Caspase-1在系統性紅斑狼瘡患者血清中的表達及意義*
董 謙,李任洲,陳 康,王偉佳
廣東省中山市人民醫院檢驗醫學中心免疫室,廣東中山 528403
系統性紅斑狼瘡(SLE)是一類臨床表現復雜,可導致多器官、系統受累的炎性自身免疫性疾病[1]。由于SLE病因尚不明確且免疫學機制極為復雜,近年來隨著固有免疫研究的逐步深入,其在SLE發病機制中的作用越來越受到重視[2]。作為固有免疫至關重要的一部分,炎性小體與多種疾病的發生有關[3]。Caspase-1是NLR家族Pyrin域蛋白3(NLRP3)炎性小體的重要組成,其一直被認為是炎癥發生過程的關鍵組分,但對于其在SLE中的表達及作用卻并未明確。本課題通過ELISA技術檢測中國漢族SLE患者血清中的Caspase-1水平,探討其在SLE中的表達及臨床意義。
1 資料與方法
1.1一般資料 選取2017年10月至2018年3月就診于中山市人民醫院的SLE患者70例作為SLE組,其中男9例、女61例,平均年齡(36.74±11.64)歲。SLE診斷符合美國風濕病學會(ACR)2009年修訂的SLE診斷標準[4]。納入同期20例健康體檢者作為健康對照組,其中男2例、女18例,平均年齡(33.50±10.48)歲。對照組血液學指標及體格檢查均無異常。兩組性別、年齡比較差異無統計學意義(P>0.05),具有可比性。
1.2方法 采集研究對象空腹靜脈血5 mL,離心后取血清,-80 ℃存放待檢。采用ELISA檢測Caspase-1 和白細胞介素(IL)-1β水平,ELISA試劑盒購自江萊生物科技有限公司,所有操作嚴格按照試劑盒說明書進行。補體C3、補體C4、總膽固醇(TC)和清蛋白采用西門子生化分析儀XN2100及配套試劑檢測,抗dsDNA抗體采用歐蒙ELISA 檢測試劑盒,檢測時儀器質控在控。
SLE患者的疾病活動度由中山市人民醫院風濕科臨床醫師采用SLE疾病活動度指數(SLEDAI評分)統計獲得。

2 結 果
2.1兩組部分實驗室指標水平比較 SLE患者C3、C4、IL-1β、Caspase-1和清蛋白水平低于健康對照組(P<0.05),抗dsDNA抗體水平高于健康對照組(P<0.05)。見表1。
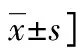
表1 兩組部分實驗室指標水平及SLEDAI評分比較[ M(P25~P75)或

組別nC3(g/L)C4(g/L)TC(mmol/L)清蛋白(g/L)健康對照組201.39±0.210.24±0.084.44±0.6545.47±1.85SLE組700.76±0.060.16±0.014.95±1.7135.92±9.81Z或t9.9102.868-1.1327.363P<0.0010.0010.560<0.001
2.2SLE患者血清Caspase-1水平與SLEDAI評分及實驗室指標的相關性分析 Spearman相關分析顯示,SLE患者血清Caspase-1 水平與C3、TC、清蛋白呈正相關(r=0.346、0.380、0.246,P<0.01),與SLEDAI評分、抗dsDNA抗體呈負相關(r=-0.301、-0.251,P<0.05)。
2.3Caspase-1對SLE的診斷效能 ROC曲線分析顯示,Caspase-1診斷SLE的曲線下面積(AUC)為0.727,95%CI為0.616~0.838,診斷SLE的最佳臨界值為62.066 pg/mL,靈敏度為0.629,特異度為0.850,Youden指數為0.479。
2.4Caspase-1對SLE疾病活動度的評估效能 ROC曲線分析顯示,Caspase-1評估SLE疾病活動度的AUC為0.674,95%CI為0.519~0.829,最佳臨界值為60.657 pg/mL,靈敏度為0.685,特異度為0.687,Youden指數為0.372。
2.5Caspase-1陽性組和陰性組SLE患者部分實驗室指標及SLEDAI評分對比 以ROC曲線得出的最佳臨界值為分界線,將血清Caspase-1>62.066 pg/mL的SLE患者設為陰性組,≤62.066 pg/mL的SLE患者設為陽性組,分別比較兩組SLE患者部分實驗室指標及SLEDAI評分,見表2。Caspase-1陽性組抗dsDNA抗體水平高于陰性組(P<0.05),而C3、C4、TC、清蛋白水平均低于陰性組(P<0.05)。
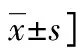
表2 Caspase-1陽性組和陰性組SLE患者部分實驗室指標及SLEDAI評分對比[ M(P25~P75)或
3 討 論
SLE是一種自身免疫性疾病,病情輕重不一,總體預后效果差,并以大量自身抗體和炎性因子生成、廣泛免疫復合物沉積為主要特點。SLE患者大都存在T、B細胞的異常活化和功能紊亂,內源性或外源性的特異性抗原刺激免疫細胞產生自身抗體,其中90%以上的患者主要產生抗核抗體。作為固有免疫至關重要的一部分,炎性小體與多種免疫相關疾病的發生和發展密切相關[5-6],在SLE致病過程中發揮了重要作用[7]。
MACIEJ等[8]研究發現缺乏NLRP3會導致小鼠嚴重狼瘡性腎炎,NLRP3可以通過限制B6lpr小鼠抗原呈遞細胞、T細胞和B細胞的擴增和活化,進而限制了自身免疫組織炎癥,從而減輕B6lpr小鼠的系統性自身免疫和狼瘡性腎炎,說明NLRP3主要對細胞免疫起免疫調節作用。ZHEN等[9]研究發現SLE患者外周血單核細胞(PBMC)中NIMA相關蛋白激酶7(NEK7)、NLRP3和ASC的mRNA和蛋白表達均顯著低于健康對照組,差異有統計學意義(P<0.05)。NEK7、NLRP3和ASC的mRNA表達與SLEDAI評分呈負相關。這些結果提示NEK7-NLRP3復合物與SLE的免疫和炎性反應密切相關。YANG等[10]通過實時定量PCR和Western Blot法研究SLE患者和健康對照者PBMC中的NLRP3、NLRP1、Caspase-1和IL-1β的mRNA和蛋白水平,結果發現與健康對照者相比,SLE患者的PBMC中NLRP3、NLRP1、Caspase-1和IL-1β的表達明顯下調。本研究結果顯示,SLE組患者血清Caspase-1水平明顯低于健康對照組,且其下游IL-1β水平也明顯降低,相關性分析發現,Caspase-1水平與C3水平呈正相關,與SLEDAI評分、抗dsDNA抗體呈負相關。通過繪制ROC曲線,以最佳臨界值把SLE患者分為Caspase-1陽性組和陰性組,結果發現,Caspase-1陽性組患者的相關實驗室指標,如C3、C4、TC和清蛋白水平均明顯下降,而抗dsDNA抗體水平明顯升高。其原因考慮與補體系統活化所致補體消耗有關,而活化的 C3、C4 參與炎性反應,可誘發自身抗體與自身抗原形成免疫復合物,大量的免疫復合物無法被機體及時清除并沉積于各器官、組織,是造成組織、器官損傷發生、發展的主要原因[11]。SLE主要是由適應性免疫的過度激活引起的,并且產生過量的活性T細胞、B細胞。據報道,一旦激活自適應免疫,就通過T細胞直接抑制NLRP3炎性小體[4]。因此,這種炎性小體的明顯下調可能與NLRP3炎性抑制作用有關。另一方面由于Ⅰ型干擾素與SLE的發生、發展密切相關[12-13],SLE患者血清中Ⅰ型干擾素水平明顯增加,而Ⅰ型干擾素可以抑制NLRP3的表達活化[14-16],從而導致NLRP3組分表達下調。
綜上所述,Caspase-1與SLE的疾病活動度具有明顯的相關性,Caspase-1對SLE的識別能力較強,具有成為SLE診斷標志物的潛力。

