應用流式細胞術檢測胃癌移植瘤小鼠脾臟中MDSC及T淋巴細胞亞群的變化
李 南,曾凡業,仝夢婷,節陽華,軒艷紅,張洪亮
(新疆醫科大學第四附屬醫院腫瘤二科,新疆 烏魯木齊 830000)
胃癌(gastric cancer)是消化道最常見的惡性腫瘤,其死亡率約占所有癌癥死亡率的20%~30%,一般患者的5 年生存率小于20%,且大多預后較差[1]。目前胃癌的致病機制尚不明確,認為腫瘤細胞可能通過促進免疫細胞凋亡或抑制其功能從而獲得免疫逃逸。傳統治療方案如手術、放療及化療未能明顯改善患者的預后生存,但隨著對胃癌生物分子學機制的不斷深入研究,腫瘤免疫治療可能為胃癌治療方案提供新的思路。髓性抑制細胞(myeloid-derived suppressor cells,MDSC)是一種異質性細胞,主要來源骨髓組細胞和未成熟髓細胞。研究發現[2,3],大量MDSC 積聚在荷瘤小鼠脾臟、血液及腫瘤組織或存在腫瘤患者的外周血及腫瘤組織中。正常的免疫應答反應是機體抵抗腫瘤細胞形成和發展的重要保護因素,其中CD8+T 細胞介導的細胞免疫反應尤為突出。在腫瘤微環境中,活化的MDSC 可通過直接或間接作用發揮免疫抑制作用,產生免疫逃逸反應,從而使腫瘤逃避機體的自身免疫監視體系,促進腫瘤發展[4]。本研究建立小鼠胃癌皮下移植瘤模型,利用流式細胞術檢測荷瘤小鼠脾臟中CD4+和CD8+T 細胞以及MDSC 和調節性T 細胞(Treg)的數量及相關比例變化,并分析其相關T 淋巴細胞的增值和凋亡反應,探討MDSC 在胃癌免疫逃逸中可能的作用機制,現報道如下。
1 材料與方法
1.1 材料
1.1.1 實驗動物 健康6~8 周齡C57BL/6J 小鼠30只,購自中國醫學科學院醫學實驗動物研究所[許可證號:scxk(京)2019-0011],在新疆醫科大學大學實驗動物中心飼養。本實驗設計經動物實驗倫理審核。
1.1.2 細胞株 小鼠前胃癌細胞株(mouse forestomach carcinona cell,MFC)購自于中科院上海生命科學院。
1.1.3 儀器及試劑 紅細胞裂解液,Fc 受體阻斷劑(2.4G2),相關流式抗體(BV421 標記大鼠抗小鼠CD25;BV605 標記大鼠抗小鼠CD8a;Alexa FluorTM647 標記大鼠抗小鼠;Foxp3 APC-cy7 標記大鼠抗小鼠CD11b。FITC 標記大鼠抗小鼠CD4;PE 標記大鼠抗小鼠Gr-1;PE-cy7 標記大鼠抗小鼠CD3),活力染料FVS510,熒光補償微球及膜聯蛋白-V(Annexin-V)凋亡染色試劑盒、5-溴脫氧尿嘧啶核苷(BrdU)細胞增殖檢測試劑盒均購自美國BD bioscience 公司。流式細胞儀為CytoFLEX 和流式數據分析軟件為Kaluza 2.0 均購自美國Beckman Coulter公司。
1.2 方法
1.2.1 造模消化 收集對數生長期的MFC 細胞,PBS洗滌2 次后,用PBS 制成細胞懸液,臺盼藍染色活細胞比例大于95%,并進行細胞計數,調整細胞濃度為1×107/ml。采用隨機數字表法將30 只小鼠分成正常組和荷瘤組,每組15 只。對小鼠右側背部皮膚進行常規酒精消毒后,荷瘤組小鼠注射取0.2 ml 的MFC 細胞懸液,正常組小鼠注射等量的生理鹽水。
1.2.2 免疫細胞表面抗原染色 腫瘤形成約2 周后采用頸椎脫臼法處死小鼠,分離脾臟并將其制成單細胞懸液,加入Fc 受體阻斷劑2.4G2,4 ℃下封閉10 min,然后加入活力染料FVS510(1∶1000 稀釋),室溫下孵育15 min。用細胞緩沖液洗滌2 遍后加入滴定的細胞表面抗體混合液,總反應體系為50 μl,4 ℃下避光孵育10 min,細胞緩沖液清洗兩遍后上機檢測。采用FMO 作為陰性對照,細胞凋亡檢測按照說明書操作。
1.2.3 細胞內染色 制備脾臟單細胞懸液,在進行細胞表面抗原染色后,染色緩沖液洗滌2 次后,加入100 μl 細胞固定/打孔液,混勻后4 ℃下避光放置20 min。2 次細胞固定/打孔緩沖液洗滌后,用100 μl細胞固定/打孔緩沖液重懸后,加入滴定的Foxp3 抗體,4 ℃下避光孵育30 min。細胞固定/打孔緩沖液洗滌2 次后上機檢測。
1.2.4 細胞增殖檢測 小鼠24 h 腹腔內注射BrdU 溶液,1 mg/只,連續注射3 d。在處死小鼠制成脾臟單細胞懸液后,先進行細胞表面染色,細胞經固定,破膜后加入DNase(1×107/ml),37 ℃下避光孵育60 min,加入熒光素標記的BrdU 單克隆抗體染色,采用流式細胞儀進行檢測分析。
1.3 統計學方法 采用SPSS 17.0 統計軟件進行數據分析,計量資料以()表示,組間比較采用t檢驗。將α=0.05 設為檢驗水準。
2 結果
2.1 胃癌MFC 荷瘤小鼠腫瘤形成情況 胃癌移植瘤接種小鼠后,第6 天可在體外觸及約黃豆大小腫塊,約第17 天后腫塊顯著增大,其與正常組小鼠相比,荷瘤組小鼠開始出現不同程度的消瘦、豎毛、蜷縮、精神萎靡、懶動、活動量減少,成瘤率為100.00%。
2.2 荷瘤小鼠脾臟中MSDC 和Treg 細胞變化 在流式數據分析中,應用4 個基本的二維散點圖以消除上樣分析樣本的碎片、死細胞,粘連體和不穩定的細胞流見圖1。與正常組相比,荷瘤組MDSC 占脾細胞的比例和數量升高,差異有統計學意義(P<0.05);荷瘤組CD3+CD4+CD25+Foxp3+Treg 細胞比例及數量較正常組升高,差異有統計學意義(P<0.05),見圖2、表1。
表1 兩組小鼠脾臟中MDSC 和Treg 細胞比例及數量比較()

表1 兩組小鼠脾臟中MDSC 和Treg 細胞比例及數量比較()

圖1 粘連體和不穩定的細胞流
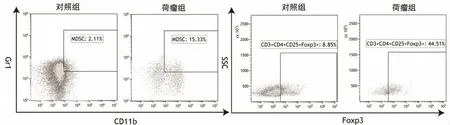
圖2 小鼠脾臟中MDSC 和Treg 細胞
2.3 荷瘤小鼠脾臟中CD4+和CD8+T 細胞變化 荷瘤組小鼠脾臟中CD4+和CD8+T 細胞所占脾細胞比例和數量低于正常組,差異有統計學意義(P<0.05),見圖3、表2。
表2 兩組小鼠脾臟中CD4+和CD8+T 細胞比例及數量比較()

表2 兩組小鼠脾臟中CD4+和CD8+T 細胞比例及數量比較()

圖3 小鼠脾臟中CD4+和CD8+T 細胞
2.4 荷瘤小鼠脾臟中CD4+和CD8+T 細胞凋亡率與增值率變化 荷瘤組CD4+T 細胞凋亡率高于正常組,但差異無統計學意義(P>0.05);荷瘤組小鼠脾臟CD8+T 細胞凋亡比例高于正常組,且CD4+和CD8+T細胞增值率低于正常組,差異有統計學意義(P<0.05),見圖4、表3。
表3 兩組小鼠脾臟中CD4+和CD8+T 細胞凋亡率與增值率比較(,%)

表3 兩組小鼠脾臟中CD4+和CD8+T 細胞凋亡率與增值率比較(,%)

圖4 小鼠脾臟中CD4+和CD8+T 細胞凋亡率與增值率
3 討論
腫瘤的發生與發展常伴隨著機體自身的免疫功能異常變化,且主要體現在各種功能性免疫細胞數量或功能的改變。體內多種免疫細胞可殺傷或清除腫瘤細胞,但傳統T 細胞仍發揮著至關重要作用,其中CD8+效應性T 細胞可釋放穿孔素或顆粒酶,分泌腫瘤壞死因子α(TNF-α)及表達膜型FasL 等機制直接殺傷腫瘤細胞,而CD4+效應性T 細胞可釋放Th1 型細胞因子,促進CD8 的細胞毒性殺傷機制[5]。然而,在機體抗腫瘤免疫應答過程中,腫瘤細胞卻能逃避機體免疫系統的攻擊或抑制傳統T 細胞免疫應答,從而導致腫瘤細胞在體內進行性生長。MDSC和Treg 細胞可發揮免疫抑制作用,其中人MDSC 定義為CD33+CD11b+HLA-DRlow/-,小鼠MDSC 定義為Gr1+CD11b+[6],而Treg 是一群細胞表面高表達CD25,胞內高表達Foxp3 轉錄因子的CD4+T 細胞亞群。腫瘤部位的MDSC 可分泌白介素-10(IL-10)和轉化生長因子-β(TGF-β)等抑制免疫應答,而Treg細胞可通過細胞直接接觸和分泌IL-35 和TGF-β等細胞因子抑制T 效應細胞增殖[7,8]。
MDSC 是免疫抑制網絡中主要的細胞群,其是由早期髓源祖細胞、非成熟粒細胞、單核細胞以及不同分化階段的樹突狀細胞組成,可存在于腫瘤患者外周血和大量積聚在荷瘤宿主外周淋巴和腫瘤組織中[6]。本研究采取MFC 小鼠背部注射制備胃癌小鼠模型,主要觀察荷瘤小鼠脾臟中各種淋巴細胞的變化,結果顯示荷瘤小鼠脾臟中MDSC 和Treg 細胞較正常組升高,而CD4+和CD8+T 細胞比例和數量卻呈下降趨勢(P<0.05),其原因可能為這兩類淋巴細胞的增殖能力明顯降低,且CD8+T 細胞的凋亡能力顯著升高。此外,MDSC 的大量增殖和激活能誘導一氧化氮合酶,精氨酸酶和活性氧的表達,從而導致精氨酸的加速分解和一氧化氮的大量合成,而精氨酸的缺乏會阻滯T 細胞的分化和增殖,且一氧化氮的積聚會抑制IL-2 受體下游信號蛋白,從而抑制T 細胞活化,并激活Fas-FasL 途徑促進T 細胞凋亡[9,10]。此外,CD8+T 細胞Fas 表達的增加,也會增強腫瘤組織MDSC 和Treg 誘導凋亡的敏感性。
總之,胃荷瘤小鼠脾臟中MDSC 和Treg 細胞比例和數量增加,而具有抗腫瘤細胞作用的CD4+和CD8+T 細胞數量降低,增殖受阻和凋亡增加,提示腫瘤形成和發展過程中機體免疫功能的復雜變化,且主要表現為抑制腫瘤作用減弱,促進腫瘤進展因素增強。因此,如何扭轉這一免疫功能變化,將會為臨床胃癌患者的治療提供新的方向,但具體免疫細胞在腫瘤微環境中所起的作用仍需進一步研究闡明。

