17β-雌二醇及補骨脂素對骨髓間充質細胞向成骨細胞分化的誘導作用
王振濤 劉金釗
摘要 目的:觀察17β-雌二醇對骨髓間充質干細胞向成骨細胞分化的誘導作用。方法:將大鼠的骨髓間充質干細胞(BMSCs)暴露于不同濃度的17β-雌二醇、補骨脂素增殖和成骨分化培養基。通過茜素紅(Alizarin Red)染色法觀察細胞增殖;通過酶聯免疫吸附試驗法(ELISA)和實時聚合酶鏈反應(PCR)評估成骨標志物Ⅰ型膠原的分泌水平以及關鍵因子RUNX2的表達情況。結果:與對照組比較,17β-雌二醇補充劑促進BMSCs增殖。BMSCs增殖添加的17β-雌二醇的不同劑量(0、0.001、0.01、0.1 nmol/L),有效地改善了骨髓間充質干細胞分泌Ⅰ型膠原的水平,RUNX2的mRNA也被上調。17β-雌二醇干預后第5天,Ⅰ型膠原表達顯著升高(P<0.05),在17β-雌二醇干預的第7天,RUNX2 mRNA及蛋白表達隨17β-雌二醇水平的增加而升高(P<0.05)。結論:17β-雌二醇聯合補骨脂素可以作為一種有效的調節劑,以提高骨髓再生中MSC的能力。
關鍵詞 骨髓間充質干細胞;17β-雌二醇;補骨脂素;成骨細胞;成骨相關基因RUNX2;細胞分化;誘導作用;Ⅰ型膠原
Abstract Objective:To observe the inducing effects of 17β-estradiol on the differentiation of bone marrow mesenchymal stem cells into osteoblasts.Methods:BMSCs from rat bone marrow were exposed to different concentrations of 17 beta-estradiol(E2) and psoralen proliferation and osteogenic differentiation media.Cell proliferation was observed by Alizarin Red staining,and the secretion of collagen type I and the expression of key factor RUNX2 were evaluated by ELISA and real-time PCR.Results:17 β-estradiol supplements promoted the proliferation of BMSCs compared with the control group.The different doses of 17 β-estradiol(0,0.001,0.01,0.1 nmol/L) added to the proliferation of BMSCs effectively improved the level of type I collagen secreted by bone marrow mesenchymal stem cells,and the mRNA of RUNX2 was also up-regulated.On the 5th after β-estradiol intervention,the expression of type I collagen was significantly increased(P<0.05).On the 7th day of 17β-estradiol intervention,RUNX2 factor mRNA and protein expression increased with the increase of 17 β-estradiol concentration(P<0.05).Conclusion:17 beta-estradiol combined with psoralen can be used as an effective regulator to improve the ability of MSCs in bone marrow regeneration.
Keywords Bone marrow mesenchymal stem cells; 17 beta estradiol; Psoralen; Osteoblast; Osteogenic related gene RUNX2; Cell differentiation; Induction; Type I Collagen
中圖分類號:R512.91文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2021.13.010
基于成體干細胞的骨組織工程現已成為臨床治療由創傷、腫瘤切除和先天性無效引起的骨骼缺損的有前景的替代方法。骨髓間充質干細胞(Bone Mesenchymal Stem Cells,BMSCs)被認為是這種方法的潛在細胞來源,因為它具有自我更新和多重分化的能力。然而,能夠可分離的骨髓BMSCs的數量非常小,并且對于骨再生的臨床應用是不充分的[1-3]。已經證明包括年齡、骨質疏松癥和關節炎在內的各種病理生理因素可進一步降低細胞數量及其增殖和分化能力。最近有報道稱,老年捐贈者骨髓中的BMSCs數量明顯低于年輕捐贈者。老年捐贈者的BMSCs衰老百分比及其復制時間顯著增加。雖然理論上BMSCs數量可以通過體外細胞培養擴增,但由于細胞衰老,操作會導致增殖和分化潛能顯著降低。因此,BMSCs增殖和成骨分化的有效改善對于基于BMSCs的骨再生的臨床應用是必需的。類固醇激素積極參與骨代謝并且在包括BMSCs的許多類型的細胞中具有多功能調節作用。例如,糖皮質激素在BMSCs的多重分化中起關鍵作用,并上調成骨、軟骨形成和脂肪形成分化潛能。在骨質疏松癥研究中,發現雌激素不僅可以預防骨吸收,還可以通過募集成骨細胞的祖細胞來增加骨形成[4-5]。最近的一項研究表明,補充17β-雌二醇可有效刺激人和小鼠BMSCs的增殖能力。17β-雌二醇還具有提高間充質干細胞(Mesenchymal Stem Cell,MSC)分化潛能的強大能力,包括成骨和成脂分化。17β-雌二醇通過雌激素受體作用調節細胞功能。最近的研究表明雌激素水平的變化是絕經后骨質疏松癥的一個重要原因[6]。此外,其他研究發現自體骨髓間充質干細胞移植可以增強骨骼強度,改善骨質疏松癥癥狀。“腎主骨生髓”理論與BMSCs成骨分化有關。《素問·陰陽應象大論》曰:“腎主骨髓,在體為骨。”《素問·宣明五氣》曰:“腎生骨髓,其充在腎。”因此,本研究通過四唑類化合物[3-(4,5-dimethylthiazol-2-yl)-5(3-carboxymethoxyphenyl)-2-(4-sulfopheny)-2H-t etrazolium,MTS]測定法測量細胞增殖,研究17β-雌二醇和補骨脂素對大鼠BMSCs增殖和分化的影響及其對大鼠BMSCs分泌Ⅰ型膠原的影響。
1 材料與方法
1.1 材料
1.1.1 動物 選擇清潔級3月齡SD大鼠12只,雌雄各半,購自解放軍軍事醫學科學院動物中心,批號:20190302。許可證號:SCXK-(軍)2020-003,動物實驗倫理審批號:20200356,動物飼養條件:環境溫度為22 ℃左右,濕度設置為40%~60%,光照周期為12 h,保持正常自由飲食。
1.1.2 藥物 1%抗生素-抗真菌劑(青霉素+鏈霉素),醫院自配,青霉素(瑞陽制藥有限公司,批號:019005),鏈霉素(山東魯抗醫藥股份有限公司,批號:018043),地塞米松(瑞陽制藥有限公司,批號:020013),β-甘油磷酸(北京智杰方遠科技有限公司,批號:019237)。
1.1.3 試劑與儀器 胎牛血清(上海素爾生物科技有限公司,貨號:10437-028),17β-雌二醇(艾美捷科技有限公司,貨號:10006315-10),補骨脂素(成都格利普生物科技有限公司,貨號:66-97-7),TRIzol試劑(北京柏萊斯特科技公司,貨號:LGTZ001),Dulbecco′s改良培養基(Dulbecco′s Modified Eagle Medium,LG-DMEM),培養基(武漢普諾賽生命科技公司,貨號:PM150210C)。電泳儀(北京六一生物科技有限公司,型號:DYCZ-20H),聚合酶鏈反應(Polymerase Chain Reaction,PCR)儀(賽默飛世爾科技公司,美國,型號:NEW VeritiPro)。
1.2 方法
1.2.1 分組與模型制備 12只清潔級SD大鼠通過CO2吸入實施安樂死。無菌條件下取其來自脛骨和股骨的骨髓,用不含17β-雌二醇等類固醇的培養基沖洗骨髓腔以洗脫髓腔內細胞。以上所述培養基由不含酚紅的α-MEM培養基、10%活性炭剝離的胎牛血清和1%抗生素-抗真菌劑(青霉素+鏈霉素)組成。將細胞以5×107個細胞/100 mm培養皿接種,并在37 ℃,5% CO2中與不含17β-雌二醇等類固醇的培養基一起溫育。在第3天,通過培養基更換去除未附著的細胞來分離MSC。將MSC孵育至80%的濃度,然后以106個細胞/100 mm培養皿的密度進行傳代培養。檢測細胞CD44、CD90、CD105均呈陽性表達,而CD34、CD45呈陰性表達,鑒定為BMSCs。使用雄性和雌性大鼠的第一部分骨髓間充質干細胞(Passage-1 Bone Mesenchymal Stem Cells,Passage-1 BMSCs)研究17β-雌二醇對BMSCs增殖的功能。將1 000個傳代的BMSCs細胞放入96孔板的每個孔中,分為4組,每組250個,分別暴露于補充不同劑量的無類固醇培養基(0.001、0.01、0.1 nmol/L)的17β-雌二醇和補骨脂素。分別記作對照組、0.1 nmol/L 17β-雌二醇和補骨脂素處理組、0.01 nmol/L17β-雌二醇和補骨脂素處理組及0.001 nmol/L 17β-雌二醇和補骨脂素處理組。
1.2.2 干預方法 對照組不進行藥物干預處理,而對0.1 nmol/L 17β-雌二醇和補骨脂素處理組、0.01 nmol/L 17β-雌二醇和補骨脂素處理組及0.001 nmol/L 17β-雌二醇和補骨脂素處理組分別給予對應劑量的17β-雌二醇和補骨脂素處理,在第7天,使用茜素紅S染色法(Alizarin Red Staining)觀察細胞增殖,所有步驟均按照說明書嚴格操作。
1.2.3 檢測指標與方法 1)實時熒光定量聚合酶鏈反應(Real-time Polymerase Chain Reaction,RT-PCR)測定Runt相關轉錄因子(Runt-related Transcriptional Factor 2,RUNX2) mRNA表達:實時PCR用于量化細胞因子RUNX2的基因在誘導3、5、7 d后的表達情況。使用總RNA提取試劑(TRIzol)試劑從BMSCs提取總RNA,并使用純化PCR產物法(QIAquick PCR Purication Kit)純化。用DNAse I使用第一鏈cDNA合成試劑盒和隨機六聚體引物逆轉錄反應得到cDNA。使用熒光定量PCR試劑盒(SYBR Green PCR Master Mix)進行定量實時PCR。選用甘油醛-3-磷酸脫氫酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH)作為內參。RUNX2、GAPDH基因引物序列見表1。反應體系見表2。反應參數:95 ℃ 35 s,35個循環(95 ℃ 35 s,55 ℃ 40 s,72 ℃ 35 s),72 ℃延伸10 min。計算Ct值,得到反應的擴增曲線,計算不同誘導天數BMSCs中細胞因子RUNX2 mRNA相對表達量,產物1.5%瓊脂糖凝膠電泳分析。2)BMSCs細胞中Ⅰ型膠原的水平與RUNX2蛋白的測定:將傳代-1雄性和雌性大鼠BMSCs以105個細胞/100 mm培養皿的密度接種。在70%的濃度下,將培養基更換為補充有不同濃度17β-雌二醇(0.001、0.01、0.1 nmol/L)的成骨分化培養基。成骨分化培養基由補充有100 nmol/L地塞米松,10 mmol/L β-甘油磷酸和0.05 mmol/L的Dulbecco改良培養基(LG-DMEM)組成。成骨誘導液培養3、5、7 d后,收集各組上清液,根據說明書,用酶聯免疫吸附試驗(Enzyme Linked Immunosorbent Assay,ELISA)試劑盒測量大鼠BMSCs分泌Ⅰ型膠原的水平。蛋白質印跡法(Western Blotting)檢測RUNX2蛋白的表達。
1.3 統計學方法 采用SPSS 20.0統計軟件對實驗數據進行分析,用單因素方差分析進行樣本間比較,測量結果以均數±標準差(±s)表示。各組間的兩兩比較采用LSD-t檢驗,以P<0.05為差異有統計學意義。
2 結果
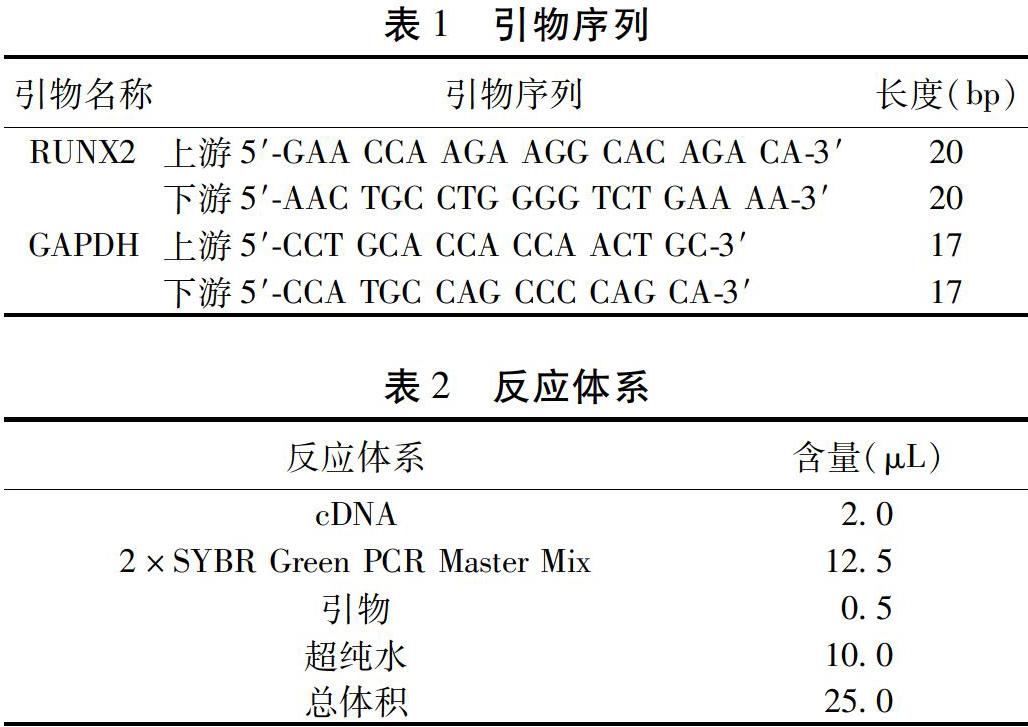
2.1 原代大鼠BMSCs的培養、誘導與形態觀察 將大鼠BMSCs接種培養48 h后換液,可觀察到單核細胞多以圓形形態生長,有的細胞呈長梭形,似成纖維細胞,胞質內顆粒較多。見圖1A。使用含有0.001 nmol/L 17β-雌二醇的誘導后可見多個散在分布的、大小形態不均一的棕色鈣化結節。見圖1B。
2.2 17β-雌二醇和補骨脂素對大鼠BMSCs分泌Ⅰ型膠原的影響 與對照組比較,第3天時,17β-雌二醇和補骨脂素不同劑量處理組對大鼠BMSCs分泌Ⅰ型膠原影響的差異均無統計學意義;第5天時,Ⅰ型膠原分泌量較對照組顯著提高,不同劑量17β-雌二醇和補骨脂素處理組較對照組均正相關(P<0.05);在第5天和第7天時,17β-雌二醇和補骨脂素對Ⅰ型膠原的分泌具有劑量依賴性。見表3。
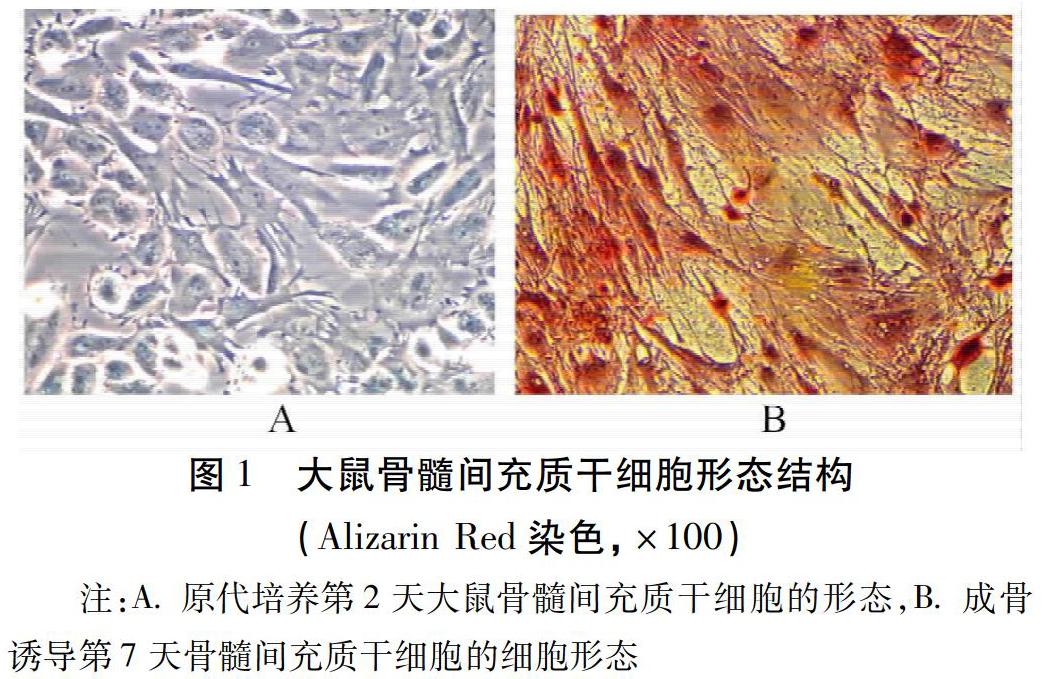
2.3 17β-雌二醇和補骨脂素對大鼠BMSCs RUNX2因子蛋白表達的影響 誘導第7天時,RUNX2蛋白表達升高。見圖2~3。
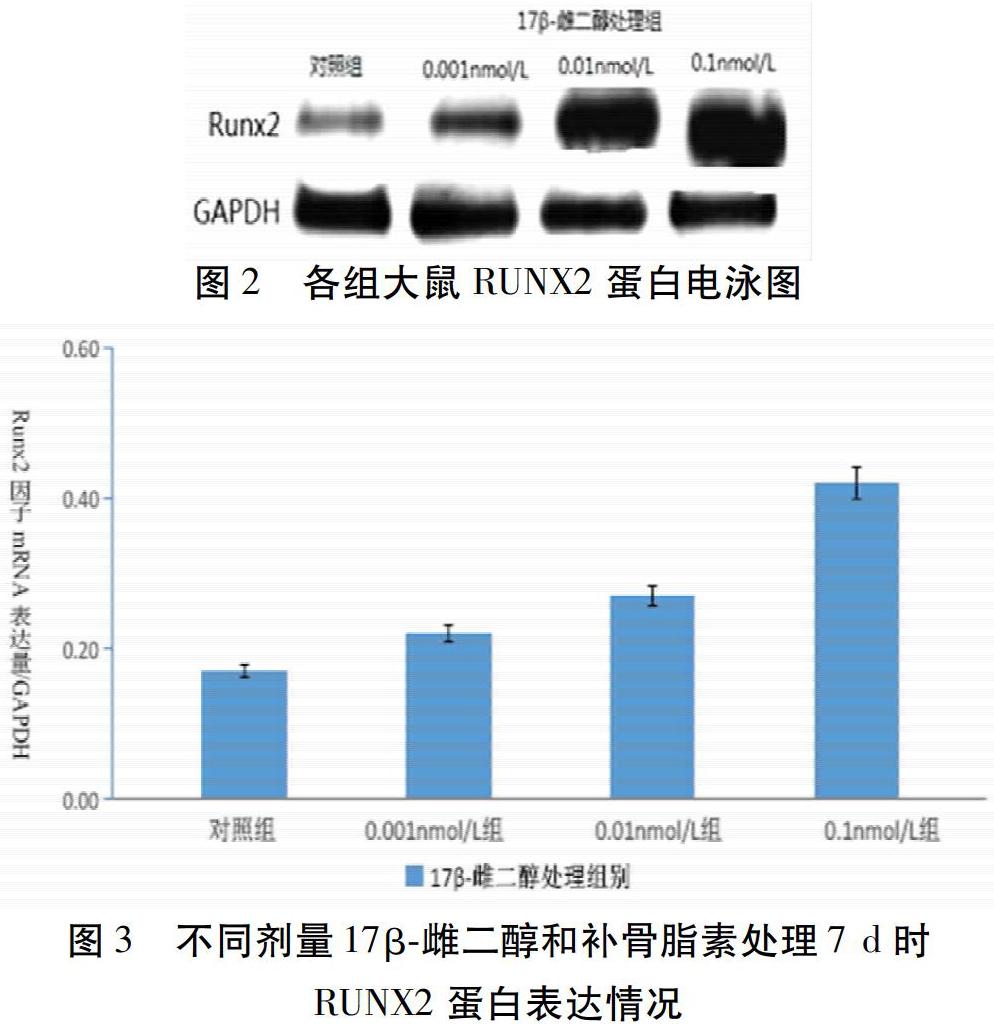
2.4 17β-雌二醇和補骨脂素對大鼠BMSCs RUNX2 mRNA表達的影響 BMSCs增殖添加的17β-雌二醇和補骨脂素的不同劑量(0、0.001、0.01、0.1 nmol/L),有效地改善了骨髓間充質干細胞分泌Ⅰ型膠原的水平,RUNX2的mRNA也被上調。17β-雌二醇干預后第5天,Ⅰ型膠原表達顯著升高(P<0.05),干預第7天,RUNX2 mRNA及蛋白表達隨17β-雌二醇劑量的增加而升高(P<0.05)。見圖4~5。
3 討論
限制骨髓MSC作為骨組織工程有希望的細胞來源的障礙是有限的細胞供應和降低的分化潛能。MSC增殖和分化的有效改善在確定基于MSC的骨再生的成功臨床應用中起關鍵作用。最近已經證明類固醇可以增加MSC的增殖和分化,并延緩衰老[7-9]。本研究表明,17β-雌二醇促進MSC增殖和成骨分化。17β-雌二醇顯著改善了成骨分化期間成骨生長因子的合成。這些數據有力地表明17β-雌二醇可能作為有效的調節劑起作用,以提高MSC再生骨髓的能力。此外,本研究首次證明了17β-雌二醇調節骨髓間充質干細胞的性別差異。類固醇的最佳劑量和改善MSC增殖和成骨潛力的相互作用,有效地根據MSC供體的性別而變化。17β-雌二醇受體,成骨標志物和細胞因子之間的關系也是性別依賴性的。這些結果為將來改善和優化MSC成功骨再生能力提供了重要信息;但是,該機制需要進一步研究。最近在成人干細胞研究文獻中已經注意到干細胞的性別差異[10-14]。有研究發現從雌性小鼠分離的肌源性干細胞(Muscle-derived Stem Cells,MDSCs)比從雄性小鼠分離的MDSCs具有更高的骨骼肌再生效率[15]。從雄性小鼠分離的MDSCs具有比從雌性小鼠分離的MDSCs更強的成骨潛能和骨再生[16-17]。還發現從雄性分離的人脂肪來源的干細胞比從雌性分離的那些更具成骨性[18]。雖然這種機制很少被討論,但其中一個可能的因素是17β-雌二醇受體的性別差異,這些受體在干細胞增殖和分化中起關鍵作用。
目前的研究表明,17β-雌二醇對MSC具有很強的促有絲分裂作用[19-20]。17β-雌二醇的作用是雙相的,并且17β-雌二醇在高劑量下失去功能甚至抑制細胞增殖。發現17β-雌二醇對雌性大鼠MSC具有更多的促有絲分裂功能,而雌激素和地塞米松的組合對雄性大鼠MSC具有更多的促有絲分裂功能。低水平的雌激素和地塞米松對雄性大鼠MSC增殖具有協同作用。同樣,在地塞米松存在下,雌二醇的補充有效地改善了MSC的成骨分化;然而,最大限度地上調成骨標志物的劑量具有性別差異。較低劑量的17β-雌二醇上調ALP峰值活性,這是雌性MSC成骨分化的早期標志,而不是雄性。然而,與雌性MSC比較,成熟的成骨細胞標志物骨鈣素(Osteocalcin,OCN)的峰值出現在雄性MSC的17β-雌二醇劑量較低的情況下。在雄性和雌性中產生峰值OCN量的17β-雌二醇劑量與BMP-7表達的水平一致。后者與雄性和雌性大鼠MSC中的類固醇受體高度相關。因此,我們認為MSC在成骨分化期間與17β-雌二醇補充的性別差異可能是由類固醇受體的變化引起的。本研究中多種類固醇受體之間的關系也顯示了雄性和雌性MSC之間的差異。這也表明類固醇受體的差異可能是成骨分化中性別二態性的原因。
類固醇激素在細胞和組織代謝中相互作用。糖皮質激素和雌激素已經被證明可以交互作用于它們的受體并調節骨髓細胞。據報道雌二醇(E2)在成骨分化期間增加雌激素受體α(Estrogen Receptor α,ERα),而在雌性小鼠MSC中不增加ERα[21]。在本研究中,我們發現17β-雌二醇補充劑不僅可以上調ERα,還可以上調雄性和雌性供體的MSC的糖皮質激素受體(Glucocorticoid Receptor,GR)和雄激素受體(Androgen Receptor,AR)。E2還上調雄性供體的MSC的ERα,而對雌性MSC的作用較少。ERα的變異與雄性和雌性MSC中的ER,GR和AR水平高度相關。ER與雄性MSC中的GR和AR相關,與雌性MSC中的GR無關。這表明雌激素受體β(Estrogen Receptor β,ERβ)可能在用E2補充劑處理的雄性和雌性MSC的成骨分化中起不同作用。
據報道,雌激素可通過上調成骨生長因子的數量來增加骨髓細胞的成骨分化,包括骨形成蛋白(Bone Morphogenetic Protein,BMP)-2,BMP-6和轉化生長因子-β1(Transforming Growth Factor-beta 1,TGF-β1)[22]。本研究表明,17β-雌二醇補充劑可有效上調雄性和雌性MSC中TGF-β1的表達。上調的TGF-β1與MSC的堿性磷酸酶(Alkaline Phosphatase,ALP)高度相關。此外,首次探索E2在MSC的成骨分化過程中有效上調BMP-7的作用。BMP-7已被廣泛認為是骨再生的成骨蛋白。BMP-7的功能包括骨形成和癌細胞增殖,是產生雌激素依賴的關鍵環節。在本研究中,BMP-7的mRNA被17β-雌二醇補充劑上調,并且在成骨分化期間與雄性和雌性大鼠MSC中的類固醇受體高度相關。這表明E2增加成骨分化的機制之一可能是通過上調BMP-7。骨碎補能有效地促進BMSCs增殖和骨向分化,上調TGF-β1、BMP-2的表達量可能是其作用機制之一,并由此影響其在骨髓中的增殖和分化,使干細胞具有遷移歸巢的特性。雖然目前使用的成骨標志物包括ALP和OCN肯定會影響MSC的成骨潛能,但它們不是MSC骨形成能力的可靠預測因子。因此,需要在體外和體內定量測量MSC的骨形成,以進一步證實MSC的類固醇調節功能。
本研究初步揭示了成骨分化過程中成骨細胞和類固醇受體相關基因表達的相關性。然而,未來使用基因敲除技術和開展拮抗劑的研究對于進一步證明這一點是必要的。17β-雌二醇和補骨脂素具有促進MSC增殖和分化的作用,并且RUNX2參與了該調控過程。
參考文獻
[1]黃慶雷,魏曉飛.間充質干細胞免疫調節的可塑性[J].中國科學:生命科學,2016,46(7):799-808.
[2]連寶濤,徐景利,郭震浪,等.葛根素注射液聯合西藥常規治療心力衰竭療效的Meta分析[J].中國實驗方劑學雜志,2016,22(4):189-194.
[3]宋寶全.人間充質干細胞成脂分化調控機制的研究[D].北京:北京協和醫學院,2016.
[4]何曉清.Wnt3a/5a信號在TLR4調控MSC向成骨細胞分化成熟中的作用及機制研究[D].重慶:第三軍醫大學,2016.
[5]劉關羽,何衛陽,朱鑫,等.氧化應激誘導自噬對骨髓間充質干細胞增殖與凋亡的影響[J].中國病理生理雜志,2015,31(12):2176-2182.
[6]劉曉光,肖衛華,趙淋淋,等.間充質干細胞移植治療骨骼肌損傷的研究進展[J].中國康復醫學雜志,2015,30(12):1313-1317.
[7]曾建春,曾意榮,樊粵光,等.淫羊藿甙誘導MSCs向成骨細胞分化過程中對Wnt信號通路的影響[J].廣州中醫藥大學學報,2014,31(4):607-611,678.
[8]楊麗,朱曉峰,王攀攀,等.淫羊藿水提取物對大鼠骨髓間充質干細胞骨向分化的影響及其機制[J].中草藥,2013,44(22):3182-3187.
[9]門通,樸善花,滕春波.Hippo信號通路轉錄效應因子TAZ/YAP對間充質干細胞分化的調控[J].遺傳,2013,35(11):1283-1290.
[10]劉海全,秦佳佳,吳倩.淫羊藿對骨質疏松MSCs成脂分化PPARγ mRNA表達的影響[J].中藥新藥與臨床藥理,2013,24(4):382-385.
[11]武密山,趙素芝,任立中,等.川續斷皂苷Ⅵ誘導大鼠骨髓間充質干細胞向成骨細胞方向分化的研究[J].中國藥理學通報,2012,28(2):222-226.
[12]Deal C.Potential new drug targets for osteoporosis[J].Nat Clin Pract Rheumatol,2009,5(1):20-27.
[13]Lozo P,Krpan D,Krvavica A,et al.Bone histology in postmenopausal osteoporosis--variations in cellular activity[J].Acta Med Croatica,2004,58(1):5-11.
[14]Duque G.Bone and fat connection in aging bone[J].Curr Opin Rheumatol,2008,20(4):429-434.
[15]Tuli R,Tuli S,Nandi S,et al.Characterization of multipotential mesenchymal progenitor cells derived from human trabecular bone[J].Stem Cells,2003,21(6):681-693.
[16]Leskel HV,Olkku A,Lehtonen S,et al.Estrogen receptor alpha genotype confers interindividual variability of response to estrogen and testosterone in mesenchymal-stem-cell-derived osteoblasts[J].Bone,2006,39(5):1026-1034.
[17]Wang Z,Goh J,Das De S,et al.Efficacy of bone marrow-derived stem cells in strengthening osteoporotic bone in a rabbit model[J].Tissue Eng,2006,12(7):1753-1761.
[18]Sekiya I,Larson BL,Smith JR,et al.Expansion of human adult stem cells from bone marrow stroma:conditions that maximize the yields of early progenitors and evaluate their quality[J].Stem Cells,2002,20(6):530-541.
[19]Kadowaki A,Tsukazaki T,Hirata K,et al.Isolation and characterization of a mesenchymal cell line that differentiates into osteoblasts in response to BMP-2 from calvariae of GFP transgenic mice[J].Bone,2004,34(6):993-1003.
[20]Hong L,Sultana H,Paulius K,et al.Steroid regulation of proliferation and osteogenic differentiation of bone marrow stromal cells:a gender difference[J].J Steroid Biochem Mol Biol,2009,114(3-5):180-185.
[21]Mizuno M,Kuboki Y.Osteoblast-related gene expression of bone marrow cells during the osteoblastic differentiation induced by type I collagen[J].J Biochem,2001,129(1):133-138.
[22]Sammons J,Ahmed N,El-Sheemy M,et al.The role of BMP-6,IL-6,and BMP-4 in mesenchymal stem cell-dependent bone development:effects on osteoblastic differentiation induced by parathyroid hormone and vitamin D(3)[J].Stem Cells Dev,2004,13(3):273-280.
(2019-02-14收稿 責任編輯:王明)

