生物轉化技術在中藥和天然藥物開發中的應用進展
程思佳 李順祥


摘要 生物轉化技術具有選擇性強、催化效率高、反應條件溫和、反應種類多以及環境污染小等特點,該項技術應用于中藥和天然藥物開發的研究越來越多,可以為現代藥物原料提供新的工藝或新替代品,對發掘中藥活性成分、擴大藥源、保護中藥資源等有著重要意義。現以國內外最新研究報道為依據,分析了生物轉化技術應用于中藥和天然藥物開發的意義,對轉化反應的生物體系,其主要反應類型以及生物轉化的影響因素進行總結,為進一步研究提供思路與方法。
關鍵詞 生物轉化;中藥;天然產物;還原反應;水解反應;氧化反應;羥基化反應;糖基化反應
Abstract Biotransformation has strong selectivity,high catalytic efficiency,mild reaction conditions,various reaction types and less environmental pollution properties,and was increasingly applied in Chinese medicinal and natural drugs,which provides a new technolo or substitute for modern pharmaceutical raw materials.It is of great significance in exploring active ingredients,expanding resources and protecting resources of Chinese medicinal.Based on the latest research at home and abroad,the paper analyzes the significance of biotransformation technology for the development of Chinese medicinal,summarizes the biological system of transformation reaction,its main reaction types and the influencing factors of biological transformation,and provides ideas and methods for further research.
Keywords Biotransformation; Chinese medicinal; Natural product; Reduction reaction; Hydrolysis reaction; Oxidation reaction; Hydroxylation; Glycosylation reaction
中圖分類號:R284.3文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2021.13.025
中醫藥是中華民族的瑰寶,從古至今為中國乃至全世界人民的健康事業做出了不可磨滅的貢獻。但隨著人口增加,中藥市場的需求急劇增加,而野生中藥資源供不應求,栽培藥材品質參差不齊,存在藥材品質欠佳、藥物活性成分含量不穩定、生物利用度低等問題,對我國中醫藥事業的發展產生嚴重威脅。因此,中藥及天然藥物的新型開發,對促進中醫藥現代化、國際化具有重大意義[1-2]。生物轉化技術因諸多優點而逐漸被許多研究者重視,現對該技術在中藥和天然藥物中的應用情況進行綜述,以期為其如何更好地作用于中藥和天然藥物資源的開發與利用提供參考。
1 生物轉化技術
生物轉化(Biotransformation),又稱生物催化(Biocatalysis),是指利用生物體系或生物體系的相關酶制劑對外源性底物進行改造或結構修飾所發生的生理生化反應[3]。它比傳統的化學合成更經濟、更安全、更具區域選擇性和立體選擇性,能夠得到一些用傳統合成化學方法很難制備的生物活性化合物[4-6]。由此可見,生物轉化具有生成新化合物或更有效地生產已知化合物的巨大潛力。
目前,用于轉化研究的生物體系主要有真菌、細菌、藻類、植物懸浮細胞、組織或器官以及動物細胞、組織等,其中應用最多的是植物細胞懸浮培養體系和微生物體系。
由于植物細胞中存在許多特異性功能酶,通過選擇合適的植物細胞、反應條件和底物,利用細胞懸浮培養進行生物轉化,可以獲得活性先導化合物[7-8]。近年來,利用植物細胞懸浮培養進行生物轉化的研究日漸增多,有研究利用成熟的細胞懸浮培養體系對底物作用的多樣性,對一些生物利用度低的天然化合物和部分人工合成的活性化合物進行生物轉化,獲得了具有較好活性的衍生物——熊果苷[9-10]。另外,微生物種類繁多、分布廣、繁殖快、易變異、對自然環境的變化具有極強的適應能力、含酶豐富等特點使得微生物轉化系統能快速穩定地實現生物活性物質的生產,而且微生物遺傳操作的方法早已確立。Muthukumar等[11]將蕨類植物蜈蚣草的肌動蛋白催化基因轉至土壤農桿菌中,將富含砒霜的孢子作為底物加入轉化體系,進行了穩定表達。人參二醇皂苷以微生物體系為主進行的生物轉化產物已被證實具有抗癌、抗炎、抗過敏以及神經保護和肝保護作用等藥理活性[12]。目前,利用微生物轉化天然藥物是近年來研究的熱點之一,其來源的廣泛性為天然藥物轉化進一步產業化提供了可能性,值得深入研究。
1.1 生物轉化中常見的反應類型
用于生物轉化的各生物體系均能使多種化合物發生不同的反應,其中主要涉及羥基化、水解、氧化、還原、糖基化等幾類化學反應。我們可以通過對這些反應的研究來尋找具有生物活性的衍生物,也可以通過對促進這些反應發生的酶的研究為產業化進程做準備。見表1。
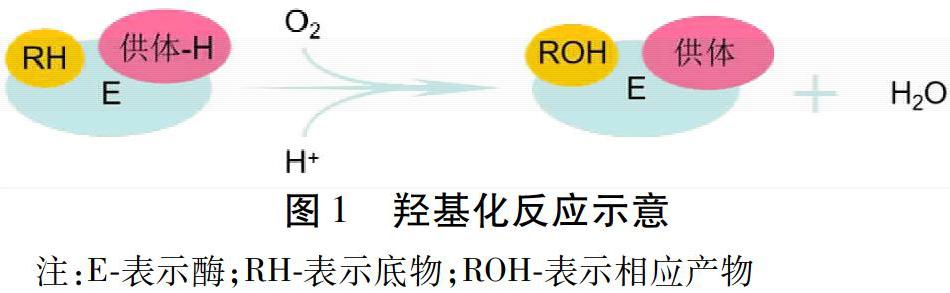
1.1.1 羥基化反應 羥基化反應在生物轉化中最為常見,目前可在底物某一位置或多個位置引入羥基,生成多種有意義的衍生物。見圖1。克服了傳統有機化學方法難以準確高效安全羥基化的瓶頸。此外,在羥基化反應中扮演重要角色的羥基化酶具有特異性,可以立體選擇、專一地對底物進行羥基化,得到特定高活性成分或新化合物來增加藥物療效。人類最早對羥基化反應的關注始于Mason等[13]和Hayaishi等[14]對有機底物分子通過羥基化酶的作用結合氧生成氫氧化物的報道。生物轉化中進行羥基化反應的酶類型見表2。1952年,Morray和Pereroon首次從黑根霉中將黃體酮轉化為11α-羥基黃體酮,將研究者的注意力轉向了生物轉化和藥物合成的結合。其中,細胞色素P450酶系在合成活性物質的羥基化反應中扮演著重要角色,能夠介導甾體的羥基化反應,而甾體類化合物在脂肪代謝、糖代謝、蛋白質合成、礦物質合成等方面發揮著重要的作用[15]。這些酶參與了植物次生代謝中的大部分羥基化反應,如24-亞甲基膽固醇經細胞色素P450酶催化的氫酰化反應合成了多種烯醇類化合物,大約有14個細胞色素P450酶基因參與了紫杉醇途徑[16-18]。羥基化反應在中藥和天然藥物開發中的應用見表3。
1.1.2 水解反應 常見于糖苷類、蛋白質及多肽、酯類等中藥和天然藥物的水解作用,尤其是糖苷類。目前國內外對人參皂苷和薯蕷皂苷水解反應研究最多,對大豆皂苷和甘草皂苷水解反應的研究次之,對齊墩果烷型五環三萜皂苷的研究相對較少。許多研究者通過生物轉化途徑改變皂苷的糖鏈結構來避免物理法和化學法水解皂苷糖苷鍵對生態環境的破壞。另外,通過生物水解酶體系,可特異有效地水解糖類、蛋白質及多肽等大分子物質,使原本被視為雜質的組分重新產生活性而得以利用。雖然現在大部分生物轉化水解反應還處于較初級的篩選和發現階段,但只要通過優化反應條件和優化克隆酶的基因等手段,發揮生物轉化的長處,一定能更好地將其應用于中藥和天然藥物的研發。見表4。
1.1.3 氧化反應 當前對氧化反應的研究主要集中于羥基氧化、羰基氧化、環氧化等方面。環氧化反應在轉化的過程中也很普遍,多發生在化合物的雙鍵部位,尤其在菇類中常見,除環氧化反應,雙鍵部位也很容易形成鄰二醇結構[40]。最具代表性的便是沒藥醇在炭疽病毒作用下生成的幾種代謝產物的表現。另外,環氧化反應生成的手性化合物的中間體在手性藥物的研究中起重要作用。不對稱環氧化反應的研究與發展能對手性藥物的有效性和安全性提供基礎保障,以及更經濟和更安全的用藥條件。見表5。
1.1.4 還原反應 目前報道的還原反應有羰基還原、雙鍵還原等。還原酮和醛中的羰基可以制備手性醇,生成新的手性中心,其在生物轉化中應用廣泛,對藥物化學的發展具有重要意義[41]。利用還原酶催化進行還原反應與傳統化學方法進行還原相比具有高效、環保等顯著優勢。手性醇可以用來合成多種手性藥物,發現和發展新型、高效的不對稱還原催化,是極具前景的研究,其對于手性藥物的制備也是至關重要的。見表6。
1.1.5 糖基化反應 常見的外源化合物中易發生糖基化的官能團有羥基、氨基、羧基、甲氧基等,主要的轉化體系為植物懸浮細胞。而微生物體系內相應催化酶的缺乏,大多靠克隆外源基因構建工程菌來完成糖基化反應。糖基化通常是天然產物生物合成的最后一個環節,其實質上是糖基轉移酶或糖苷轉移酶參與的高專一性反應。糖基化產物具有高穩定性、高水溶性和低細胞毒性等特點,能讓藥效更好地發揮,為藥物的生產和開發助力。見表7。
1.2 生物轉化體系對中藥和天然藥物的影響
1.2.1 擴大藥源,為新藥開發提供基礎 生物轉化技術因其對外源底物作用的多樣性、反應的強選擇性和高效性,可以應對目前天然活性成分在中藥和天然藥物中含量低、結構復雜、合成困難等難題,緩解需求巨大的市場壓力,為高品質的中藥和天然藥物走向現代化和國際化提供保障。近期有許多學者對發揮藥用價值的活性成分進行研究,Fischer等[52]研究發現含H6H基因同源物的工程菌能使低山莨菪堿-6β-羥化酶在東莨菪堿生物合成中的活性大幅度提高。孫敏鴿等[53]利用黑曲霉將莪術醇轉化為抗流感、呼吸道合胞病毒和單純皰疹病毒作用更強的3α-羥基莪術醇。蘇玲等[54]利用人參-靈芝共發酵過程的復雜反應類型,將原人參二醇型及原人參三醇型人參皂苷轉變為稀有人參皂苷Rg3、20S-Rg3、Rf。為了進一步滿足醫藥市場對活性物質的需求,有學者對生物轉化產路進行了研究,如郭雙雙等[55]利用菌種HQ-10產生的β-葡萄糖醛酸酶對黃芩進行發酵,獲得了超過原藥材5倍以上的黃芩素提取率。為了解決青蒿素有效活性基團過氧橋的不穩定性、無法在酮基以外的部位進行結構轉化的難題,有研究者將生物轉化技術應用在青蒿素的開發利用上,從發酵產物中分離得到了16個轉化產物,并通過結構鑒定確定其中10個為新化合物[56]。
1.2.2 減小不良反應,優化生產工藝 由于部分中藥存在有效成分穩定性差、水溶性低、生物利用度低、不良反應強等問題,嚴重限制了其應用,故對這些有效成分加以結構轉化或修飾,對改善其性質意義重大。羥基化反應一般會在底物某一位置或多個位置引入羥基,可以改變底物極性,能有效改善藥物水溶性。李銳等[57]發現,利用華根霉將雙脫甲氧基姜黃素進行微生物轉化成雙脫甲氧基姜黃素-O-葡萄糖苷,不僅增加了其水溶性,并增強了其抗腫瘤活性,大大提高了其生物利用度。葉敏[58]利用連格孢霉對華蟾毒精進行轉化,利用羥基化、脫氫、脫乙酰基反應得到了6種羥基化和乙酰基產物,大大降低了華蟾毒精的毒性,還增加了其藥效。孫鵬等[59]利用黑曲霉對附子進行生物轉化,利用酯化反應降低了烏頭堿含量,得到一種毒性較小的苯甲酰烏頭原堿,提高了附子的藥用價值。
1.2.3 作為體外模型,輔助藥物代謝研究 Reighard和楊金銘[60]于1974年提出了“哺乳動物藥物代謝的微生物代謝模型”理論。該理論建立在真菌與哺乳動物均為真核生物、其代謝機制所設計的酶系具有相似性的基礎上。因此,這一研究領域的開啟,為預測藥物代謝和建立體外藥物毒性代謝模型提供了良好平臺[61]。目前有關人體腸內菌群對天然產物的轉化作用報道較多,其中有研究發現腸內菌群也可以在體外幫助皂苷成分轉化為易被吸收的苷元,再對其進一步利用,從而提高藥物的生物利用度[62]。有研究利用人腸內菌群模型對藥物代謝進行了深入研究,為入胃藥的體內代謝研究提供了豐富的研究基礎[63-72]。
2 小結
由此可見,生物轉化體系中強大且多樣的生物酶體系可克服傳統研究方法難以實現的化學結構改造或修飾的難題,以更低廉的成本得到自然界含量稀少的物質或具有活性的新穎化學結構,以此擴大藥源選擇范圍以促進中藥新藥的開發。酶體系對原活性物質的結構改造或修飾,大幅度擴大了高活低毒活性物質的篩選范圍,有望從根本上解決某些藥物的毒性問題,為中藥活性成分的應用拓寬了道路,更為新藥開發和應用奠定了良好基礎。目前微生物模型在中藥活性物質代謝方面的應用研究報道較少,但近幾年生物信息學的快速發展,加上微生物代謝模型低成本、好調控和多樣性等優點,其在活性、毒性評測以及活性物質代謝研究上的作用十分可期。
3 討論
生物轉化技術的應用,為傳統中藥和天然藥物研究提供了良好的機會和方法。目前取得的許多創新性成果也得到了廣泛認同和高度肯定。但是生物轉化技術在國內的研究大部分仍處于實驗室研究階段,欲將其運用于工業化大生產仍需克服許多技術問題。面對這一境況,我們需要對轉化機制和轉化體系進行系統化認知,對各學科知識進行整理和融合,結合現代科學技術對其進行深入研究。生物轉化技術在中藥領域的應用前景十分廣闊,我們應該將二者有效結合,加快推進中藥現代化進程,為我國傳統中藥文化走向世界做出貢獻。
參考文獻
[1]劉金花,魏建文,劉貴銀.中藥資源可持續發展的現狀與未來[J].世界最新醫學信息文摘,2019,19(9):32-33.
[2]胡之璧.中藥生物技術與中藥資源的可持續發展[J].上海中醫藥大學學報,2012,26(2):5-8.
[3]Loughlin WA.Biotransformations in organic synthesis[J].Bioresource Tech,2000,74(1):49-62.
[4]Ward OP,Young CS.Reductive biotransformations of organic compounds by cells or enzymes of yeast[J].Enzyme Microb Technol,1990,12(7):482-493.
[5]de Carvalho CC,da Fonseca MM.Biotransformation of terpenes[J].Biotechnol Adv,2006,24(2):134-142.
[6]Bicas JL,Dionísio AP,Pastore GM.Bio-oxidation of terpenes:an approach for the flavor industry[J].Chem Rev,2009,109(9):4518-4531.
[7]Cordell GA,Lemos TLG,Monte FJQ,et al.Vegetables as chemical reagents[J].J Nat Prod,2007,70(3):478-492.
[8]Matsuda T,Yamanaka R,Nakamura K.Recent progress in biocatalysis for asymmetric oxidation and reduction[J].Cheminform,2009,20(5):513-557.
[9]唐婕妤,羅月芳,彭菲,等.水培益母草轉化對苯二酚生成熊果苷的研究[J].中藥材,2017,40(1):42-45.
[10]羅月芳,唐婕妤,彭菲,等.益母草懸浮細胞系的建立及轉化外源氫醌生成熊果苷研究[J].中國中醫藥信息雜志,2019,26(2):80-83.
[11]Muthukumar B,Joyce BL,Elless MP,et al.Stable transformation of ferns using spores as targets:Pteris vittata and Ceratopteris thalictroides[J].Plant Physiol,2013,163(2):648-658.
[12]Yang XD,Yang YY,Ouyang DS,et al.A review of biotransformation and pharmacology of ginsenoside compound K[J].Fitoterapia,2015,100:208-220.
[13]Mason HS,Fowlks WL,Peterson EW.Oxygen transfer and electron transport by the phenolase complex[J].J Am Chem Soc,1955,77(10):2914-2915.
[14]Hayaishi O,Katagiri M,Rothberg S.Mechanism of the pyrocatechase reaction[J].J Am Chem Soc,1955,77(20):5450-5451.
[15]徐艷紅,楊欣,張爭,等.白木香3-羥基-3-甲基戊二酰輔酶A還原酶基因AsHMGR2的克隆及表達分析[J].藥學學報,2013,48(6):953-959.
[16]Coon M J.Cytochrome P450:nature′s most versatile biological catalyst[J].Annu Rev Pharmacol Toxicol,2005,45(1):1-25.
[17]Hatlestad GJ,Sunnadeniya RM,Akhavan NA,et al.The beet R locus encodes a new cytochrome P450 required for red betalain production[J].Nat Genet,2012,44(7):816-820.
[18]Morant M,Bak S,Moller BL,et al.Plant cytochromes P450:tools for pharmacology,plant protection and phytoremediation[J].Curr Opin Biotechnol,2003,14(2):151-162.
[19]Dai ZR,Ning J,Sun GB,et al.Cytochrome P450 3A Enzymes Are Key Contributors for Hepatic Metabolism of Bufotalin,a Natural Constitute in Chinese Medicine Chansu[J].Front Pharmacol,2019,10:52.
[20]Putkaradze N,Knig L,Kattner L,et al.Highly regio-and stereoselective hydroxylation of vitamin D2 by CYP109E1[J].Biochem Biophys Res Commun,2020,524(2):295-300.
[21]Fischer C,Kwon M,Ro D,et al.Isolation,expression and biochemical characterization of recombinant hyoscyamine-6β-hydroxylase from Brugmansia sanguineatuning the scopolamine production[J].Med Chem Comm,2018,9(5):888-892.
[22]Tamaki S,Kato S,Shinomura T,et al.Physiological role of β-carotene monohydroxylase(CYP97H1) in carotenoid biosynthesis in Euglena gracilis[J].Plant Sci,2019,278:80-87.
[23]Singh P,Kapkoti D S,Singh N,et al.Biotransformation of artemisinic acid by the fungus Trichothecium roseum and anti-candidal activity of its metabolites[J].Biocatal Biotransfor,2019,37(4):1-6.
[24]孫莉,錢生勇,冒小平,等.苦參堿衍生物的生物轉化制備及其抗腫瘤活性研究[J].藥學與臨床研究,2017,25(1):24-26.
[25]顧湘,倪美鑫,冒小平,等.氧化苦參堿衍生物的生物轉化制備及其抗腫瘤活性研究[J].西北藥學雜志,2017,32(6):711-714.
[26]Le C,Jian WD,Li XZ,et al.An improved water-soluble/stereospecific biotransformation of aporphine alkaloids in Stephania epigaea to 4R-hydroxyaporphine alkaloids by Clonostachys rogersoniana[J].Process Biochem,2016,51(8):933-940.
[27]王磊,龍秀鋒,肖青,等.一株10-羥基喜樹堿轉化內生菌的篩選及鑒定[J].生物技術,2014,24(1):80-85.
[28]Li L,Rong XL,Min Y,et al.Microbial metabolism of evodiamine by Penicilliuim janthinellum and its application for metabolite identification in rat urine[J].Enzyme Microb Tech,2006,39(4):561-567.
[29]駱健美,宋霆,朱鳳芝,等.赭曲霉轉化洋地黃毒苷的工藝優化和產物活性分析[J].天然產物研究與開發,2015,27(3):398-403.
[30]Kumar V,Bharate SS,Vishwakarma RA.Modulating lipophilicity of rohitukine via prodrug approach:Preparation,characterization,and in vitro enzymatic hydrolysis in biorelevant media[J].Eur J Pharm Sci,2016,92:203-211.
[31]Guang TC,Min Y,Shao JN,et al.Microbial transformation of 20(S)-protopanaxadiol by Absidia corymbifera.Cytotoxic activity of the metabolites againsthuman prostate cancer cells[J].Fitoterapia,2013,84(9):6-10.
[32]Kan S,Li J,Huang W,et al.Microsphere resin chromatography combined with microbial biotransformation for the separation and purification of salvianolic acid B in aqueous extract of roots of Salvia multiorrihza Bunge[J].J Chromatogr A,2009,1216(18):3881-3886.
[33]Cheng Q,Liu G,Zhang P,et al.Lipase-catalyzed hydrolysis of(R,S)-2,3-diphenylpropionic methyl ester enhanced by hydroxypropyl-β-cyclodextrin[J].Biotechnol Prog,2018,34(6):1355-1362.
[34]Dong J,Lei C,Lu D,et al.Direct Biotransformation of Dioscin into Diosgenin in Rhizome of Dioscorea zingiberensis by Penicillium dioscin[J].Indian J Microbiol,2015,55(2):200-206.
[35]Hou J,Xue J,Wang C,et al.Microbial transformation of ginsenoside Rg3 to ginsenoside Rh2 by Esteya vermicola CNU 120806[J].World J Microbiol Biotechnol,2012,28(4):1807-1811.
[36]Su JH,Xu JH,Yu HL,et al.Properties of a novel β-glucosidase from Fusarium proliferatum ECU2042 that converts ginsenoside Rg3 into Rh2[J].J Mol Catal B Enzym,2009,57(1-4):278-283.
[37]張星.三類活性天然產物—蟾蜍甾烯、姜黃素、土荊皮乙酸類化合物的生物轉化研究[D].沈陽:沈陽藥科大學,2011.
[38]Kumar D,Dubey KK.An efficient process for the transformation of betulin to betulinic acid by a strain of Bacillus megaterium[J].3 Biotech,2017,7(3):157.
[39]Choudhary MI,Batool I,Khan SN,et al.Microbial transformation of oleanolic acid by Fusarium lini and alpha-glucosidase inhibitory activity of its transformed products[J].Nat Prod Res,2008,22(6):489-494.
[40]Fraga BM,González P,Hernández MG,et al.Microbial transformation of 18-hydroxy-9,13-epi-ent-pimara-7,15-diene by Gibberella fujikuroi[J].J Nat Prod,2003,66(3):392-397.
[41]Sultana N,Saify ZS.Enzymatic biotransformation of terpenes as bioactive agents[J].J Enzyme Inhib Med Chem,2013,28(6):1113-1128.
[42]Zhu X,Pang C,Cao Y,et al.Biotransformation of Cholesterol and 16α,17α-Epoxypregnenolone and Isolation of Hydroxylase in Burkholderia cepacia SE-1[J].Biomed Res Int,2016,2016:5727631.
[43]Chaves MRB,Moran PJS,Rodrigues JAR.Regio-and enantioselective bioreduction of methyleneketoesters using both polymeric resin and cellulose matrix[J].J Mol Catal B:Enzym,2013,98:73-77.
[44]章雅琴.生物氧化-還原反應生產(R)-扁桃酸及其衍生物[D].杭州:浙江工業大學,2013.
[45]Ferreira D A,Assuno J C C,D E Lemos T L G,et al.Asymmetric reduction of acetophenone derivatives by Lens culinaris[J].Biocatalysis,2012,30(5-6):469-475.
[46]Dymarska M,Grzeszczuk J,Urbaniak M,et al.Glycosylation of 6-methylflavone by the strain Isaria fumosorosea KCH J2[J].PLoS One,2017,12(10):e0184885.
[47]Camila RP,Eduardo AS,Raquel AS,et al.Microbial transformation of β-blapachone to its glycosides by Cunninghamella elegans ATCC 10028b[J].Phytochem Lett,2013,6(4):657-661.
[48]朱鐵梁,延慧君,郝素云,等.梅林青霉對熊果酸的微生物轉化研究[J].中草藥,2014,45(4):476-479.
[49]Grech-Baran M,Sykowska-Baranek K,Krajewska-Patan A,et al.Biotransformation of cinnamyl alcohol to rosavins by non-transformed wild type and hairy root cultures of Rhodiola kirilowii[J].Biotechnol Lett,2014,36(3):649-656.
[50]Lim CG,Wong L,Bhan N,et al.Development of a Recombinant Escherichia coli Strain for Overproduction of the Plant Pigment Anthocyanin[J].Appl Environ Microbiol,2015,81(18):6276-6284.
[51]王碧霞,徐德宏,譚朝陽,等.小葉女貞糖基轉移酶基因的克隆和原核表達研究[J].中國中藥雜志,2018,43(4):704-711.
[52]Fischer C,Kwon M,Ro DK,et al.Isolation,expression and biochemical characterization of recombinant hyoscyamine-6β-hydroxylase from Brugmansia sanguinea-tuning the scopolamine production[J].Medchemcomm,2018,9(5):888-892.
[53]孫敏鴿,趙倩,陳麗霞,等.黑曲霉(AS 3.739)對莪術醇的生物轉化及條件優化[J].沈陽藥科大學學報,2013,30(3):226-231.
[54]蘇玲,劉舒,劉志強,等.人參-靈芝共發酵過程中產物的抗氧化活性及其成分變化規律研究[J].食品與發酵科技,2016,52(6):41-46,65.
[55]郭雙雙,程林,楊利民,等.黃芩葡萄糖醛酸水解酶基因的克隆、生物信息學分析及表達[J].中國中藥雜志.2015,40(22):4370-4377.
[56]馬偉光,張超.生物轉化的核心技術——天然藥物發酵的研究進展[J].云南中醫學院學報,2004,27(3):55-57.
[57]李銳,劉芳,李蕓香,等.微生物轉化法制備雙脫甲氧基姜黃素糖苷化產物及其對HepG2腫瘤細胞的抑制作用[J].食品與發酵工業,2016,42(6):20-25.
[58]葉敏.華蟾毒精和蟾毒靈的生物轉化研究[D].北京:北京大學,2003.
[59]孫鵬,李玲,吳麗,等.基于生物轉化的附子減毒增效考察[J].中國實驗方劑學雜志,2012,18(22):16-19.
[60]Reighard JB,楊金銘.哺乳動物代謝的微生物模型[J].國外醫學:藥學分冊,1987,(2):75-76.
[61]Srisilam K,Veeresham C.Biotransformation of drugs by microbial cultures for predicting mammalian drug metabolism[J].Biotechnol Adv,2003,21(1):3-39.
[62]Wang XM,Li XB,Peng Y.Impact of Qi-invigorating traditional Chinese medicines on intestinal flora:A basis for rational choice of prebiotics[J].Chin J Nat Med,2017,15(4):241-254.
[63]楊秀偉,張建業,徐嵬,等.山柰苷的人腸內細菌生物轉化研究[J].藥學學報,2005,40(8):717-721.
[64]楊秀偉.中藥實驗醫學研究中的關鍵基礎科學問題——從腸內細菌生物轉化確定中藥有效和有毒化學成分[J].中西醫結合學報,2005,3(2):154-159.
[65]楊秀偉.基于中藥化學成分體內過程的中藥有效成分和有效效應成分及有毒成分的發現策略[A].中國植物學會藥用植物和植物藥專業委員會.第六屆全國藥用植物和植物藥學術研討會論文集[C].中國植物學會藥用植物和植物藥專業委員會:中國植物學會,2006.
[66]楊秀偉,張建業,徐嵬.羅漢果皂苷Ⅲ的人腸內細菌生物轉化[J].北京大學學報:醫學版,2007,39(6):657-662.
[67]楊秀偉,徐嵬.中藥化學成分的人腸內細菌生物轉化模型和標準操作規程的建立[J].中國中藥雜志,2011,36(1):19-26.
[68]楊秀偉.人參化學成分的藥物代謝動力學研究[J].中國現代中藥,2016,18(1):16-35.
[69]Zhang LQ,Yang XW,Zhang YB,et al.Biotransformation of phlorizin by human intestinal flora and inhibition of biotransformation products on tyrosinase activity[J].Food Chemistry,2012,132(2):936-942.
[70]Yang XW,Wang N,Li W,et al.Biotransformation of 4,5-O-dicaffeoylquinic acid methyl ester by human intestinal flora and evaluation on their inhibition of NO production and antioxidant activity of the products[J].Food Chem Toxicol,2013,55:297-303.
[71]Ran L,Wu S,Xu W,et al.Biotransformation of naringin by human intestinal flora[J].J Chin Pharm Sci,2013,22(4):329-333.
[72]楊鑫,叢博,王如峰,等.人腸內菌轉化模型的穩定性研究[J].中藥材,2015,38(5):923-927.
(2020-11-17收稿 責任編輯:吳珊,徐穎)

