膠質瘤細胞外泌體通過miR-125b對細胞增殖凋亡的影響
劉彥廷,孫 拯,王壯壯,龔 偉,馬金陽,田春雷
膠質瘤是中樞神經系統常見的惡性腫瘤之一,目前臨床上多采用手術+放化療等綜合治療為主,但患者復發率極高,整體預后差。膠質瘤細胞可分泌一種直徑約40~100 nm細胞外膜性囊泡,即外泌體,不僅可作為細胞間的通信載體,還可通過攜帶miRNAs調控腫瘤細胞的增殖凋亡。目前發現,miR-125b與膠質瘤組織惡性程度存在相關性,可通過抑制下游靶基因,調控膠質瘤細胞的增殖凋亡。如:miR-125b可通過抑制DNA損傷DRAM2、P53和P38等靶基因,改變腫瘤細胞的增殖活性。該研究擬通過提取膠質瘤細胞的外泌體,將其與U251細胞共培養,觀察外泌體能否通過miRNAs調控膠質瘤細胞增殖凋亡,為該領域的研究提供新的實驗依據。
1 材料與方法
1.1 材料與儀器
人膠質瘤細胞U251與人星型膠質細胞購于南方醫科大學神經病學研究實驗室細胞庫,RT-PCR試劑盒購于日本TaKaRa公司,CCK-8試劑盒購于美國Sigma公司;兔抗人CD63、CD9和phalloidin單克隆抗體均購于美國Cell Signaling Technolog公司,β-actin單克隆抗體購于上海康成生物公司;胎牛血清、培養基購于美國Gibco公司;PKH67購于德國默克公司,Annexin-V/ Propidium Iodide試劑盒購自廣州康眾生物有限公司,RPMI1640和胎牛血清購自廣州益龍科技有限公司。共聚焦顯微鏡(德國萊卡公司),H-7600電子顯微鏡(日本日立)。2%磷鎢酸購自美國Sigma,TRIzol LS試劑(Invitrogen,CA,USA)。1.2 細胞培養與外泌體的提取
人源性膠質瘤細胞U251或人星型膠質細胞置于RPMI 1640 培養基中常規培養,添加青霉素100 U/ml,鏈霉素100 μg/ml降低細胞污染,設定培養箱參數為37 ℃、95%飽和濕度,5% CO培養箱,每2~3天更換1次培養基,常規培養細胞72 h后,提取細胞上清液,4 ℃下完成離心操作,依次275 r/min離心8~10 min,提取離心管內上清液,1 836 r/min離心15 min,提取離心管內上清液,3 000 r/min離心30 min,用0.22 μm濾器過濾后,24 000 r/min離心60 min,去除離心管內上清液,用1 ml PBS吹打混勻管底,凍存于-80 ℃冰箱。1.3 透射電鏡觀察外泌體形態
外體重懸液置于涂有碳涂層的300網銅網格上,然后在室溫下干燥5 min,用2%磷鎢酸滴染色10 min。采用H-7600電子顯微鏡觀察樣品形態,納米顆粒跟蹤分析(NTA)評估分離的外泌體直徑分布。1.4 Western blot
實驗設U251細胞外泌體組和U251細胞去外泌體上清液組(對照組),總蛋白提取后,用SDS-PAGE將等載量的提取蛋白分離,然后轉移到聚偏二氟乙烯膜上。用5%脫脂牛奶封閉膜3 h,然后依次加入CD9、CD63和β-actin蛋白抗體(1 ∶1 000)4 ℃孵育過夜。PBS沖洗后滴加二抗(1 ∶2 000),室溫下溫育2 h。滴加化學發光試劑(ECL)2 min,使用Chemi DocMP顯現。1.5 免疫熒光染色
細胞PBS沖洗后,依次加入多聚甲醛溶液固定,0.1% Tirton X-100,BSA溶液封閉,按預設時間間隔加入PKH67熒光標記(綠色)(1 ∶100稀釋),phalloidin抗體(1 ∶100稀釋),U251細胞外泌體采用PKH67熒光標記(綠色),U251細胞質用phalloidin染色,避光條件下孵育1 h,DAPI染核3 min,PBS沖洗后取出細胞爬片,封片,熒光顯微鏡下觀察。運用激光共聚焦顯微鏡采集圖像。圖像采用Image Pro軟件分析。1.6 細胞增殖活力檢測
取處于對數生長期細胞,配置密度為1×10/ml細胞懸液,于96孔板中每孔加入單細胞懸液100 μl,空白孔加入等量的培養基,置于37 ℃、恒定飽和濕度、 5% CO培養箱中孵育,分別于培養第0、24、48、72及96 小時加入10 μl CCK-8溶液,繼續孵育3~4 h后,置于酶標儀用450 nm單波長測吸光度值(OD值),實驗重復3次,繪制細胞生長曲線。1.7 流式細胞儀檢測細胞凋亡
取對數生長期細胞,以2×10個/孔接種在6孔板上。按實驗設計分組培養后胰酶消化收集處理,PBS清洗后70%冷乙醇固定,離心洗滌后采用Annexin-V/ Propidium Iodide試劑盒檢測細胞凋亡比例。1.8 MiRNAs基因篩選
選擇國內外文獻報道,已通過miRNAs基因芯片證實與U251膠質瘤細胞增殖凋亡相關20個miRNAs作為篩選目標:miR-4726-5p、miR -1255b-2-3p、miR -340-5p、miR -4275、miR -4712-3p、miR -576-5p、miR -1299、miR -4268、miR -3591-5p、miR -626、miR -3169、miR-374a、miR-590-3p、miR-374b、miR-29c、miR-125b、miR-221、miR-10a、miR-32和miR-138。1.9 MiR-125b NC、mimics、inhibitor質粒轉染
實驗分對照組:轉染陰性對照組(negative control,NC)、miR-125b mimics組和miR-inhibitor組。miR-125b NC、mimics和inhibitor質粒載體由上海吉瑪生物制藥有限公司構建,將質粒載體轉染后,采用胰酶收集細胞,重懸沉淀后用細胞培養液將細胞密度調至5×10個/ml,接種于6孔板中培養。1.10 RT-PCR
參照TRIzol試劑說明書操作提取細胞總RNA,鑒定RNA濃度及純度。采用RT-PCR試劑盒,按照上面反應體系進行cDNA的合成逆轉錄反應體系。ABI Prism7500型熒光定量 PCR儀中擴增,以內參U6進行標準化,采用2法計算基因的相對表達量。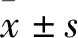
2 結果
2.1 膠質瘤細胞源性外泌體的鑒定
透射電子顯微鏡結果顯示:膠質瘤U251細胞上清液提取出外泌體顆粒具有雙側膜結構(圖1A),納米顆粒跟蹤分析顯示:外泌體的尺寸分布約為100 nm直徑(圖1B)。Western blot顯示:外泌體組特異性外泌體標記蛋白CD9和CD63含量高于對照組(去外泌體細胞上清液)(圖1C)。結果表明,外泌體成功地從細胞上清液中分離出來。
圖1 膠質瘤細胞源性外泌體的鑒定A:電鏡下外泌體形態(×50 000,紅色箭頭);B:外泌體徑粒分析;C:外泌體標志性蛋白CD63和CD9表達量
2.2 U251細胞攝取外泌體情況
在U251細胞培養基中分別加入濃度為100 μg/ml的外泌體懸液30 μl(外泌體組)或等量不含外泌體培養基(對照組),共聚焦熒光顯微鏡結果顯示:外泌體組U251細胞內可見PKH67熒光標記,對照組(細胞上清液)細胞內未見PKH67熒光標記(圖2)。
圖2 熒光顯微鏡下U251細胞攝取外泌體情況 ×400DAPI:U251細胞核;PKH67:外泌體;FITC-phalloidin:U251細胞質;Merge:合圖
2.3 外泌體影響U251細胞增殖凋亡
分別將外泌體懸液30 μl(濃度為100 μg/ml)或無外泌體培養基30 μl(對照組)加入U251細胞共培養,流式細胞術結果顯示:外泌體組細胞凋亡比例為(6.03±0.15)%,低于對照組(18.34±4.07)%(t
=17.207,P
<0.01)(圖3A)。CCK-8結果顯示:外泌體組細胞增殖活性在72 h(t
=9.398,P
<0.01)及96 h(t
=6.025,P
<0.01)時間點高于對照組對應時間點(圖3B),差異有統計學意義(P
<0.05)。
圖3 外泌體對U251細胞增殖凋亡的影響A:流式細胞法檢測細胞凋亡(Q2+Q3)比例;B:CCK-8檢測細胞在450 nm處吸光度值,與對照組比較:*P<0.05
2.4 膠質瘤細胞源性外泌體內miRNA的鑒定
按“1.8項下方法”選擇的20個miRNAs,RT-PCR結果顯示:U251細胞外泌體中miR-125b、miR-221、miR-374a、miR-138和 miR-4712等含量高于人星型膠質細胞外泌體。其中miR-125b倍數差異性最高(圖4),差異有統計學意義(t
=38.322,P
<0.01)。
圖4 RT-PCR檢測miRNAs相對表達量與人星型膠質細胞外泌體比較:*P<0.05
2.5 外泌體通過miR-125b調控膠質瘤細胞的增殖凋亡
分別將miR-NC、miR-125b mimics或miR-125b inhibitor轉染U251細胞后提取外泌體,RT-PCR結果顯示:miR-NC組外泌體miR-125b水平高于miR-125b inhibitor組(t
=2.533,P
=0.039),低于miR-125b mimics組(t
=21.103,P
<0.01)(圖5A)。將提取的外泌體與U251細胞共培養,CCK-8結果顯示:在72 h及96 h時間點,miR-NC組細胞增殖活性低于miR-125b mimics組(72 h,t
=2.486,P
=0.038)(96 h,t
=2.636,P
=0.030),高于miR-125b inhibitor組(72 h,t
=2.938,P
=0.028)(96 h,t
=2.815,P
=0.021)(圖5B)。流式細胞術結果顯示miR-NC組細胞凋亡比例為(14.33±3.06)%,高于miR-125b mimics組(7.12±1.27)%(t
=4.132,P
=0.003),低于miR-125b inhibitor組(32.75±5.41)%,差異均有統計學意義(t
=6.198,P
<0.01)(圖5C)。
圖5 外泌體通過miR-125b調控膠質瘤細胞的增殖凋亡A:RT-PCR檢測miR-125b相對表達量,與miR-NC組比較:*P<0.05,**P<0.01;B:CCK-8檢測細胞在450 nm處吸光度值,與miR-125b mimics比較:*P<0.05;與miR-125b inhibitor組比較:#P<0.05;C:流式細胞法檢測細胞凋亡(Q2+Q3)比例
3 討論
研究發現,外泌體是細胞外囊泡的常見類型,可作為蛋白質、RNAs和其他生物活性分子載體,參與膠質瘤細胞間的信號傳導,進而改變受體細胞的增殖、凋亡等。Spinelli et al發現人內皮細胞外泌體通過干擾膠質瘤干細胞的增殖及分化,促使膠質瘤干細胞保持多向分化能力及腫瘤特性。Hao et al發現星型膠質瘤細胞外泌體通過抑制受體細胞PTEN蛋白,促進腫瘤細胞增殖,減少細胞自然狀態下的凋亡比例。此外,Zhou et al總結指出,巨噬細胞、星型細胞等,均可通過外泌體完成細胞間的信號傳導,觸發反饋循環通路。本研究中發現,將膠質瘤細胞外泌體與腫瘤細胞共培養后,可增加細胞增殖活性;流式細胞術發現,外泌體與U251細胞共培養后,細胞晚期凋亡比例明顯降低,提示外泌體可調控細胞增殖凋亡活性。
在膠質瘤細胞微環境中,外泌體miRNAs是多種生理和病理條件下的細胞調節因子,通過激活和(或)抑制不同的信號通路,在膠質瘤增殖凋亡過程中發揮重要作用。如Yue et al提出,低氧條件下膠質瘤細胞外泌體通過miR-301a,靶向抑癌基因轉錄延伸因子A樣蛋白7,激活Wnt/catenin信號通路,調控膠質母細胞瘤的增殖活性。Yang et al發現膠質瘤細胞外泌體可通過miR-221,抑制受體細胞發動蛋白(DNM3),促進細胞增殖。本研究對比人星型膠質細胞外泌體與膠質瘤細胞外泌體發現,多個miRNAs出現差異性表達,如miR-125b、miR-221、miR-10a、miR-32等,提示外泌體可根據細胞源性不同,調整RNAs轉錄。但同時也發現,PCR結果與以往文獻報道存在差異性,推測其可能原因是:miRNAs必須通過RNA結合蛋白RBPs運輸到多囊泡體,最終裝載到外泌體并從質膜分泌。在不同細胞源性及微環境下,外泌體中Argonaute 2蛋白的缺失程度不同,或外泌體miRNAs降解程度不一,均可導致miRNAs水平出現差異性變化。
研究發現,miR-125b在多個腫瘤細胞中表達含量明顯升高,其對應的靶基因眾多,覆蓋細胞增殖、分化、遷移、凋亡、細胞周期和耐藥等,但其作用存在差異性。如Zheng et al發現急性淋巴細胞白血病和低分化非小細胞肺癌中,miR-125b作為腫瘤增殖和細胞周期調控的抑制因子,通過調控NF-κB信號通路發揮作用。而Huang et al在膠質瘤細胞中發現,miR-125b的上調可激活Wnt通路,同時促進STAT3和NF-κB信號通路活性。此外,神經氨酸酶1、DRAM2、P53和P38均是miR-125b的直接靶點,miR-125b對下游靶基因的抑制程度直接影響細胞增殖活性。在本研究中,外泌體內miR-125b含量較高,明顯高于其他RNAs,將外泌體懸液與miR-125b inhibitor共同加入細胞共培養后,可逆轉外泌體對細胞增殖凋亡的影響,提示外泌體對膠質瘤細胞增殖凋亡的調控作用,主要依賴miR-125b。此外,本研究中,miR-125b促進膠質瘤細胞增殖,抑制凋亡,推測miR-125b可能通過P53和P38蛋白發揮作用。
本研究的局限性在于僅在U251細胞株進行驗證,在其他膠質瘤細胞株中的結果尚未證實;此外,外泌體是否可通過長鏈非編碼RNA、mRNAs或蛋白質等發揮作用仍需要進一步論證。

