抑制芳香烴受體表達促進人臍帶間充質干細胞的增殖和軟骨分化
王新偉,趙英杰,李素素,王越業(yè),賈成艷,常 艷,魏 偉
人臍帶間充質干細胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)可以從嬰兒臍帶組織中獲得,具有良好的多向分化潛能,相較于其他來源間充質干細胞(mesenchymal stem cells,MSCs)成軟骨分化能力更強,并且臍帶組織臨床上取材方便,所以hUC-MSCs目前被廣泛用于軟骨組織工程中。芳香烴受體(aryl hydrocarbon receptor,AhR)屬于Per-Arnt-Sim同源域家族成員蛋白,是一種配體激活的核轉錄因子,可被污染物、微生物、食物和新陳代謝等提供的小分子活化。AhR參與許多重要的生物學過程,如細胞遷移和細胞分化并影響骨骼發(fā)育。已有研究表明AhR參與調控MSCs的成脂和成骨分化能力,但對其成軟骨分化能力的影響還不清楚。基于以上研究背景,該研究使用小干擾RNA方法抑制hUC-MSCs中AhR的表達,觀察AhR敲低后hUC-MSCs增殖以及成軟骨分化能力的變化。
1 材料與方法
1.1 材料
hUC-MSCs由南京康雅生物科技有限公司提供;DMEM-F12培養(yǎng)基和軟骨分化誘導培養(yǎng)基購自以色列BI公司;胎牛血清購自澳大利亞Science Cell公司;AhR-homo-1432 inhibitor 轉染試劑、Lipofectamine2000及Opti-MEM購自上海吉凱基因生物科技有限公司;實時熒光定量PCR試劑盒和引物分別購自南京諾唯贊生物科技股份有限公司和上海生工生物股份有限公司;SOX-9和COL2A1抗體購自美國Santa Cruz公司;CCK-8檢測試劑盒購自合肥鼎秀生物科技有限公司;阿利新藍染色試劑購自武漢賽維爾生物科技有限公司;CD34、CD45、CD73和CD105流式抗體購自美國BioLegend公司;BCA蛋白含量檢測試劑盒購自上海碧云天生物科技有限公司。1.2 主要儀器
Tecan Infinite M 1000 PRO酶標儀(瑞士Tecan);Olympus顯微成像系統(tǒng)(日本Olympus);FC 500型貝克曼流式細胞儀(美國Beckman Coulter);7500熒光定量PCR儀(美國Thermo Fisher Scientific);LAS 4000 Mini型化學發(fā)光成像分析儀(美國GE Healthcare Life Sciences)。1.3 實驗方法
1.3.1
hUC-
MSCs的表面分子標記物檢測 采用流式細胞儀檢測細胞表面分子標記物,取貼壁hUC-MSCs,0.25%胰酶消化重懸至1.5×10/ml,各管分別加入單克隆抗體 CD34、CD45、CD70和CD105,同時每管樣品設立同型陰性對照。室溫避光孵育45 min,用 PBS 洗去未結合抗體并重懸細胞,流式細胞儀進行檢測分析。1.3.2
質粒轉染hUC-
MSCs 用Opti-MEM稀釋AhR-homo-1432 inhibitor 轉染試劑及Lipofectamine2000,然后將轉染試劑稀釋液分別與Lipofectamine2000稀釋液混合,當細胞融合度為30%時加入轉染試劑混合液,37 ℃、5% CO條件下培養(yǎng)6 h后更換新鮮培養(yǎng)基繼續(xù)培養(yǎng)。同法轉染AhR-homo-1432 inhibitor control設為陰性對照組。1.3.3
細胞增殖能力檢測 將hUC-MSCs以細胞密度為3.0×10個/孔接種于96孔板中培養(yǎng),分為Control、si-NC和si-AhR組,每組設定6個副孔。按照上述方法轉染細胞,細胞轉染成功后繼續(xù)培養(yǎng)用于CCK-8實驗,每組檢測4個時間點:第1、3、5和7天,λ=450 nm,測定OD值,繪制細胞生長曲線。1.3.4
誘導hUC-
MSCs成軟骨分化 將hUC-MSCs以細胞密度為1.0×10個/孔接種于24孔細胞板中培養(yǎng),分為Control、si-NC和si-AhR組,每組設定3個副孔。按照上述方法轉染細胞,細胞轉染成功后繼續(xù)培養(yǎng)至細胞匯集度為80%,更換軟骨分化誘導培養(yǎng)基培養(yǎng)7 d,3 d換一次液,用于下一步實驗。1.3.5
RNA提取、cDNA合成及實時熒光定量PCR 各組hUC-MSCs軟骨誘導分化培養(yǎng)7 d后,使用TRIzol試劑分別提取各組細胞總RNA,用HiScript?II Reverse Transcriptase試劑盒合成cDNA。配置實時熒光定量PCR反應體系,AceQ qPCR SYBR Green Master Mix 10 μl,DEPC水6.8 μl,上下游引物和50×ROX Reference Dye 1各0.4 μl,cDNA模板2 μl,體系總體積20 μl。置于美國賽默飛公司7500熒光定量PCR儀上進行反應,檢測AhR、SOX-9和COL2A1的mRNA表達,si-NC組細胞作為陰性對照,GAPDH作為內參。所用引物均由上海生工生物工程公司設定,見表1。
表1 實時熒光定量PCR引物序列
1.3.6
Western blot 各組hUC-MSCs軟骨誘導分化培養(yǎng)7 d后,棄去培養(yǎng)基并用PBS清洗,在24孔板每孔中加入適量的含有蛋白酶抑制劑的蛋白裂解液,冰上裂解30 min。將細胞刮下,收集于1.5 ml EP管并反復凍融,使細胞充分裂解。4 ℃、12 000 r/min離心15 min,取上清液。根據(jù)說明書,使用BCA蛋白濃度檢測試劑盒對蛋白進行定量。在提取的上清液中加入蛋白上樣緩沖液煮沸后得到蛋白樣本。SDS-聚丙烯酰胺凝膠電泳法將蛋白轉移至PVDF上,用5%的脫脂牛奶封閉2 h,與相應一抗4 ℃孵育過夜,與二抗結合2 h后,通過發(fā)光成像分析儀顯影。1.3.7
阿利新藍染色 各組hUC-MSCs軟骨分化誘導7 d后,棄去培養(yǎng)基并用PBS清洗,在24孔細胞板中每孔加入4%中性甲醛固定30 min,然后加入阿利新藍染色液染色30 min,PBS清洗后鏡下觀察。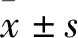
2 結果
2.1 hUC-MSCs鑒定
流式細胞儀檢測hUC-MSCs表面分子標記物CD34、CD45、CD73和CD105的表達。其中CD34表達0.6%,CD45表達1.5%,二者均呈陰性表達(陰性率<5%),CD73表達99.8%,CD105表達99.2%,二者均呈陽性表達(陽性率>95%),這與MSCs的特點相符(圖1)。
圖1 流式細胞儀檢測hUC-MSCs表面分子標記物表達
2.2 hUC-MSCs轉染效率
顯微鏡下觀察可發(fā)現(xiàn)hUC-MSCs大多以多角形或梭形為主,細胞大小均一,胞質豐富,胞核大且核仁清晰。與Control組比較,轉染后第5天的hUC-MSCs形態(tài)無變化。實時熒光定量PCR測定轉染效率結果表明:與Control組比較,si-NC組AhR的mRNA表達差異無統(tǒng)計學意義(P
>0.05);而與si-NC組比較,si-AhR組AhR的mRNA表達明顯降低(F
=8.658,P
<0.05)。Western blot測定轉染效率結果表明:與Control組比較,si-NC組AhR的蛋白表達差異無統(tǒng)計學意義(P
>0.05);而與si-NC組比較,si-AhR組AhR的蛋白表達明顯降低(F
=6.798,P
<0.05)。以上結果說明轉染AhR-homo-1432 inhibitor可以有效沉默hUC-MSCs中的AhR表達(圖2~4)。
圖2 正常hUC-MSCs與轉染后hUC-MSCs ×100A:Control組;B:si-NC組;C:si-AhR組
2.3 AhR干擾后hUC-MSCs的增殖反應
CCK-8測定結果顯示轉染后第1天起,si-NC組hUC-MSCs的細胞活力與Control組比較差異無統(tǒng)計學意義;而si-AhR組hUC-MSCs的細胞活力與si-NC組比較有升高,且在第5天和第7天差異有統(tǒng)計學意義(F
=7.449,P
<0.05;F
=6.414,P
<0.05)。見圖5。
圖3 轉染后hUC-MSCs的AhR mRNA表達與si-NC組比較:*P<0.05

圖4 轉染后hUC-MSCs的AhR蛋白表達A:Western blot檢測β-actin和AhR的表達;B:根據(jù)A的結果進行條帶灰度分析;與si-NC組比較:*P<0.05

圖5 AhR干擾后hUC-MSCs的細胞活力與si-NC組比較:*P<0.05
2.4 AhR干擾后hUC-MSCs軟骨分化標志物SOX-9和COL2A1的mRNA和蛋白表達
實時定量熒光PCR結果顯示:與Control組比較,si-NC組的SOX-9和COL2A1 mRNA表達差異無統(tǒng)計學意義(P
>0.05);而與si-NC組比較,si-AhR組SOX-9和COL2A1 mRNA表達明顯升高,差異有統(tǒng)計學意義(F
=12.258,P
<0.05;F
=13.124,P
<0.05)。Western blot結果表明:與Control組比較,si-NC組的SOX-9和COL2A1在蛋白水平上表達差異無統(tǒng)計學意義(P
>0.05);而與si-NC組比較,si-AhR組SOX-9和COL2A1在蛋白水平上表達明顯升高,差異有統(tǒng)計學意義(F
=9.323,P
<0.05 ;F
=6.750,P
<0.05)(圖6、7)。
圖6 AhR干擾后SOX-9和COL2A1 的mRNA表達與si-NC組比較:*P<0.05
2.5 AhR干擾后hUC-MSCs蛋白聚糖表達
軟骨分化誘導7 d后,進行阿利新藍染色,可見Control、si-NC和si-AhR組均有藍染,si-NC組與Control組藍染差異無統(tǒng)計學意義;si-AhR組與si-NC組比較,藍染明顯增強,蛋白聚糖含量增多,說明hUC-MSCs軟骨分化程度更高(圖8)。
圖8 hUC-MSCs成軟骨誘導后阿利新藍染色結果A:Control組; B:si-NC組;C:si-AhR組
3 討論
關節(jié)軟骨主要由軟骨細胞和細胞外基質組成,無血管和神經(jīng)系統(tǒng),軟骨細胞增殖能力極弱且缺乏再生能力,導致軟骨損傷后難以自我修復。目前臨床治療關節(jié)軟骨損傷的方法有骨髓刺激修復和軟骨細胞移植修復,但取得的軟骨修復效果不能讓人滿意。隨著科學技術的發(fā)展,基于干細胞的相關療法為治療軟骨損傷提供了新的治療方向。MSCs作為一種多功能干細胞,具備自我更新和多向分化功能,可分化為骨細胞和軟骨細胞,修復受損軟骨組織,同時還具有抗炎和免疫調控功能,這為軟骨損傷的治療帶來新方向和新思路。hUC-MSCs來源于新生兒臍帶,具備MSCs的各種特性,且與其他來源的MSCs比較,具備更強的分化和增殖能力,因此更具有臨床應用價值。


圖7 AhR干擾后SOX-9和COL2A1的蛋白表達A:Western blot檢測β-actin、SOX-9和COL2A1的表達:B:根據(jù)A的結果進行條帶灰度分析;與si-NC組比較:*P<0.05
在本研究中,為了探究AhR對hUC-MSCs增殖和軟骨分化的影響,通過小干擾抑制hUC-MSCs中AhR的表達,用CCK-8法檢測hUC-MSCs增殖能力的變化,結果表明在第5天和第7天,AhR干擾的hUC-MSCs細胞活力增強。軟骨分化誘導培養(yǎng)7天檢測相關指標,結果表明AhR干擾的hUC-MSCs軟骨分化標志物SOX-9和COL2A1的mRNA和蛋白表達量增加,蛋白聚糖表達增多,提示AhR干擾后的hUC-MSCs的軟骨分化能力更強。綜上所述,通過干擾AhR表達可以促進hUC-MSCs的增殖和軟骨細胞分化能力,提示AhR可作為調控hUC-MSCs軟骨分化的潛在靶點,值得進一步研究和確認,這對于軟骨損傷相關疾病的治療和預防有著重要意義。

