羽扇豆醇通過NF-κb信號通路調控胃癌小鼠免疫微環境
姜瑞 陳佳 侯向紅
(甘肅省人民醫院消化內鏡中心,甘肅 蘭州 730000)
胃癌發病率位居我國惡性腫瘤的首位〔1〕。研究指出,我國每年新增胃癌病例約68萬,占全球每年新增胃癌病例的42%,且死亡率已超過世界平均水平的2倍〔2〕。目前臨床上針對胃癌患者常采用手術、放化療和靶向治療等,但手術有明顯局限性,且各種方案的綜合療效不甚理想〔3,4〕,尚需探討新的治療方案。腫瘤微環境是指腫瘤細胞所處的內環境,腫瘤細胞可通過自分泌與旁分泌改變并維持自身生存和進展,全身與局部組織亦可通過調節分泌、代謝、免疫等影響腫瘤生長。有報道指出,核轉錄因子(NF)-κb包括5種亞基,其中包括NF-κb p65,在致病因素刺激下NF-κb p65活化,與此同時腫瘤組織T細胞活化,可分泌大量的白細胞介素(IL)-6、IL-10、腫瘤壞死因子(TNF)-α等,而此類因子均有免疫抑制作用,進而可參與惡性腫瘤細胞免疫逃逸〔5〕。因此調節胃癌免疫微環境是抑制腫瘤生長的可行途徑。羽扇豆醇是從羽扇豆種子的表皮、無花果樹等提煉的,可抗炎、抗腫瘤、抗氧化、調節免疫。有研究顯示,羽扇豆醇可抑制抗原遞呈細胞的成熟與活化,下調TNF-α表達,治療急性移植物抗宿主病〔6〕。另有研究推測羽扇豆醇有抗消化系統惡性腫瘤的作用且很可能是通過調節免疫微環境實現的〔7〕。但羽扇豆醇是否可通過調節NF-κb通路調控胃癌荷瘤小鼠的免疫微環境發揮抗腫瘤效應尚不可知。本研究旨在探討羽扇豆醇通過NF-κB信號通路調控胃癌小鼠免疫微環境的作用。
1 材料與方法
1.1材料 實驗細胞與動物:小鼠胃癌細胞株MFC購自上海雅吉生物科技有限公司;C57BL/6J雄性小鼠50只,清潔級,7~9周齡,18~22 g,購自上海史萊克實驗動物有限公司,許可證號:SCXK(滬)2019-0003。
藥品與試劑:羽扇豆醇(上海丹施生物科技有限公司,純度>98%);常山酮(成都彼樣生物科技有限公司,純度>98%);膜聯蛋白V(Annexin)V-FITC、碘化丙啶(PI)染料(南京沃博生物科技有限公司,批號:1912101、1911017);蘇木素-伊紅(HE)染色試劑盒(北京酷來搏科技有限公司,批號:1910118);Trizol試劑(上海聯邁生物工程有限公司,批號:1910154A);逆轉錄試劑盒(蘇州宇恒生物科技有限公司,批號:1911014102);NF-κb p65、IL-6、IL-10、TNF-α、β-actin(內參)上下游序列(委托大連寶生物科技有限公司合成);蛋白定量試劑盒(上海雅酶生物科技有限公司,批號:1911142018);兔抗鼠NF-κb p65、IL-6、IL-10、TNF-α單克隆抗體(Abcam中國公司,批號:1911014、1910185、1912148、1912136);酶標記的山羊抗兔NF-κb p65、IL-6、IL-10、TNF-α多克隆抗體(Abcam公司,批號:1910102、1911107、1912186、1912192)。實驗設備:TDZ5-BP型醫用離心機(長沙湘銳離心機有限公司);530-119型游標卡尺(昆山艾弗特計量儀器有限公司);JY10001型電子天平(上海精密儀器儀表有限公司);BriCyte E6型流式細胞儀(深圳邁瑞生物醫療電子股份有限公司);RM2235型切片機(德國徠卡公司);CX33型光學顯微鏡(日本奧林巴斯公司);Mastercycler nexus flat型聚合酶鏈反應(PCR)儀(Eppendorf中國有限公司);ZF208型凝膠圖像成像分析系統(上海嘉鵬科技有限公司)。
1.2方法 建模與分組干預:取小鼠胃癌細胞株MFC,常規培養至對數生長期,待細胞接近80%進行消化,收集懸液至離心管,1 000 r/min離心5 min,棄上清液以0.9%生理鹽水重懸,調整細胞密度至1×107個/ml。對小鼠右后肢脫毛,取0.2 ml注射于其右后肢外側皮下,0.2 ml/只。隔日用游標卡尺測量皮下移植瘤長徑與短徑,計算腫瘤體積,1 w后腫瘤體積>50 mm3計為建模成功〔8〕。50只小鼠有48只建模成功,建模成功率為96.00%(48/50)。將建模成功小鼠采用隨機數字表分為5組,模型組、常山酮組各9只,羽扇豆醇低、中、高劑量組各10只。模型組予以1 ml/100 g體重無菌生理鹽水腹腔注射,常山酮組予以2 μg常山酮溶于0.1 ml/100 g體重無菌生理鹽水中腹腔注射,羽扇豆醇低、中、高劑量組予以10、20、40 mg/kg羽扇豆醇溶于0.1 ml/100 g體重無菌生理鹽水中腹腔注射,1次/d,持續1 w。
腫瘤質量及免疫微環境指標檢測:干預后采用斷頭法處死小鼠,處死前收集尾靜脈血,處死后迅速取胸腺、脾臟、癌組織和癌旁組織。采用電子天平稱量腫瘤、胸腺、脾臟質量,計算胸腺、脾臟質量指數;采用流式細胞儀檢測各組外周血、胸腺、脾臟、癌組織和癌旁組織CD3+CD4+、CD3+CD8+、Treg、自然殺傷(NK)細胞占比,所用方法為Annexin V-FITC/PI雙染法,并計算CD4+/CD8+。
癌組織病理改變觀察:取腫瘤組織沖洗干凈后固定,常規脫水、透明處理,石蠟包埋后連續切片(層厚4 μm),烤片后脫蠟,水化,蘇木素染色后伊紅復染,脫水、透明、封片,采用光學顯微鏡觀察,其中HE染色需要嚴格按照試劑盒使用說明書操作。
癌組織NF-κb p65、IL-6、IL-10、TNF-α mRNA表達檢測:采用液氮研磨腫瘤組織并勻漿,提取總mRNA,檢測并鑒定,結果為1.8~2.0視為合格,將其逆轉錄后配制反應體系,其中NF-κb p65上游序列:5′-TGCTAGAGCTATTATAGCT-3′,下游序列:5′-ATGCTTAGAGGCGCGGCTATA-3′;IL-6上游序列:5′-CTGGATATAGGCGCGGCATAT-3′,下游序列:5′-CGGGCTATATAGCGGCTAGCTA-3′;IL-10上游序列:5′-TCGCGTATATGCGTATAGCTAG-3′,下游序列:5′-ATCGCTATAGCTATTAGCGCTAGCT-3′;TNF-α上游序列:5′-CGCGTATATAGGCTATATGGCGCG-3′,下游序列:5′-CTGGAAGTCTTCGAGAGCTAG-3′;β-actin上游序列:5′-AGAGCTCTTCGAGAG-3′,下游序列:5′-TAGAGCTCTCTAGAGCT-3′,預計擴增產物長度分別為:312 bp、320 bp、348 bp、390 bp、280 bp。擴增反應流程:92℃(10 min),35個循環:95℃(10 s)、60℃(30 s)、95℃(15 s)、75℃(15 s),最后72℃(5 min),計算2-△△Ct。
癌組織NF-κb p65、IL-6、IL-10、TNF-α蛋白表達檢測:采用Western印跡檢測。取腫瘤組織研磨勻漿,加入蛋白裂解液,提取總蛋白,定量檢測。上樣、電泳、轉膜和封閉,加入一抗,4℃冰箱中孵育過夜;洗脫后加入二抗,室溫孵育2 h。洗脫后加入電化學發光液。采用凝膠圖像成像分析系統分析蛋白表達。
1.3統計學方法 采用SPSS24.0軟件進行單因素方差分析和SNK-q檢驗。
2 結 果
2.1各組小鼠腫瘤質量比較 常山酮組〔(3.02±0.56)g〕和羽扇豆醇低、中、高劑量組腫瘤質量〔(3.00±0.52)g、(2.71±0.42)g、(2.05±0.37)g〕均顯著低于模型組〔(4.85±0.73)g,P<0.05〕,羽扇豆醇中、高劑量組腫瘤質量均顯著低于常山酮組、羽扇豆醇低劑量組(P<0.05),羽扇豆醇高劑量組腫瘤質量顯著低于羽扇豆醇中劑量組(P<0.05)。
2.2各組胸腺、脾臟質量指數比較 常山酮組和羽扇豆醇各劑量組胸腺、脾臟質量指數均顯著高于模型組(P<0.05),羽扇豆醇中、高劑量組胸腺、脾臟質量指數均顯著高于常山酮組、羽扇豆醇低劑量組(P<0.05),羽扇豆醇高劑量組胸腺、脾臟質量指數均高于羽扇豆醇中劑量組(P<0.05),見表1。
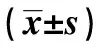
表1 各組胸腺、脾臟質量指數比較
2.3各組免疫指標比較 外周血、胸腺、脾臟CD3+CD4+、NK細胞、CD4+/CD8+,癌組織CD4+/CD8+,癌旁組織CD3+CD4+、CD3+CD8+、NK細胞、CD4+/CD8+比較,常山酮組和羽扇豆醇各劑量組均顯著高于模型組(P<0.05),羽扇豆醇中、高劑量組均顯著高于常山酮組、羽扇豆醇低劑量組(P<0.05),羽扇豆醇高劑量組均高于羽扇豆醇中劑量組(P<0.05);外周血、胸腺、脾臟Treg,癌組織CD3+CD4+、CD3+CD8+、Treg、NK細胞,癌旁組織Treg比較,常山酮組和羽扇豆醇各劑量組均顯著低于模型組(P<0.05),羽扇豆醇中、高劑量組均顯著低于常山酮組、羽扇豆醇低劑量組(P<0.05),羽扇豆醇高劑量組均顯著低于羽扇豆醇中劑量組(P<0.05),見表2~6。
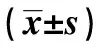
表2 各組外周血細胞免疫指標比較
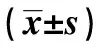
表3 各組胸腺細胞免疫指標比較
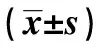
表4 各組脾臟細胞免疫指標比較
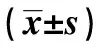
表5 癌組織細胞免疫指標比較
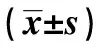
表6 癌旁組織細胞免疫指標比較
2.4各組腫瘤組織病理改變比較 模型組腫瘤細胞排列不規則,異型性明顯,間質有充血水腫和炎癥浸潤,腺體呈囊狀擴張;常山酮組和羽扇豆醇低劑量組部分腫瘤細胞排列不規則,有異型性,間質有充血水腫和炎癥浸潤表現;羽扇豆醇中劑量組少部分腫瘤細胞排列不規則且有異型性,間充質有輕微充血水腫和炎癥浸潤表現;羽扇豆醇高劑量組腫瘤細胞基本排列規則,細胞異型性不明顯,間充質無充血水腫和炎癥浸潤表現。見圖1。
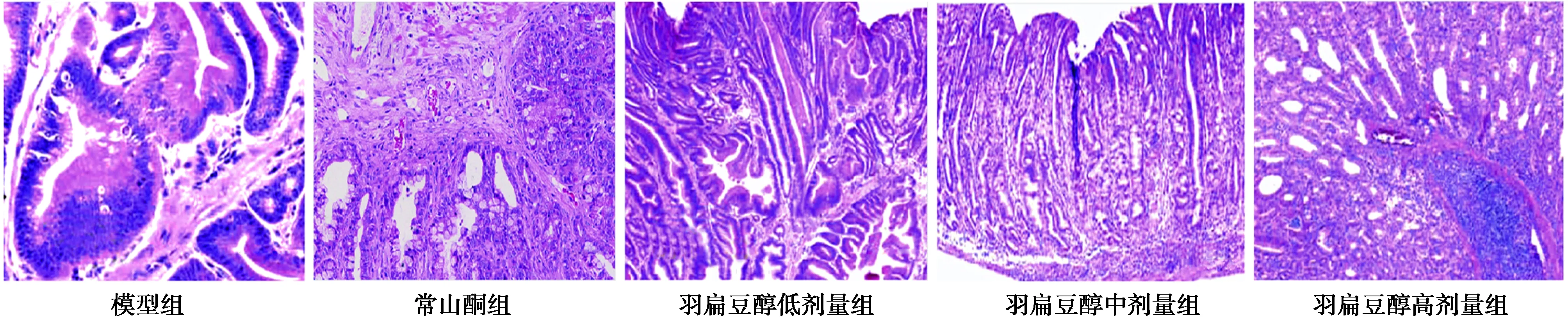
圖1 各組腫瘤組織病理改變(HE,×100)
2.5各組癌組織NF-κb p65、IL-6、IL-10、TNF-α mRNA及蛋白表達比較 癌組織NF-κb p65、IL-6、IL-10、TNF-α mRNA及蛋白表達比較,常山酮組和羽扇豆醇各劑量組均顯著低于模型組(P<0.05),羽扇豆醇中、高劑量組均顯著低于常山酮組、羽扇豆醇低劑量組(P<0.05),羽扇豆醇高劑量組均顯著低于羽扇豆醇中劑量組(P<0.05),見表7,圖2。
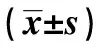
表7 各組癌組織NF-κb p65、IL-6、IL-10、TNF-α mRNA及蛋白表達比較
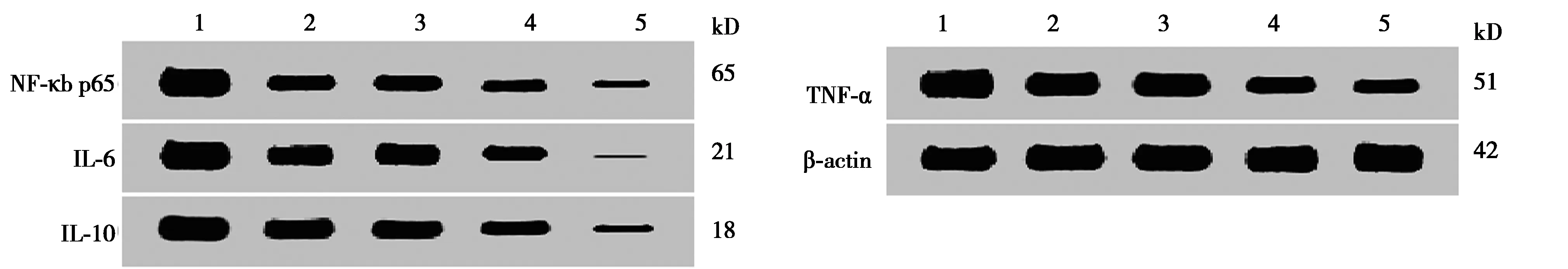
1~5:模型組,常山酮組,羽扁豆醇低劑量組,羽扁豆醇中劑量組,羽扁豆醇高劑量組圖2 各組癌組織NF-κb p65、IL-6、IL-10、TNF-α蛋白表達
3 討 論
胃癌的發生與致病微生物感染、飲食中致癌物超標、遺傳因素等均相關,可通過直接浸潤、血行轉移、淋巴轉移和腹膜種植等途徑擴散〔9,10〕。有研究指出〔11〕,胃癌細胞可通過多種途徑逃避機體免疫系統的識別與攻擊,稱為免疫逃逸,常見的機制有腫瘤細胞抗原缺失及抗原改變、腫瘤細胞共刺激信號異常、腫瘤細胞表達或分泌免疫抑制因子、誘導T細胞凋亡或抑制其活化、抑制機體免疫應答等。另有研究顯示〔12〕,腫瘤免疫微環境與病情發展和預后均相關,改善腫瘤免疫微環境有助于增強抗腫瘤效果,改善預后。常山酮是從常山中獲取的喹唑酮類物質,有報道〔13〕顯示常山酮可調節小鼠的免疫微環境,且該藥物在臨床抗腫瘤治療中也顯示出良好的應用價值〔14〕,故而本研究選用常山酮作為陽性對照藥物。本研究結果提示常山酮和羽扇豆醇均促進胃癌小鼠機體細胞免疫,增強機體對胃癌細胞的識別和免疫殺傷效應,且羽扇豆醇的作用呈劑量依賴性;本研究結果常山酮和羽扇豆醇均可促使CD3+CD4+、CD3+CD8+、Treg、NK細胞進入癌組織發揮抗腫瘤作用,而在發揮此作用的同時上述細胞可被大量消耗,因此癌組織中CD3+CD4+、CD3+CD8+、Treg、NK細胞水平顯著下降。T細胞是抗腫瘤免疫中的主力軍,有免疫記憶功能和特異性,而NK細胞和Treg細胞也有重要的抗腫瘤作用,分別負責非特異性抗腫瘤和機體內負向調節免疫應答、維持機體免疫平衡〔15〕。有研究顯示〔16,17〕,T細胞中CD3+CD4+、CD3+CD8+可通過多種途徑抑制腫瘤生長,其中前者水平升高可活化的T細胞分泌大量的IL-6、IL-10和TNF-α等,既可直接破壞腫瘤細胞的結構,還可增強效應細胞的抗腫瘤作用;后者則是主要的細胞毒效應細胞,當CD4+/CD8+升高意味著機體免疫應答及抗腫瘤活性增強,可避免腫瘤細胞免疫逃逸。相關報道〔18〕發現對肝癌荷瘤小鼠予以藥物治療調控免疫微環境可增加抑瘤率,且本研究與該報道中的外周血、脾臟、腫瘤組織及癌旁組織T細胞免疫指標變化趨勢相符。本研究結果表明常山酮和羽扇豆醇均可通過調節免疫微環境發揮抗胃癌作用,且羽扇豆醇的作用呈劑量依賴性。T細胞活化可分泌大量的細胞因子,進而通過各種途徑發揮抗腫瘤效應。本研究結果表明常山酮和羽扇豆醇均可抑制癌組織中NF-κb p65、IL-6、IL-10、TNF-α mRNA和蛋白表達。NF-κb p65是一種可與免疫球蛋白κ輕鏈基因增強子κb序列特異性結合的和蛋白因子,可由TNF-α受體家族成員激活〔19〕。結合國內外相關報道〔20~22〕,NF-κb p65可通過多種途徑參與胃癌的發生和發展,包括激活炎癥反應、抑制免疫應答、參與血管生成、細胞黏附、細胞自噬、能量代謝等,可誘導細胞增殖,延長細胞存活期。另有報道指出〔23〕,NF-κb p65激活可促進T細胞活化,增強IL-6、IL-10和TNF-α的表達。但是本研究常山酮組和羽扇豆醇各劑量組癌組織中IL-6、IL-10、TNF-α mRNA和蛋白降低,可能是由于CD3+CD4+、Treg、NK細胞等進入癌組織后大量被消耗以發揮抗腫瘤作用,因此腫瘤生長被抑制,與此同時IL-6、IL-10、TNF-α的活性下降。羽扇豆醇是一種三萜烯,已被證實有抗氧化、抗炎、抗惡性腫瘤細胞增殖和遷移等作用,且該藥物可調節荷瘤實驗動物的免疫系統〔24〕,增強免疫應答,抑制惡性腫瘤細胞免疫逃逸。
綜上,常山酮和羽扇豆醇均可抑制胃癌小鼠腫瘤生長,還可調節整體細胞免疫和局部細胞免疫指標水平,增強免疫應答,抑制腫瘤免疫逃逸,推測是通過抑制NF-κb p65表達,并通過該通路下調IL-6、IL-10、TNF-α的表達實現此作用的。本研究為胃癌免疫調節治療研究提供了新方向,但羽扇豆醇是否可通過其他信號通路途徑調節胃癌免疫微環境尚不清楚,后期仍需深入研究和探討,以充分挖掘羽扇豆醇的醫用價值。

