可拆卸式輸尿管軟鏡鈥激光切開內(nèi)引流術治療腎囊性疾病效果分析*
趙振華,胡 明,馮權(quán)堯,徐 勛,張湛英,關禮賢
(南方醫(yī)科大學附屬南海醫(yī)院,廣東 佛山 528000)
腎囊性疾病是具有同一腎囊腫形態(tài)特性的多種混雜疾病,大部分生長緩慢,無需治療[1],但如囊腫最大直徑>4 cm、出現(xiàn)局部疼痛或壓迫腎盂及腎血管,則需外科處理[2]。目前臨床應用較多的為后腹腔鏡囊腫去頂減壓術,療效確切,但并發(fā)癥也較多[3]。隨著泌尿外科微創(chuàng)技術的不斷進步,輸尿管軟鏡技術已成為泌尿系疾病的主要手段之一,為腎囊性疾病提供了一種新的治療方法[4]。一體式輸尿管軟鏡在臨床較為常見,其設備及維修費用昂貴,在一定程度上限制了其推廣[5]。可拆卸式輸尿管軟鏡則具有操作輕便、維修方便、使用成本低等優(yōu)勢,近年來其應用價值逐漸得到認可[6]。本研究旨在探討可拆卸式輸尿管軟鏡鈥激光切開內(nèi)引流術治療腎囊性疾病效果分析。現(xiàn)報告如下。
1 資料和方法
1.1 一般資料
選取2019年1-12月本院收治的100例腎囊性疾病患者,按照隨機數(shù)字表法分為研究組和對照組,每組各50例。研究組男29例,女21例;年齡28~67歲,平均(51.3±5.9)歲;囊腫直徑4.2~7.8 cm,平均(5.5±0.7)cm;囊腫類型:單側(cè)腎囊腫28例,雙側(cè)腎囊腫6例,單側(cè)腎盂旁囊腫12例,雙側(cè)腎盂旁囊腫4例。對照組男31例,女19例;年齡25~69歲,平均(52.2±6.6)歲;囊腫直徑4.3~7.7 cm,平均(5.4±0.9)cm;囊腫類型:單側(cè)腎囊腫34例,雙側(cè)腎囊腫5例,單側(cè)腎盂旁囊腫9例,雙側(cè)腎盂旁囊腫2例。兩組患者一般資料比較差異無統(tǒng)計學意義(P>0.05),具有可比性。
1.2 入選標準
納入標準:①年齡18~70歲。②符合腎囊腫和腎盂旁囊腫的診斷標準。③經(jīng)彩超、CT及靜脈腎盂造影檢查確診為良性腎囊腫且囊腔呈內(nèi)生性生長。④囊腫最大直徑>4 cm或有疼痛癥狀或有壓迫梗阻影像學改變。⑤自愿參加研究并簽署知情同意書。
排除標準:①可疑或不能排除惡變腎囊性病變。②囊腫繼發(fā)出血明顯。③凝血功能障礙。④合并心肺腦肝腎等嚴重基礎疾病。⑤合并尿道或輸尿管嚴重狹窄無法置入輸尿管軟鏡鞘者。⑥合并嚴重髖關節(jié)畸形等不適合截石體位。⑦妊娠、哺乳期女性。
1.3 方法
研究組給予可拆卸式輸尿管軟鏡鈥激光切開內(nèi)引流術治療。患者行氣管插管全身麻醉,取截石位。先以德國WOLF F8/9.8或F4.5/6.5輸尿管硬鏡探查輸尿管,并上行至腎盂,置入18 G斑馬導絲,退出輸尿管硬鏡。在導絲引導下逆行置入Cook(F12/14)輸尿管輸送鞘。順輸送鞘置入德國鉑立可拆卸式輸尿管軟鏡,進入腎盂或腎盞內(nèi),依次觀察腎盂、上盞、中盞、下盞,找到腎囊性病灶,用美國科醫(yī)人550 um鈥激光(功率設置:能量1.0~2.0 J,頻率10~20 Hz)在囊腫最薄弱處開窗并放射狀切開,直徑約3~5 cm,注意避開血管搏動,破壞囊腫壁,對囊液進行引流,術畢留置雙J管做內(nèi)引流,1個月后拔除。
對照組給予后腹腔鏡下囊腫去頂減壓術治療。患者行氣管插管全身麻醉,取健側(cè)臥位。三點法建立腹膜后腔,在髂前上棘2 cm與腋中線相交處做一個長約1.5 cm的橫切口,氣囊擴張分離腹膜后間隙建立氣腹,再于第12肋下緣下方2 cm與腋前線、腋后線相交處各做一穿刺點,依次置入套管和操作器械。切除腹膜外脂肪,打開腎周筋膜,游離腎門處組織,找到并游離病灶,鈍性分離囊壁,使用吸引器抽凈囊液后盡可能完整剝除整個囊腫壁。對囊壁有異常不能排除腫瘤者,取部分囊腫壁組織送檢。氣腹減壓后檢查囊壁內(nèi)是否與腎盂相通,留置腹膜后引流管,縫合關閉切口。
1.4 觀察指標
①手術相關指標:包括手術時間、術中出血量、術后12 h疼痛程度、住院時間。術后12 h疼痛程度采用視覺模擬評分法(VAS)進行評定,使用一條長約10 cm的游動標尺,兩端分別為“0”和“10”,分數(shù)越高,疼痛越劇烈,讓患者在直尺上標出能代表自己疼痛程度的相應位置。②臨床療效及復發(fā)情況:兩組患者均予隨訪6個月,行超聲或CT復查,觀察其臨床效果及復發(fā)情況。臨床療效判定標準[7]:術后6個月囊腫消失或最大直徑縮小≥80%以上或最大直徑<10 mm為治愈;50%≤囊腫最大直徑縮小<80%為顯效;30%≤囊腫最大直徑縮小<49%為有效;囊腫最大徑縮小<30%為無效。③術后并發(fā)癥發(fā)生情況:包括疼痛、發(fā)熱、感染、囊腔內(nèi)血塊形成等。
1.5 統(tǒng)計學方法
2 結(jié)果
2.1 兩組手術相關指標比較
研究組手術時間、住院時間短于對照組,術中出血量少于對照組,術后12 h疼痛程度評分低于對照組,兩組比較差異有統(tǒng)計學意義(P<0.05)。詳見表1。
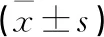
表1 兩組手術相關指標比較
2.2 兩組臨床療效及復發(fā)情況比較
研究組總有效率高于對照組(P<0.05);研究組復發(fā)率低于對照組,但兩組比較差異無統(tǒng)計學意義(P>0.05)。詳見表2。

表2 兩組臨床療效及復發(fā)情況比較(n,%)
2.3 兩組并發(fā)癥總發(fā)生率比較
研究組并發(fā)癥發(fā)生率明顯低于對照組,兩組比較差異有統(tǒng)計學意義(P<0.05)。詳見表3。

表3 兩組并發(fā)癥總發(fā)生率比較(n,%)
3 討論
腎囊性疾病是泌尿外科常見疾病,主要包括單純性腎囊腫、腎盂旁囊腫及多囊腎等,它多發(fā)于男性,且發(fā)病率隨著年齡的增加而上升[7]。單純腎囊腫生長緩慢,大部分無明顯癥狀,隨著其體積增大可壓縮腎集合系統(tǒng),導致腰痛、血尿、高血壓等,一般建議直徑>4 cm、有臨床癥狀或合并癥者行外科治療[8]。腎盂旁囊腫也叫腎竇囊腫,因位置靠近腎竇,在體積較小時就可產(chǎn)生壓迫癥狀。因此,近年來有學者主張積極干預,對直徑>2 cm、有臨床癥狀或合并癥者即可考慮手術治療[9]。以往臨床上常采用囊腫憩室去頂術或腎部分切除術治療,手術效果確切、并發(fā)癥少,但創(chuàng)傷較大、術后恢復慢、花費高等缺點,應用具有局限性,近年來已逐漸被其他微創(chuàng)術式所替代[10]。B超引導下囊腫穿刺加硬化劑注入術是一種簡便易行的方法,在實時超聲顯像下將穿刺針置入病灶,再注入硬化劑,以達到診斷和治療的目的,但存在刺破腎門血管、硬化劑滲至集合系統(tǒng)等嚴重并發(fā)癥的風險,故現(xiàn)視為禁忌[11]。
后腹腔鏡囊腫去頂減壓術是目前較為推薦的微創(chuàng)手術方式,常用于腎囊腫和腎盂旁囊腫的治療,相較于開放手術,其創(chuàng)傷小、恢復快、并發(fā)癥少、復發(fā)率低,但其手術過程中容易損傷腎門部結(jié)構(gòu),合并感染、粘連嚴重者存在中轉(zhuǎn)開放手術的可能,且其血尿、感染、尿外滲等術后并發(fā)癥發(fā)生率仍較高,可達15%~37%[12],同時周圍組織出血粘連給二次手術帶來難度,術后一旦囊腫復發(fā)則較難處理。
隨著微創(chuàng)技術的不斷發(fā)展,輸尿管軟鏡技術的應用范圍越來越廣泛。本研究中應用輸尿管軟鏡鈥激光切開內(nèi)引流術治療腎囊性疾病,術中經(jīng)尿道輸尿管路徑進入腎集合系統(tǒng)進行各種內(nèi)鏡下操作,符合經(jīng)自然腔道路徑,最大限度降低對人體生理指標的影響。同時因其通過自然腔道手術,重復性好,最大程度解決了腎囊腫需要多次手術的問題[13],直視下到達腎盂腎盞,能有效避免視野盲區(qū),更易尋及囊腫,并可選擇腎囊腫薄弱位置以低能量鈥激光行切開內(nèi)引流,不易誤傷正常腎組織及大血管,出血較少,術后以雙J管繼續(xù)充分引流囊液,可減少炎性反應的發(fā)生,避免切口閉合,從而降低囊腫復發(fā)率[14]。同時,考慮到一體式電子輸尿管軟鏡設備昂貴、易損耗、維修困難,術中采用可拆卸式輸尿管軟鏡,其成像系統(tǒng)和操作系統(tǒng)完全分開,最大限度地保存軟鏡的核心部件,有效地降低了設備損耗的風險,降低了使用成本,更適合在基層醫(yī)院推廣[15]。本研究結(jié)果顯示,研究組手術時間、住院時間短于對照組,術中出血量少于對照組,術后12 h疼痛程度評分低于對照組,研究組并發(fā)癥發(fā)生率明顯低于對照組,提示可拆卸式輸尿管軟鏡鈥激光切開內(nèi)引流術操作更為安全、可靠、微創(chuàng)、操作簡便,能有效減少手術時間和術中出血量,利于患者術后恢復。此外,研究組總有效率明顯高于對照組,進一步證實該術式治療腎囊性疾病效果顯著。
分析可拆卸式輸尿管軟鏡鈥激光切開內(nèi)引流術治療腎囊性疾病的特點:①術前常規(guī)行CTU、CTA檢查判斷囊腫情況,若囊腫離腎集合系統(tǒng)較遠可向囊腔內(nèi)注入亞甲藍,以準確掌握囊腫與集合系統(tǒng)和腎血管關系。②切開囊腫時應在最薄弱處沿開窗點向四周放射狀切開,開窗的范圍應盡可能大,避免血管損傷,注意血管的走形和方向,避開明顯波動的部位。③對于較大的囊腫雙J管近端應置入囊腔內(nèi),術后可使用B超或腹部X片確認。
綜上所述,可拆卸式輸尿管軟鏡鈥激光切開內(nèi)引流術治療腎囊性疾病臨床效果肯定,并發(fā)癥少,術后恢復快,安全性高,值得臨床推廣應用。

