免疫組化標志物在鑒別漿膜腔積液惡性腫瘤細胞中的應用價值
蘇梅芬
(廣西欽州市第二人民醫院病理科,廣西 欽州 535000)
漿膜腔積液中惡性腫瘤屬于臨床中較為復雜的類型之一,漿膜腔積液內腫瘤細胞的檢測在臨床病理送檢中屬于較為常見的現象[1]。在診斷過程中受到傳統細胞學涂片判讀的限制,很難為臨床提供腫瘤的來源與分類,加上晚期腫瘤患者難以耐受手術和極易出血,不易獲取原發部位腫瘤的組織學標本[2]。而漿膜腔積液經常被臨床中當作首發癥狀,較為容易獲取,因此在臨床病理工作中利用漿膜腔積液的樣本進行制作蠟塊加做免疫組化檢測來診斷具有較為積極的作用,能為臨床治療惡性腫瘤提供個性化的幫助和參考[3]。因此,有效的免疫組化標志物的檢測手段顯得尤為重要,為了分析免疫組化標志物在鑒別漿膜腔積液惡性腫瘤細胞中的應用有效性,我院針對收治的60 例漿膜腔積液惡性腫瘤患者展開了觀察及診斷分析。
1 資料與方法
1.1 臨床資料
選擇我院2019年1月至2020年12月收治的由細胞學篩選的漿膜腔積液惡性腫瘤患者60 例作為本次觀察對象,采用數字隨機分組的方式將其分成三組,A 組20 例患者中男性患者11 例,女性9 例,最大年齡為81 歲,最小年齡為39歲,年齡均值為(62.56±5.69)歲,其中心包積液患者3 例,腹水患者7 例,胸水患者10 例;B 組20 例患者中男性患者12例,女性8 例,最大年齡為82 歲,最小年齡為40 歲,年齡均值為(62.57±5.72)歲,其中心包積液患者4 例,腹水患者7 例,胸水患者9 例;C 組20 例患者中男性患者10 例,女性10 例,最大年齡為80 歲,最小年齡為41 歲,年齡均值為(62.62±5.70)歲,其中心包積液患者3 例,腹水患者8 例,胸水患者9 例。
對三組漿膜腔積液惡性腫瘤患者的一般資料進行統計分析,結果顯示組間差異小且可比性高。本研究觀察之前,60例患者經臨床病理學診斷后均確診為漿膜腔積液惡性腫瘤患者;本觀察開展前,60 例患者及其家屬均對本次觀察的目的、內容、形式和結果等展開了詳細的了解且均已簽署知情同意協議;本次觀察均在我院倫理委員會審批下通過。
1.2 方法
本次觀察中使用的4 種檢測手段中涉及到的儀器設備包括切片機、離心機及脫水機、包埋機等等;使用的試劑包括免疫組化染色采用的EnVision 法,抗體包括CEA、CK20、TTF-1、CK7、CK8、CK、EMA、CA125、PAX-5、CDX-2、Villin、NapsinA、CR、MC、D2 -40、WT -1、PR、ER、HER -2、CD15、MUM1、CD20、CD3、vimentin、Ki-67、P53 等等。將60 例患者的漿膜腔積液標本編號后分成2 份,一份80ml,將其分別放置在2 個離心管中,通過3000r/min 轉速的速度實施離心操作5 分鐘,兩管將上清液去除后保留沉淀物等待檢測。
針對A 組20 例患者實施常規細胞學涂片檢查,針對B組20 例患者實施薄層液基細胞技術制片檢查,選擇1 管沉淀物給予2 張常規涂片的檢測,將濕片固定在95%的乙醇溶液中給予HE 的染色處理;再將剩下的沉淀物全部轉入薄層液基細胞保存瓶內,選擇由手工型制片對液基薄層細胞技術的處理。檢測后呈巢團、彌漫或散在的分布顯著異型細胞,明確為免疫組化染色的基本條件。
針對C 組20 例患者實施細胞蠟塊切片結合免疫組化檢測的聯合診斷,利用一管沉淀物注入40ml 的福建泰普生物有限公司生產的細胞提取液,給予3000r/min 的低速離心操作,連續離心操作5 分鐘后將上清液去除,再加入10%的50ml 中性福爾馬林,重復進行5 分鐘的離心操作,將上清液去除后沉淀物能凝固成塊,后將固塊包在濾紙內放置如包埋盒中,采用全自動脫水機進行固定、脫水處理,然后實施包埋、切片及HE 染色的處理,將細胞蠟塊切片后實施免疫組化染色的檢測。檢測完成后參照組織學的原則,細胞核、細胞膜及細胞質出現定位較為清晰的棕黃色或黃色顆粒的患者,且量在10%以上的異型細胞則屬于陽性,完全不著色則屬于陰性。各類抗體陽性的結果可靠,染色定位較為準確。
1.3 觀察指標
對比觀察三組漿膜腔積液惡性腫瘤患者檢測診斷之后對比檢出率及鑒別漿膜腔積液中惡性腫瘤的來源和分類的陽性率等指標的差異。
1.4 統計學分析
采用spss27.0 軟件對三種診斷技術下的診斷結果進行處理,檢出率及鑒別漿膜腔積液中惡性腫瘤的來源和分類的陽性率為計數資料,采用x2 表示,當P 小于0.05 表示三種診斷技術下的診斷結果之間的差異有統計學意義。
2 結果
2.1 三種檢測漿膜腔積液中惡性腫瘤細胞陽性檢出率的對比
C 組漿膜腔積液中惡性腫瘤患者檢測后的檢出率顯著高于A 組漿膜腔積液中惡性腫瘤患者及B 組漿膜腔積液中惡性腫瘤患者(P<0.05),差異具有統計學意義;見表1所示:
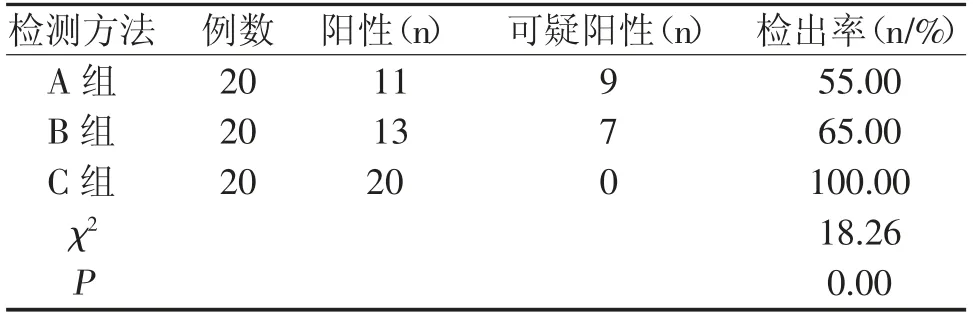
表1 三種檢測漿膜腔積液中惡性腫瘤細胞陽性檢出率
2.2 漿膜腔積液中惡性腫瘤的來源和分類
A 組惡性漿膜腔積液患者、B 組惡性漿膜腔積液患者及C 組惡性漿膜腔積液患者的臨床資料、細胞學特點及免疫組化結果的分析下,對其組織來源和類型進行分析的具體結果見表2所示:
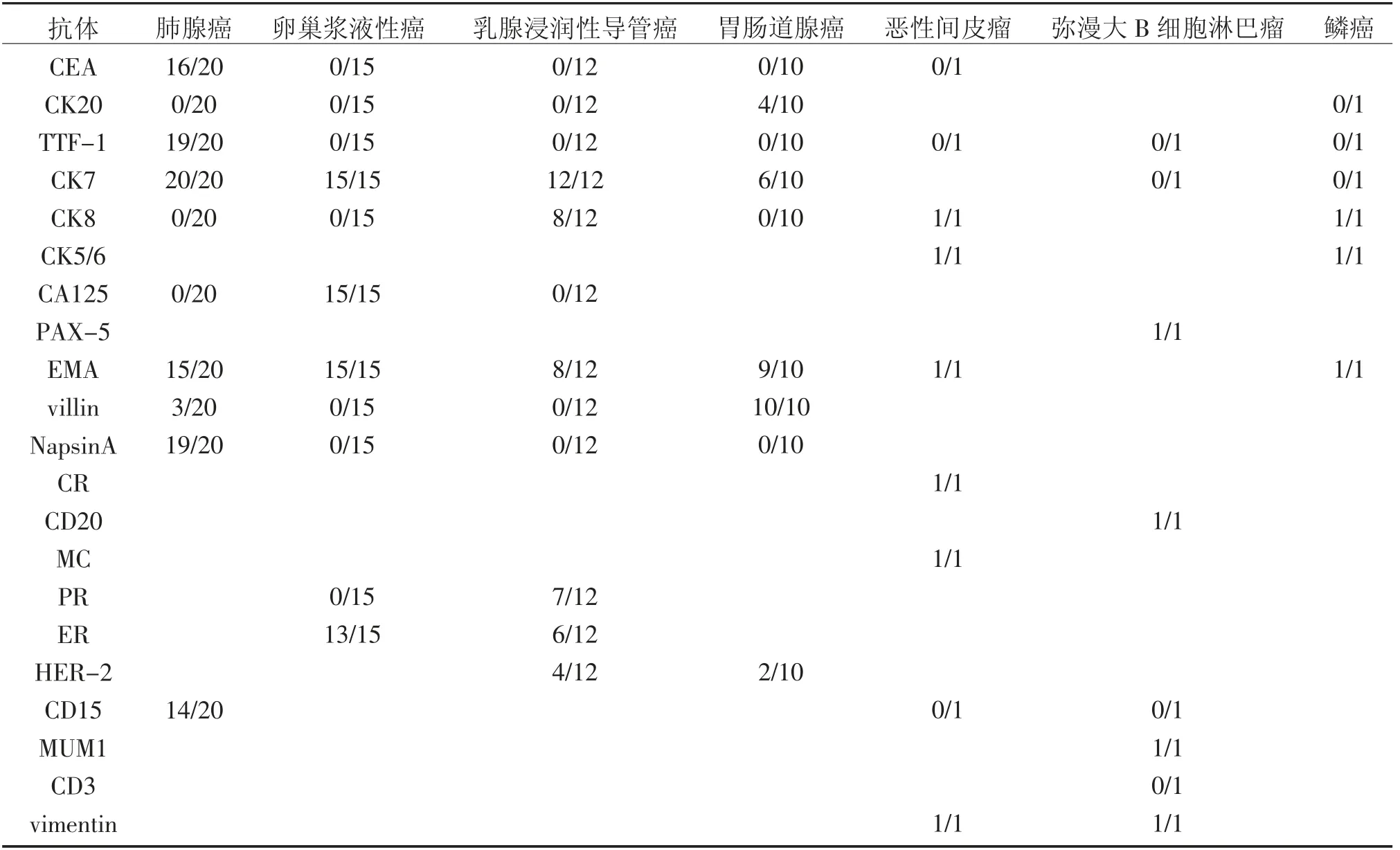
表2 三組患者的惡性腫瘤細胞免疫組化表達(陽性率/總數)
3 討論
漿膜腔積液屬于臨床中較為多發的病癥之一,有時甚至是唯一的臨床癥狀。對于患者來說早期開展疾病良惡性的鑒別診斷對于預后及疾病的治療具有較為積極的意義,準確而有效的鑒別診斷技術是提高患者生存質量、延長患者生存時間的重要保證。因此,在臨床病理中針對惡性漿膜腔積液患者應給予相應的鑒別診斷操作[4]。
以往一般針對惡性漿膜腔積液患者實施常規細胞學涂片檢測及薄層液基細胞技術制片的檢測。在病理鑒別診斷的過程中由于常規細胞學涂片的檢測過程中可能會由于細胞重疊、細胞排列分散、細胞結構不清晰及細胞數量少等等客觀因素的影響增加診斷的難度[5]。而液基薄層細胞技術制片的檢測中保存液雖然能很好的固定標本,還能讓制作的液基薄片減少甚至消除影響因素,具有背景干凈整潔、細胞量聚集、細胞退變較少及細胞平鋪排列等等優點。但檢測的過程中依舊存在著不確定的病例,具有一定的局限性[6]。相對于常規細胞學檢測液基薄層細胞技術制片的檢測來說,細胞蠟塊切片收集的細胞量較大、分布較為均勻,且不存在重疊現象,結構較為清晰,在組織形態上和組織學切片較為類似,能減少漏診及誤診現象的出現[7]。此外,細胞蠟塊切片的檢測還能更好的提高細胞的完整性及切片的數量,提高腫瘤細胞的檢出率,還能對其進行免疫組化染色的檢測,聯合抗體檢測能更好的判斷腫瘤的來源與分類,并能進行基因檢測。免疫組化標志物屬于外科組織病理學中最常見的診斷技術之一,能幫助病理診斷中對腫瘤的良惡性、組織的來源及亞型等進行確診[8]。如在不明來源腺癌的鑒別診斷中可以通過NapsinA、Tg、CK7、TTF-1、villin、CDX-2、ER 、PR、WT-1、CK20、PAX-8、CA125 等等組合明確組織的來源;而對于鱗癌、惡性淋巴瘤等的分類診斷可以通過P63、P40、CK5/6、CD20、CD3、PAX-5、MUM1 等等抗體進行分類診斷[9]。
由此可見,臨床病理工作中在對漿膜腔積液惡性腫瘤細胞的鑒別診斷中單獨通過某一種檢測手段(常規細胞學涂片檢查或薄層液基細胞技術制片檢查)很難鑒別漿膜腔積液惡性腫瘤的類型及來源,通過細胞蠟塊切片結合免疫組化檢測的免疫組化標志物的檢測能很好的提高惡性腫瘤細胞的檢出率,并幫助臨床中判斷腫瘤細胞的來源和分類,為臨床治療提供參考依據。

