基于核心素養(yǎng)構(gòu)建元素化合物認(rèn)知模型教學(xué)設(shè)計(jì)
——以“二氧化硫的性質(zhì)和應(yīng)用”為例
張夢燁
(江蘇省蘇州市東山中學(xué) 江蘇蘇州 215000)
高中化學(xué)的重點(diǎn)內(nèi)容之一就是元素化合物的學(xué)習(xí),這部分內(nèi)容的教學(xué)常以講授為主,學(xué)生的學(xué)習(xí)比較被動(dòng),課堂中的學(xué)生實(shí)驗(yàn)也只是按照已給出的實(shí)驗(yàn)方案進(jìn)行簡單的實(shí)驗(yàn)操作,學(xué)習(xí)過程沒有達(dá)到足夠的思維深度,化學(xué)核心素養(yǎng)目標(biāo)無法在教學(xué)中很好地體現(xiàn)。構(gòu)建元素化合物知識的認(rèn)識模型,是化學(xué)知識骨架的構(gòu)建,對培養(yǎng)學(xué)生創(chuàng)新意識和實(shí)踐能力有重要意義,是落實(shí)化學(xué)學(xué)科核心素養(yǎng)的知識載體。學(xué)習(xí)好元素化合物,有利于學(xué)生構(gòu)建高中化學(xué)知識體系,提高學(xué)生類比同化、歸納演繹、信息加工、分析推理等方面的能力,以及培養(yǎng)學(xué)生的辯證思維和社會責(zé)任[1]。
一、內(nèi)容分析
二氧化硫的性質(zhì)和應(yīng)用是蘇教版高中化學(xué)必修第一冊專題4中第一單元含硫化合物性質(zhì)中的第一課時(shí),含硫化合物的學(xué)習(xí)在氯和鈉元素的學(xué)習(xí)之后,所以該階段,學(xué)生還沒有建立研究元素化合物學(xué)習(xí)的認(rèn)知模型。新版的這節(jié)課與舊版相比改動(dòng)較大,之前以酸雨的形成來引入二氧化硫相關(guān)知識的學(xué)習(xí),而新版的這節(jié)內(nèi)容中更注重二氧化硫?qū)θ祟惿畹淖饔谩?/p>
本節(jié)課以生活中常見的“食品添加劑”為背景來激發(fā)學(xué)生的學(xué)習(xí)興趣。學(xué)生在本課之前,已經(jīng)學(xué)習(xí)了海水中的化合物和氧化還原反應(yīng)等相關(guān)知識,因而不僅在元素化合物的理論知識學(xué)習(xí)方面有基礎(chǔ),而且有能力操作一些簡單的實(shí)驗(yàn)和進(jìn)行探究性實(shí)驗(yàn)的學(xué)習(xí)。
二、教學(xué)目標(biāo)的構(gòu)建
在知識層面上,基礎(chǔ)初中碳及其化合物、高中氯元素和鈉元素化合物性質(zhì)學(xué)習(xí)的基礎(chǔ)和氧化還原反應(yīng)的理論基礎(chǔ)上,需掌握SO2是一種酸性氧化物,具有酸性氧化物的通性,以及SO2的特殊性質(zhì)——還原性、氧化性和漂白性。
在方法層面上,很多學(xué)生對元素化合物知識的學(xué)習(xí)都是通過死記硬背的方式,缺乏元素化合物性質(zhì)研究模型的認(rèn)識。化合物性質(zhì)的研究一般從兩方面進(jìn)行:一是按元素的組成進(jìn)行分類,歸納出該類型物質(zhì)的一般化學(xué)性質(zhì);二是從核心元素的價(jià)態(tài)出發(fā),判斷其性質(zhì)以實(shí)現(xiàn)不同物質(zhì)間的轉(zhuǎn)化[2]。學(xué)生需要會判斷SO2是酸性氧化物,SO2中的S元素的價(jià)態(tài)為+4價(jià)。
在觀念層面上,化學(xué)基本觀念往往隱藏在教材中,以具體知識為載體來挖掘出隱含其中的觀念。本節(jié)課的教材以生活中SO2的應(yīng)用為載體來體現(xiàn)SO2的特殊性質(zhì)。基于以上分析,由此確定教學(xué)目標(biāo)為:
1.基于物質(zhì)類別、元素價(jià)態(tài)對二氧化硫的性質(zhì)作出解釋與預(yù)測;
2.通過觀察和實(shí)驗(yàn)探究,歸納二氧化硫的性質(zhì);
3.認(rèn)識食品中適量添加二氧化硫的作用,辯證分析二氧化硫與人類生活、社會發(fā)展的關(guān)系。
三、設(shè)計(jì)流程
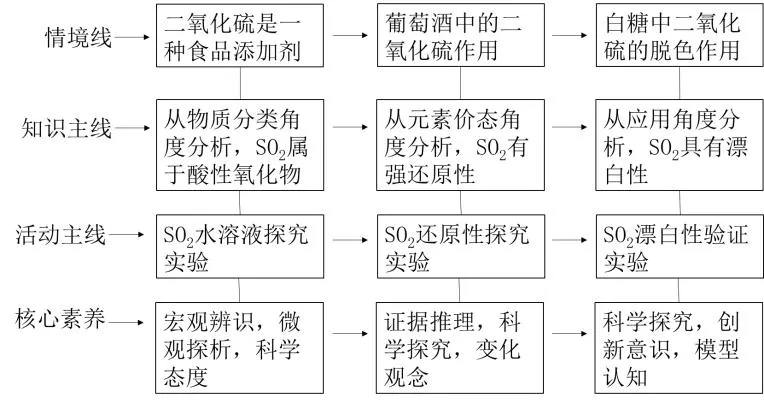
四、教學(xué)過程
環(huán)節(jié)1:情境創(chuàng)設(shè)
問題引導(dǎo):你對食品添加劑有何認(rèn)識?
視頻導(dǎo)入介紹食品添加劑。(引出SO2是一種食品添加劑,打破學(xué)生對二氧化硫只是一種空氣污染物的認(rèn)識,引發(fā)學(xué)生對二氧化硫性質(zhì)的學(xué)習(xí)興趣。)
環(huán)節(jié)2:SO2是酸性氧化物的學(xué)習(xí)
師:展示一瓶用塑料瓶裝的二氧化硫氣體。
生:總結(jié)二氧化硫的物理性質(zhì)。
活動(dòng)探究1:老師演示二氧化硫溶于水的實(shí)驗(yàn),用針筒抽取10mL水注入塑料瓶中,塑料瓶立刻變癟了。
師:二氧化硫溶于水是物理變化還是化學(xué)變化?
學(xué)生實(shí)驗(yàn)1:根據(jù)提供的藥品:SO2水溶液、紫色石蕊試液、PH試紙,學(xué)生設(shè)計(jì)實(shí)驗(yàn)驗(yàn)證SO2溶于水是化學(xué)變化,即驗(yàn)證二氧化硫的水溶液呈酸性。
實(shí)驗(yàn)方案:用針筒抽取1mLSO2水溶液分別擠入裝有紫色石蕊試液的小試劑瓶中和PH試紙上。(用針筒與小試劑瓶做實(shí)驗(yàn),一方面避免了二氧化硫產(chǎn)生的刺激性氣味,另一方面增強(qiáng)了化學(xué)實(shí)驗(yàn)的趣味性。)
生:得出結(jié)論,SO2的水溶液呈酸性。
(SO2的水溶液呈酸性,讓學(xué)生聯(lián)想到SO2是酸性氧化物,用所學(xué)的相關(guān)知識運(yùn)用到問題解決中,分析二氧化硫作為酸性氧化物所具有的化學(xué)性質(zhì),培養(yǎng)系統(tǒng)化的關(guān)于元素化合物知識體系的構(gòu)建。)
師:從物質(zhì)分類角度分析,SO2屬于哪類物質(zhì),有何化學(xué)性質(zhì)?
生:歸納SO2作為酸性氧化物具有的通性并寫出反應(yīng)方程式:與水反應(yīng);與堿性氧化物反應(yīng);與堿反應(yīng)。
環(huán)節(jié)3:SO2具有還原性的學(xué)習(xí)
播放視頻:葡萄酒中添加SO2是干嘛的?
(貼合主題,介紹SO2在食品中的作用之一抗氧化作用,引出SO2具有還原性的學(xué)習(xí)。)
師:從元素價(jià)態(tài)角度分析,為什么SO2有抗氧化作用?
生:利用化學(xué)合價(jià)圖分析SO2的性質(zhì),二氧化硫中S元素價(jià)態(tài)為+4價(jià),S元素可能具有的價(jià)態(tài)有:-2、0、+6,則二氧化硫中S元素價(jià)態(tài)既可以升高也可以降低;說明SO2應(yīng)該既具有還原性又具有氧化性。
教師補(bǔ)充:從化合價(jià)角度分析得到,二氧化硫既具有氧化性又具有還原性,SO2具有強(qiáng)的還原性,而氧化性很弱。那還原性物質(zhì)都能與哪類物質(zhì)發(fā)生化學(xué)反應(yīng)?
學(xué)生實(shí)驗(yàn)2:如何用實(shí)驗(yàn)證明SO2的還原性?
小組討論,根據(jù)提供的藥品:SO2水溶液、BaCl2溶液、H2O2溶液、溴水,設(shè)計(jì)實(shí)驗(yàn)方案,記錄實(shí)驗(yàn)現(xiàn)象以及結(jié)論。
生:1.抽取SO2水溶液1mL加入BaCl2溶液中無明顯現(xiàn)象;2.抽取SO2水溶液1mL加入H2O2溶液中無現(xiàn)象;3.抽取SO2水溶液1mL加入溴水中黃色褪去。
分析:二氧化硫水溶液使溴水褪色,即發(fā)生化學(xué)反應(yīng):
SO2+Br2+2H2O===H2SO4+2HBr
師:如何利用現(xiàn)有的溶劑證明此反應(yīng)是生成了硫酸與溴化氫?
教師補(bǔ)充實(shí)驗(yàn)1:在加了SO2水溶液的溴水小瓶子中加入BaCl2溶液,有白色沉淀產(chǎn)生,反應(yīng)后的溶液中有SO42-則說明SO2被Br2氧化成了SO42-。
教師補(bǔ)充實(shí)驗(yàn)2:在加了SO2水溶液的H2O2溶液小瓶子中也加入BaCl2溶液,也有白色沉淀生成,說明SO2被H2O2氧化成了SO42-,SO2+H2O2===H2SO4。
(利用反驗(yàn)證的實(shí)驗(yàn)方式,建立了結(jié)論與證據(jù)之間的邏輯關(guān)系,鍛煉了學(xué)生的證據(jù)推理能力,并培養(yǎng)嚴(yán)謹(jǐn)求實(shí)的科學(xué)態(tài)度。)
歸納總結(jié):SO2具有較強(qiáng)的還原性,可被多種氧化劑(如O2、Cl2、Br2、I2、HNO3、KMnO4、H2O2等)氧化。
師:給你們提供的是SO2的水溶液而不是SO2,水溶液中還有亞硫酸,這是否會影響?
(引發(fā)學(xué)生思考,培養(yǎng)學(xué)生科學(xué)探究精神,并聯(lián)系到二氧化硫水溶液的學(xué)習(xí)。)
師:亞硫酸中的硫化合價(jià)也為+4價(jià),也具有還原性,而且在酸性條件下,亞硫酸的還原性增強(qiáng),所以亞硫酸容易被氧化。
教師補(bǔ)充實(shí)驗(yàn)3:打開加了SO2水溶液的BaCl2溶液的小玻璃瓶,晃動(dòng)一下,溶液變渾濁,由于亞硫酸極易被空氣中的氧氣氧化成硫酸。
師:作為弱酸,亞硫酸不僅容易被氧化,還不穩(wěn)定易分解,亞硫酸的分解反應(yīng)可參照碳酸的分解方程式。
生:學(xué)生填寫學(xué)案,總結(jié)關(guān)于亞硫酸的性質(zhì)。(用類比的方式,讓學(xué)生與之前的所學(xué)聯(lián)系,來構(gòu)建元素化合物學(xué)習(xí)的認(rèn)知模型。)
環(huán)節(jié)4:SO2具有漂白性的學(xué)習(xí)
師:引出日常攝入的白糖,從白糖中的SO2過渡到接下來的學(xué)習(xí)內(nèi)容。(呼應(yīng)主題,介紹SO2在食品中的作用之漂白劑,引出SO2具有漂白性的學(xué)習(xí),并從介紹二氧化硫漂白性的性質(zhì)運(yùn)用上,培養(yǎng)學(xué)生的食品安全方面的法律法規(guī)意識。)
師:介紹白糖的工藝流程,二氧化硫用于脫色,這說明了二氧化硫具有漂白性。
學(xué)生實(shí)驗(yàn)3:二氧化硫漂白性的探究
將二氧化硫水溶液注入裝有品紅溶液的小試劑瓶中,品紅溶液褪色。
(實(shí)驗(yàn)得出二氧化硫具有漂白性,與之前學(xué)的具有漂白性的物質(zhì)新制氯水相聯(lián)系,由此對比來得出二氧化硫的漂白性是暫時(shí)的,利用對比的形式學(xué)習(xí),能讓學(xué)生的印象更深刻,并能更好地理解漂白性原理的差異。)
師:我們之前學(xué)的還有一種具有漂白性的物質(zhì)是誰?還記得新制氯水滴在PH試紙上是什么現(xiàn)象嗎?
生:次氯酸具有漂白性,新制氯水滴在PH試紙上,試紙的中間是白的周圍顯紅色。
師:而二氧化硫水溶液滴在PH試紙上只顯紅色,而且二氧化硫水溶液加入紫色石蕊試液中后,紫色石蕊試液只是變紅了,這就是二氧化硫漂白性的特點(diǎn),它只能使部分有色物質(zhì)褪色,我們在剛剛的操作上再加一步,我們加熱這液體,看看有什么神奇的現(xiàn)象會發(fā)生。
教師補(bǔ)充實(shí)驗(yàn)4:取學(xué)生實(shí)驗(yàn)后的溶液倒入試管中,在試管上套上氣球,加熱試管,品紅溶液又恢復(fù)紅色。
師:這就是二氧化硫漂白性的特點(diǎn),只能使部分有色物質(zhì)褪色而且這個(gè)漂白性是暫時(shí)的,二氧化硫的漂白原理是與有色物質(zhì)發(fā)生化合反應(yīng),生成一種無色物質(zhì),而且該無色物質(zhì)不穩(wěn)定,在光照或加熱條件會分解。利用二氧化硫這樣的性質(zhì),可以用來漂白紙張、草帽,甚至一些不良商家用二氧化硫來漂白一次性筷子。
學(xué)生總結(jié):二氧化硫與次氯酸的漂白原理不同,二氧化硫的漂白是暫時(shí)性的,而次氯酸的漂白是永久性的,并且SO2不能使指示劑褪色。
(總結(jié)高中涉及的三類漂白原理,讓學(xué)生把前后關(guān)于漂白性的知識進(jìn)行整合,以增強(qiáng)記憶。)
環(huán)節(jié)5:SO2的知識點(diǎn)總結(jié)
最后以價(jià)態(tài)—類別二維圖來進(jìn)行本節(jié)課的知識點(diǎn)總結(jié)。
五、總結(jié)與反思
(一)以課程標(biāo)準(zhǔn)為基礎(chǔ)制定素養(yǎng)目標(biāo)是構(gòu)建元素化合物認(rèn)知模型的前提
課程標(biāo)準(zhǔn)要求中提出結(jié)合真實(shí)情景中的應(yīng)用實(shí)例或通過實(shí)驗(yàn)探究,了解硫及其重要化合物的主要性質(zhì),認(rèn)識二氧化硫在生產(chǎn)中的應(yīng)用和對生態(tài)環(huán)境的影響[3]。依據(jù)課程標(biāo)準(zhǔn),結(jié)合學(xué)業(yè)要求與學(xué)生的實(shí)際情況,本節(jié)課主要突出學(xué)習(xí)二氧化硫的還原性與漂白性,其他性質(zhì)則一筆帶過,由于本節(jié)課涉及內(nèi)容較多導(dǎo)致容量較大,沒有多余的時(shí)間進(jìn)行課堂練習(xí)。
(二)體驗(yàn)性的實(shí)驗(yàn)是構(gòu)建元素化合物認(rèn)知模型的基礎(chǔ)
核心素養(yǎng)中提出“科學(xué)探究與創(chuàng)新意識”,要求能從問題和假設(shè)出發(fā),依據(jù)探究目的,設(shè)計(jì)探究方案,運(yùn)用化學(xué)實(shí)驗(yàn)進(jìn)行實(shí)驗(yàn)探究。本節(jié)課利用針筒與小玻璃瓶作為實(shí)驗(yàn)儀器,在無污染,綠色化學(xué)的條件下激發(fā)了學(xué)生的學(xué)習(xí)興趣,利用這樣的微型實(shí)驗(yàn)方式,從實(shí)踐層面激勵(lì)了學(xué)生勇于創(chuàng)新的實(shí)驗(yàn)精神。
(三)多種教學(xué)方式是構(gòu)建元素化合物認(rèn)知模型的保障
本節(jié)課利用多種教學(xué)手段來完成教學(xué)目標(biāo),如用學(xué)生感興趣的食品添加劑來拉近與學(xué)生之間的距離,用趣味性的實(shí)驗(yàn)操作來引發(fā)學(xué)生對本節(jié)課的學(xué)習(xí)興趣,用師生互動(dòng)性的探究方式培養(yǎng)學(xué)生的實(shí)驗(yàn)探究能力,充分發(fā)揮了教師的主導(dǎo)作用和學(xué)生的能動(dòng)性。
- 科學(xué)咨詢的其它文章
- 小初英語銜接教學(xué)的策略研究
——以龍崗區(qū)外國語學(xué)校七年級學(xué)生為例 - 管窺語文教學(xué)的“讀寫結(jié)合”
——以《一棵小桃樹》為例 - 預(yù)習(xí),收獲未知的精彩
——“分?jǐn)?shù)的初步認(rèn)識”教學(xué)案例 - 淺談動(dòng)畫情景互動(dòng)式課堂教學(xué)
——以《消化與吸收》為例 - 農(nóng)村薄弱學(xué)校的讀后續(xù)寫教學(xué)實(shí)踐探究
——以“Passing Happiness on”為例 - 深度學(xué)習(xí)三步曲
——以小學(xué)語文閱讀教學(xué)為例

