叉頭框轉錄因子O亞族3a對結腸癌SW620細胞的影響及機制研究
馮 婷,劉 霞,高立勇
(1.鄭州大學護理學院病理教研室,河南 鄭州 450052;2.徐州市第一人民醫院病理科,江蘇 徐州 221200)
最新發布的中國惡性腫瘤流行病學數據顯示,大腸癌發病率位居第四,病死率排名第五。隨著外科手術和化學療法的不斷改進,大腸癌的治療也不斷改善,但仍有大部分患者出現復發和轉移。究其原因,外科手術及術后化療主要針對大腸癌腫瘤病灶,而沒有針對分裂、增殖能力和異質性分化更強的大腸癌干細胞。已有很多證據表明大腸癌是一種干細胞疾病,由正常大腸隱窩干細胞基因突變所致。近年來,腫瘤干細胞成為腫瘤治療的研究熱點。腫瘤干細胞是具有干細胞和腫瘤細胞雙重特征,能夠自我復制、多向分化的一種胞細,具有抵抗凋亡、致瘤及轉移潛能[1-2]。研究證明叉頭框轉錄因子O亞族(Forkhead box transcription factor O,FOXO)在造血干細胞長期維持中起著關鍵作用。因此,本研究探討FOXO3a對人結腸癌SW620細胞的影響并分析其機制。
1 材料與方法
1.1 實驗材料 人結腸癌SW620細胞由徐州醫科大學病理實驗室饋贈;RPMI-1640培養基、胰蛋白酶消化液、二甲基亞砜(DMSO)、Lipofecte脂質體轉染試劑、TRIzol試劑、cDNA第一鏈合成試劑盒、兔抗人FOXO3a單克隆抗體(批號:19121094)、兔抗人OCT4抗體(批號:19101875)和兔抗人CD133抗體(批號:19023654)均購自北京中杉公司;OPTI-MEN轉染液購自羅氏公司;引物、FOXO3a過表達載體(P-EGFP-FOXO3a)及對照載體(P-EGFP)由上海生工構建。
1.2 實驗方法
1.2.1 人結腸癌SW620細胞培養及轉染:人結腸癌SW620細胞放置于37 ℃、5% CO2孵育箱中培養。培養條件:細胞置于富含10%胎牛血清、青霉素100 U/ml、鏈霉素100 U/ml 的RPMI-1640培養液中。實驗分成對照組、空白載體組、載體組三組。各組細胞按照每孔6×105/ml接種于六孔板,使每孔細胞飽和度在轉染前達到60%~70%,依照轉染試劑說明書分別轉染P-EGFP和P-EGFP-FOXO3a。
1.2.2 細胞生長抑制率測定(MTT法):先用0.05%胰蛋白酶處理結腸癌SW620細胞,制成5×104/ml的細胞懸液后接種在24孔板中,每組設6個復孔。先在恒溫培養箱中培養48 h,再在各組細胞中加入20 μl MTT(5 mg/ ml)繼續孵育4 h后取出,在室溫下靜置5 min,吸去上清后每孔再加入150 μl DMSO,輕微搖床振蕩10 min使之充分溶解。在酶標儀波長570 nm 下比色測定OD值并計算抑制率。生長抑制率(%)=(1-實驗孔平均OD值/對照孔平均OD值)×100%。
1.2.3 轉染后FOXO3a、CD133、八聚體結合轉錄因子4(OCT4)蛋白陽性表達檢測:將預處理好的蓋玻片置入24孔板,接種SW620細胞(6×104/孔),培養細胞密度約30%~50%時轉染P-EGFP-FOXO3a,孵育48 h后棄液,細胞玻片用PBS 洗滌3 min×3次,4%多聚甲醛固定30 min后用中性樹膠將其封于載玻片上。按照免疫組化試劑盒說明書嚴格質控操作,設置對照組(以PBS代替一抗)。FOXO3a蛋白陽性表達定位在胞核/質上,顯示為棕褐色或棕黃色顆粒。隨機選取高倍鏡下5~10個視野觀察(每個視野細胞數>100個),按陽性細胞所占百分比進行評價。
1.2.4 反轉錄-聚合酶鏈反應(RT-PCR)檢測FOXO3a、CD133、OCT4 mRNA表達:TRIzol法提取各組細胞轉染總的RNA。紫外分光光度計下計算RNA純度及含量,以Oligo(dT)為引物,以1.5 μg總RNA 為模板合成cDNA。再以cDNA為模板,以β-actin為內參照進行PCR擴增反應。FOXO3a正向引物序列為5’-AGGGAAGTTTGGTCAATCAGAA-3’,反向引物序列為5’-TGGAGATGAGGGAATCAAA-GTT-3’,產物大小369 bp;CD133正向引物序列為5’- CGGGATCCGAAAAACTGATCTGT-3’,反向引物序列為5’-GAACC CCGCTCGAGTTACCTAGT-TACTCTCTCC-3’,產物大小615 bp;OCT4正向引物序列為5’-TCTCCAATTACATTCCCACCA-3’, 反向引物序列為5’-CAGGGACTCAGAACACAGGAG-3’,產物大小381 bp;β-actin正向引物序列為5’-AAATCTGGCACCACACCTT-3’, 反向引物序列為5’-TAGCACAGCCTGGATAGCAA-3’,產物大小189 bp。PCR擴增條件:95 ℃預變性30 s;65 ℃ 30 s,退火FOXO3a 65 ℃ 35 s,CD133 60 ℃ 40s,OCT4 60 ℃ 45 s,72 ℃延伸3 min,共30個循環。取10 μl PCR產物在1%瓊脂糖凝膠電泳跑膠后拍照記錄結果,分析靶基因與相應β-actin mRNA條帶灰度值,實驗重復3次后取平均值。
1.2.5 Western blot檢測FOXO3a、CD133、OCT4蛋白表達:分別轉染P-EGFP和P-EGFP-FOXO3a 48 h后提取各組總蛋白,“三明治法”將其轉移至PVDF膜上,加入稀釋好的一抗4 ℃孵育過夜(稀釋比例:FOXO3a 1∶500,CD133 1∶200,OCT4 1∶200)。次日TBS緩沖液洗膜10 min×3次,加入辣根過氧化物酶標記的二抗(1∶500稀釋)后曝光顯影。采用Gel-Doc圖像分析軟件測定條帶灰度值,分析FOXO3a、CD133、OCT4蛋白與內參蛋白光密度值,比較各蛋白表達變化。
1.2.6 細胞遷移侵襲實驗(Transwell法):將三組細胞經胰酶消化后,以每組約105個細胞種在Transwell小室上層,48 h后PBS淋洗,再用棉簽輕拭去表層未遷移的細胞,收集遷移至濾膜下層的細胞,經甲醇固定、HE染色后,于倒置顯微鏡下(10個視野,×200)計數濾膜下層細胞數來評估穿膜細胞。
1.3 統計學方法 采用SPSS 19.0統計學軟件進行分析。計量資料以均數±標準差表示,組間比較采用單因素方差分析。對方差分析有統計學差異的資料,進一步采用REGWQ法進行多組均數間兩兩比較。以α=0.05為檢驗水準。
2 結 果
2.1 三組細胞生長抑制率比較 載體組細胞生長抑制率為(26.79±0.64)%,對照組和空白載體組細胞生長抑制率分別為(7.11±3.04)%和(8.10±0.26)%,載體組SW620細胞生長抑制率明顯高于對照組和空白載體組(t=2.891、2.990,均P<0.05)。
2.2 三組細胞轉染后FOXO3a、CD133、OCT4蛋白表達陽性率比較 見表1(圖1)。與對照組和空白載體組相比,載體組FOXO3a蛋白表達陽性率增加,CD133和OCT4蛋白表達陽性率下降(均P<0.05)。

圖1 SW620細胞轉染后FOXO3a、CD133、OCT4蛋白表達情況(免疫組化染色,×200)

表1 三組細胞轉染后FOXO3a、CD133、OCT4蛋白表達陽性率比較(%)
2.3 三組細胞FOXO3a、CD133、OCT4 mRNA相對表達水平比較 見表2。FOXO3a(369 bp)、β-actin(189 bp)、CD133(615 bp)、β-actin(189 bp)和OCT4(381 bp)、β-actin(189 bp)擴增產物在電泳后擴增片段大小與設計大小均顯示一致。與對照組與空白載體組比較,載體組FOXO3a mRNA相對表達水平明顯提高,CD133、OCT4 mRNA相對表達水平下降明顯(均P<0.05)。對照組與空白載體組FOXO3a、CD133、OCT4 mRNA相對表達水平比較差異無統計學意義(均P>0.05)。
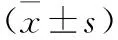
表2 三組細胞FOXO3a、CD133、OCT4 mRNA相對表達水平比較
2.4 三組細胞FOXO3a、CD133、OCT4蛋白相對表達水平比較 見表3。與對照組和空白載體組相比,載體組FOXO3a蛋白相對表達水平明顯提高(P<0.05),CD133、OCT4 蛋白相對表達水平則顯著降低(均P<0.05)。對照組和空白載體組FOXO3a、CD133、OCT4蛋白相對表達水平比較差異無統計學意義(均P>0.05)。
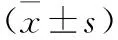
表3 三組細胞FOXO3a、CD133、OCT4蛋白相對表達水平比較
2.5 三組細胞遷移侵襲能力比較 載體組細胞穿膜數為(7.270±0.650)個,對照組與空白載體組細胞穿膜數分別為(12.810±1.646)個和(12.001±1.775)個。與對照組和空白載體組相比,載體組細胞穿膜數顯著降低(均P<0.05)。對照組與空白載體組細胞穿膜數比較差異無統計學意義(P>0.05)。
3 討 論
大腸癌在全球范圍內均是消化道常見惡性腫瘤之一[3-4]。近年來,國內外對大腸癌的發病機制及治療做了很多研究,認為腫瘤干細胞與正常干細胞相似,并且是腫瘤發生、增殖、轉移和復發的根源。大腸癌腫瘤細胞起源于大腸隱窩干細胞,也是一種干細胞啟動的疾病,基因突變和異常增殖是其發生的原始因素。相繼報道的腫瘤干細胞標記物為重新認識腫瘤起源、性質以及為腫瘤干細胞鑒別和癌癥靶向治療等提供了一個新的方向和視角。
CD133是一種五次跨膜糖蛋白,在正常組織中和腫瘤中均有表達,被公認為結直腸癌中常見的腫瘤干細胞標記物,表達水平高低影響腫瘤預后,已在結腸、腦、前列腺等腫瘤被鑒別出來[5-7]。研究表明大腸癌細胞只存在于CD133+癌細胞中,且每262個CD133+癌細胞中就有1個大腸癌干細胞存在,能在NOD/SCID小鼠模型上種植并長出腫瘤,且具有轉移能力[8-12]。
OCT4也被證明是胚胎干細胞、生殖細胞的標記物,已在成體組織中發現OCT4 表達陽性的細胞。它也是第一個被發現只在全能和多能細胞中表達的轉錄因子,不但參與胚胎干細胞和原始生殖細胞的自我更新,維持細胞全能性,還能直接控制胚胎干細胞分化方向[13-14]。成體組織中表達OCT4的細胞主要局限在具有干細胞特性的細胞中,如皮膚基底細胞層中的細胞以及胃、肝、乳腺干細胞等。OCT4是癌癥干細胞樣細胞亞群,能夠導致腫瘤耐藥和復發,是潛在的癌癥治療靶點[15]。研究發現將OCT4基因導入大腸癌細胞后,可使腫瘤細胞惡性轉化加速,其表達水平高低與腫瘤細胞惡性程度有關,高表達能提高腫瘤惡性程度,而失活或低表達能使腫瘤惡性程度得到遏制。可見OCT4能夠調控腫瘤的進展、侵襲行為和轉移能力。FOX基因編碼產物稱為FOX蛋白家族,FOXO3a是FOX家族O亞族的核心,參與調節其他成員的基因表達,該家族成員都有一長約110個氨基酸的高度保守的DNA結合域(即FOX結構域),在細胞增殖、凋亡、分化、應激及內環境穩態等細胞生命過程中發揮重要作用[16-20]。已有研究證實,FOXO3a在多種腫瘤中呈低表達,但在調控腫瘤發生、增殖、遷移、侵襲等方面扮演重要角色,且影響著腫瘤的預后。
本研究前期實驗發現大腸癌中FOXO3a也呈低表達。我們通過轉染FOXO3a過表達載體作用于大腸癌SW620細胞觀察FOXO3a、CD133、OCT4 mRNA和蛋白相對表達水平的變化。本實驗結果表明,轉染FOXO3a過表達載體可有效提高FOXO3a基因的表達,能夠抑制大腸癌SW620細胞增殖,RT-PCR、Western blot檢測結果提示載體組干細胞因子CD133和OCT4 mRNA和蛋白相對表達水平均顯著降低,證實FOXO3a表達變化會引起干細胞因子的變化。遷移侵襲實驗結果顯示,與對照組和空白載體組相比,載體組細胞穿膜數明顯降低,表明大腸癌SW620細胞遷移侵襲能力明顯減弱,進而驗證了FOXO3a能對大腸癌干細胞產生殺傷作用。
綜上所述,FOXO3a可抑制SW620細胞增殖,減弱其遷移侵襲能力,其機制可能與降低CD133、OCT4表達有關。目前臨床應用的抗腫瘤藥物比較豐富,如果將P-EGFP-FOXO3a聯合其他抗腫瘤藥協同治療大腸癌,可能會有更好的療效。

