關節鏡下納米微骨折骨髓刺激增強術聯合沖擊波治療膝骨性關節炎軟骨損傷臨床療效觀察
王瑞松,全 健,李 銳,王彥鵬,黃小強,殷繼超,劉瑞宇,楊利學,董 琪,賀利軍
(1.西安市第五醫院骨科,陜西 西安 710082;2.陜西省中醫醫院骨傷科,陜西 西安 710003;3.西安交通大學第二附屬醫院骨科,陜西 西安 710004;4.陜西中醫藥大學附屬醫院骨科,陜西 咸陽 712000)
納米微骨折骨髓刺激增強術是保膝治療的一項關鍵技術,也是近幾年軟骨修復領域興起的一項熱門新技術。它是在傳統微骨折技術的基礎上創新、優化、改進發展而來的,繼承了傳統微骨折技術的優點,改進了技術的缺陷。關節鏡下納米微骨折骨髓刺激增強術治療膝骨性關節炎(Knee osteoarthritis,KOA)軟骨損傷,具有微創、操作簡單、費用低及見效快等優勢[1]。體外沖擊波治療(Extracorporeal shock wave therapy,ESWT)是一種無創治療方式,對骨肌系統疾病安全有效,在納米微骨折術后可持續提供軟骨再生所需要的生長因子[2]。本研究觀察關節鏡下納米微骨折骨髓刺激增強術聯合ESWT治療KOA軟骨損傷臨床效果,現報告如下。
1 資料與方法
1.1 一般資料 收集2019年6月至2020年10月就診于我院骨科的KOA軟骨損傷患者72例,隨機分為治療組和對照組,各36例。兩組患者一般資料比較無統計學差異(均P>0.05),見表1。病例納入標準:符合中華醫學會骨科學分會制定的《骨關節炎診療指南(2018年版)》關于膝骨關節炎的診斷標準[3];年齡40~60歲;MRI顯示股骨遠端關節面軟骨缺損≤3.0 cm2;術前行MRI或關節鏡檢查與評估,國際軟骨修復協會(ICRS)分型軟骨損傷Ⅱ-Ⅳ度[4];患者及家屬同意并簽署知情同意書。排除標準:軟骨缺損>3 cm2;關節嚴重畸形(內、外翻畸形角度>30°);嚴重骨質疏松癥;同側膝關節周圍骨折或術后;對側肢體功能障礙;炎癥性關節炎(感染期);腫瘤所致軟骨損傷;合并嚴重肝功能異常或腎功能障礙;合并嚴重心、腦、肺疾病等;有精神疾患不能配合手術及術后康復者[5]。本研究經醫院醫學倫理委員會批準。

表1 兩組患者一般資料比較
1.2 治療方法
1.2.1 治療組:麻醉滿意后,患者仰臥位,常規消毒鋪無菌巾,在關節鏡下行膝關節探查術,明確軟骨缺損面積及形態。關節清理術后取除松動軟骨,清除鈣化軟骨層,修整缺損邊緣,用直徑1 mm克氏針進行軟骨下骨微骨折鉆孔,間距2~3 mm,直徑1 mm,限深13 mm。垂直于軟骨面勻速鉆孔,孔洞垂直、獨立,刺激骨髓,出針后骨髓液滲出。骨髓液中有豐富的骨髓干細胞和促軟骨生長因子,可分化成纖維軟骨細胞,黏附、填充軟骨缺損區域,修復軟骨缺損[5]。術畢沖洗縫合,無菌敷料包扎。
1.2.2 對照組:麻醉生效后消毒鋪巾,在關節鏡下探查清理膝關節后采用微骨折器(錐形)在軟骨缺損區域鉆孔,間距3 mm,最大直徑2 mm,深度3 mm。術畢沖洗縫合,無菌敷料包扎。
1.2.3 術后處理:兩組術后均給予預防感染、改善循環、促進骨愈合等對癥治療。術后第2天兩組患者均行ESWT治療:采用體外沖擊波治療儀(DJO FRANCE SAS公司)對患膝關節軟骨缺損側治療,能流密度0.2 mJ/mm2,沖擊頻率10 Hz,壓強300 kPa,沖擊2000次,1次/周,共3次。兩組患者均于術后第1天開始循序漸進不負重關節功能鍛煉,3周后部分負重功能鍛煉,8周后負重行走,12周后正常活動。
1.3 觀察指標 ①比較兩組臨床療效以及術后復發、軟骨修復達標及關節功能恢復情況。臨床療效判定標準:軟骨完全愈合為痊愈;軟骨愈合面積愈合≥80%為顯效;軟骨愈合面積愈合≥50%為有效;軟骨愈合面積<50%或軟骨缺損面積擴大等為無效[6]。總有效率=(痊愈+顯效+有效)例數/總例數×100%。②比較兩組患者治療前后血沉(ESR)、C-反應蛋白(CRP)、白細胞介素-1β(IL-1β)和腫瘤壞死因子-α(TNF-α)水平。③比較兩組患者術后美國特種外科醫院膝關節功能量表(HSS)評分及膝關節疼痛視覺模擬量表(VAS)評分。HSS總分100分,包括功能、活動度、疼痛、屈曲畸形、穩定性和肌力幾部分。VAS總分10分,無痛計0分;輕度疼痛,可以忍受,計1~3分;中度疼痛,計4~6分;劇烈疼痛,忍受有限,計7~10分;疼痛不可忍受,計10分[7]。④比較兩組患者不良反應發生情況。
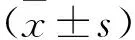
2 結 果
2.1 兩組患者臨床療效比較 見表2。治療組總有效率(97.22%)與對照組總有效率(61.11%)比較,差異有統計學意義(P<0.05)。

表2 兩組患者臨床療效比較[例(%)]
2.2 兩組患者術后復發、軟骨修復達標及關節功能恢復情況比較 根據中華醫學會外科學會外科功能評定標準[6]:隨訪6~12個月,治療組術后無復發,軟骨修復達標35例(97.22%),關節功能恢復36例(100%);對照組術后復發15例(41.67%),軟骨修復達標22例(61.11%),關節功能恢復27例(75.00%)。治療組術后復發、軟骨修復達標及關節功能恢復優于對照組(均P<0.05)。
2.3 兩組患者治療前后ESR、CRP、IL-1β、TNF-α水平比較 見表3。與術前比較,兩組ESR、CRP、IL-1β、TNF-α水平均降低,且治療組低于對照組(均P<0.05)。
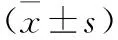
表3 兩組患者治療前后ESR、CRP、IL-1β、TNF-α水平比較
2.4 兩組患者術后HSS、VAS評分比較 見表4。兩組術前HSS、VAS評分比較無統計學差異(均P>0.05)。治療組術后1、3個月HSS評分高于對照組,VAS評分低于對照組(均P<0.05)。

表4 兩組患者術后HSS、VAS評分比較(分)
2.5 兩組患者不良反應發生情況比較 見表5。治療組不良反應總發生率低于對照組(P<0.05)。

表5 兩組患者不良反應發生情況比較[例(%)]
3 討 論
膝關節軟骨損傷是臨床常見的骨科疾病之一,損傷后出現關節疼痛、關節功能障礙,嚴重影響患者的工作與生活質量[8]。在臨床實踐中,多數老年OA患者選擇人工關節置換治療;對于30~50歲的患者,根據關節損傷機制以及損傷程度選擇適合的綜合保膝治療方案。
軟骨損傷后自我修復能力差是由關節軟骨無血管和軟骨細胞低分裂的特性所決定的[9]。轉錄生長因子β(TGF-β)超家族、纖維原細胞生長因子(FGF)家族、IL-1β、IL-6、IL-8、TNF-α等在軟骨損傷后均參與調節軟骨的生成[10]。關節軟骨缺損后,疼痛刺激滑膜細胞釋放炎性細胞因子,骨膜細胞會誘發慢性炎癥,關節液內TNF-α、IL-1β水平越高,關節癥狀越嚴重[11]。目前臨床中軟骨修復的方法很多,在疾病發展的早期,藥物關節腔內注射、物理治療、中西醫藥內服外治等保守治療可緩解臨床癥狀,但不能修復關節軟骨,不能促進軟骨再生[12]。臨床實踐證明,富含血小板血漿、間充質干細胞(MSC)、生長因子等優于基礎藥物治療[13]。在骨外科手術治療領域,軟骨修復措施主要有微骨折術、軟骨細胞移植術、骨軟骨移植術等,微骨折術手術適應證是軟骨缺損小于3 cm2,軟骨細胞移植或骨軟骨移植手術治療適用于軟骨缺損3~4 cm2者[14]。納米微骨折骨髓刺激增強術有著其他手術及藥物治療不可替代的作用,是軟骨再生的關鍵技術之一。本研究在傳統微骨折技術基礎上創新使用納米微骨折骨髓刺激新術式,將生物機械性能與微骨折術再生能力相結合,不但穩定骨髓血凝塊,還提供MSC黏附、增殖和軟骨組織修復微環境[15]。但是因為術后軟骨修復所需要的骨髓間充質干細胞和生長因子不能得到持續供給,因此本研究采用關節鏡下納米微骨折骨髓刺激增強術聯合沖擊波治療膝關節軟骨損傷,以持續提供骨髓間充質干細胞和生長因子。
本研究中,在關節軟骨缺損裸露區上鉆孔后,孔洞中的血凝塊能夠提供纖維蛋白網絡支架,釋放間質干細胞,刺激、誘導TGF-β3因子軟骨化,遷移并增殖透明軟骨樣軟骨組織,分化成透明軟骨樣纖維軟骨,其生物力學特性、穩定性非常接近透明軟骨[16]。若要提高療效,關鍵在于提高軟骨缺損處骨髓間充質干細胞(BMMSCs)水平及其周圍基質成分含量,提供MSC分化與生長所需微環境,誘導透明軟骨形成[17]。BMMSCs是成骨細胞前體,可促進成骨和軟骨再生,刺激軟骨缺損的多層修復。BMMSCs從骨髓遷移至骨表面,黏附、分化、產生細胞外基質進行立體修復[18]。在軟骨缺損區域對軟骨下骨進行有效骨髓刺激,網格狀微骨折線有利于BMMSCs、生長因子、相關蛋白等的滲出,血凝塊的黏附,促進分化成為纖維軟骨組織,從而達到修復軟骨的目的。BMMSCs促進OA軟骨修復有明顯優勢[19]。納米微骨折術聯合ESWT治療使納米級的微骨折孔洞中持續滲出骨髓液,源源不斷地提供BMMSCs和生長因子,以促進修復軟骨。李宏宇等[20]研究提示,ESWT通過降低關節內NO水平及軟骨細胞凋亡來延緩KOA進展。納米微骨折術刺激骨髓釋放充足的自體BMMSCs,ESWT持續刺激釋放BMMSCs,促進關節表面骨軟骨的再生修復[21]。
軟骨再生技術的研究是一項意義重大工程,目前沒有一個完美的、永久性修復軟骨缺損的手術治療方法。本研究在關節鏡下應用納米微骨折骨髓刺激增強術聯合沖擊波治療膝骨關節軟骨缺損,術中獲得了最大的有效骨髓刺激量,最大限度地釋放了BMMSCs和生長因子;術后ESWT誘導MSC的增殖、分化,持續提供BMMSCs和軟骨生長因子,加速了軟骨修復進程,緩解了關節疼痛,改善了關節功能,臨床效果顯著。
綜上所述,關節鏡下納米微骨折骨髓刺激增強術聯合ESWT治療KOA軟骨損傷治療效果顯著,操作簡單,微創安全,患者恢復快,是中青年軟骨損傷患者人工關節置換前的理想選擇之一。本研究優勢在于:①采用關節鏡下納米微骨折骨髓刺激增強術,均勻鉆孔深入骨髓,避免了骨小梁的壓縮,骨髓液均勻滲出,BMMSCs充分遷移、增殖、分化,為纖維軟骨形成提供纖維蛋白網絡支架。②ESWT治療持續改善微骨折術后軟骨修復的微環境,有利于軟骨再生,顯著提高軟骨修復的效率。雖然目前干細胞技術和軟骨支架技術等組織工程在關節軟骨修復領域取得了前所未有的突破,但是目前沒有任何一種技術能夠改變關節軟骨的自然結構和成分。本研究也存在不足之處:①軟骨修復術后再生的纖維軟骨比原始透明軟骨的機械穩定性差,本項技術不能改變關節軟骨的自然結構和成分。②缺乏術后多次MRI以及關節鏡復查等客觀臨床療效評價。期望未來的研究能從模擬軟骨成分、構造關節軟骨的結構出發,以組織工程學、生物化學、骨生物力學等專業角度更深入地研究關節軟骨再生技術。

