外周血T細胞免疫球蛋白黏蛋白-3和血清乳酸脫氫酶聯合檢測在骨髓增生異常綜合征診斷中的應用價值
李榮芳,金 龍,趙立丹
(西安市第九醫院老年病科,陜西 西安 710054)
骨髓增生異常綜合征(Myelodysplastic syndrome,MDS)是造血干細胞惡性疾病,早期主要表現為骨髓造血干細胞凋亡、分化成熟障礙等,中期主要表現為惡性克隆性原始細胞凋亡數量減少,呈現向急性白血病轉化的特點[1]。該病常見于老年人群,發病相對隱匿,常導致臨床漏診及誤診,增加急性白血病的發生風險[2-3]。另外, MDS患者中約90%在確診時骨髓呈現增生性活躍狀態,伴隨外周血細胞水平降低,此為無效造血,可嚴重危及患者生命健康[4]。MDS的診斷與治療一直是國內外血液病領域的研究熱點,但目前仍缺乏靈敏度高、特異性好的分子標志物或檢測手段來識別惡性克隆。研究[5]證實,MDS發病機制包括:造血干細胞分子遺傳變異,產生異常前體細胞[6];體內細胞免疫等免疫監視失能,異常克隆免疫逃逸/耐受。部分研究[7]發現,T細胞免疫球蛋白黏蛋白-3(T cell immunoglobulin and mucin domain-3,TIM-3)在MDS造血干細胞上過度表達。李雯雯等[8]則指出,MDS患者血清乳酸脫氫酶(Lactate dehydrogenase,LDH)與疾病的進展與預后相關,監測該類指標對于患者的診治具有一定的提示性。雖然TIM-3在血液疾病等方面研究報道較多,但不同研究間存在一定的差異性[9]。本研究對MDS患者外周血TIM-3和LDH表達水平進行檢測,以分析二者在MDS診斷中的應用價值。
1 資料與方法
1.1 一般資料 選取西安市第九醫院老年病科2020年1月至2021年1月收治的98例MDS患者作為MDS組,其中男性52例,女性46例;年齡35~64歲,平均(56.36±7.23)歲;體重48~61 kg,平均(55.36±5.15)kg;依據MDS國際預后積分系統[10],低危41例,中危35例,高危22例。病例納入標準:①符合MDS診斷標準[11],排除其他造血及非造血系統疾病;②無認知、精神障礙;③配合度較高。排除標準:①心、肝、腎等臟器功能障礙;②合并免疫系統疾患;③患有其他惡性腫瘤。選取同期36名健康體檢者作為對照組,其中男性19例,女性17例;年齡36~65歲,平均(57.00±7.47)歲;體重45~61 kg,平均(55.82±5.41)kg。兩組一般資料比較無統計學差異(均P>0.05)。數據均選自本院一批次驗證測試的驗證計劃。
1.2 檢測方法
1.2.1 外周血單核細胞(PBMC)表面TIM-3表達水平檢測:對照組于體檢當日、MDS組于入院第1天采集空腹靜脈血4 ml,EDTA抗凝,每管加入紅細胞裂解液2 ml,避光反應5 min,磷酸緩沖鹽溶液(PBS)洗滌1次,離心棄上清后PBS重懸備用。取制備好的PMBC懸液100 μl,將每例樣本分為空白對照組、陰性對照組和實驗檢測組(空白對照組不加任何試劑,陰性對照組只加各類抗體,實驗檢測組加PBMC懸液和各類抗體),分別吸取熒光標記的抗體(CD4、TIM-1、TIM-3抗體)各5 μl加入流式管混勻,室溫避光孵育15 min,PBS洗滌1次,離心棄上清后加入200 μl PBS重懸液,采用FACS Calibur型流式細胞儀檢測TIM-3表達水平。TIM-3試劑盒(批號:F02731;規格:96 T)購自上海西唐生物科技有限公司。
1.2.2 LDH表達水平檢測:對照組于體檢當日、MDS組于入院第1天采集空腹靜脈血3 ml,EDTA抗凝,于2 h內送至檢驗科,3500 r/min(離心半徑15 cm)離心10 min,分離血清后取0.5 ml分裝于EP管內,于冰箱-80 ℃保存待測。選用日立760全自動生化儀,采用速率法對LDH水平進行測定。LDH正常參考值為218~458 U/L。

2 結 果
2.1 兩組TIM-3和LDH表達水平比較 見表1。與對照組相比,MDS組TIM-3和LDH表達水平更高(均P<0.05)。
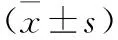
表1 兩組TIM-3和LDH表達水平比較
2.2 不同預后分級MDS患者TIM-3和LDH表達水平比較 見表2。不同預后分級MDS患者TIM-3和LDH表達水平比較差異無統計學意義(均P>0.05)。
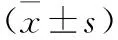
表2 不同預后分級MDS患者TIM-3和LDH表達水平比較
2.3 TIM-3、LDH單項及聯合檢測診斷MDS效能分析 見表3(圖1)。TIM-3單項診斷MDS的敏感性與特異性分別為70.10%、69.40%,LDH則為62.89%、77.80%。TIM-3、LDH聯合檢測診斷MDS的敏感性與特異性分別為88.70%和68.12%,二者聯合檢測診斷價值高于單項指標檢測。

表3 TIM-3、LDH單項及聯合檢測診斷MDS效能分析

圖1 TIM-3、LDH單項及聯合檢測診斷MDS ROC曲線
3 討 論
MDS以無效造血和易轉化為急性髓系白血病為特點[12-14]。TIM-3屬于免疫球蛋白TIM家族,小鼠中TIM家族包括TIM-1至TIM-8,而在人類基因中只鑒定出TIM-1/3/4。TIM-3基因定位于人類染色體5q33.2,其功能與信號轉導有關[15]。隨著研究的深入,國內外學者發現TIM-3還可以表達在自然殺傷細胞(NK)、巨噬細胞、肥大細胞和其他淋巴細胞亞群上,并且對細胞因子和趨化因子的分泌起著重要調節作用,在病毒性感染、自身免疫病、腫瘤免疫逃逸、移植免疫耐受中均發揮重要作用。諸多研究[16-17]指出,TIM-3在腫瘤浸潤性淋巴細胞中高表達,且這種高表達多與腫瘤密切相關。當TIM-3調節固有免疫反應時,并不直接作用于半乳糖凝集素9(Gal9),而是通過與高遷移率族蛋白 B1結合而引起后續免疫應答[18]。此外,TIM-3還可與主要作用于凋亡細胞的磷脂酰絲氨酸配體相結合,在消除體內凋亡細胞和維持內環境穩定方面發揮作用。LDH參與機體糖、脂、蛋白等多種重要物質代謝[19],其廣泛存在于人體心、腎、骨骼肌等中,正常人血清中含量極少[20]。LDH水平在血液系統常見惡性腫瘤如MDS、白血病、多發性骨髓瘤、噬血細胞綜合征、淋巴瘤等中均有不同程度升高[21]。本研究中,與對照組相比,MDS組TIM-3和LDH表達水平明顯更高,提示MDS患者TIM-3和LDH表達水平出現了異常。MDS此類疾患的細胞遺傳學特點為細胞基因突變發生率甚高,由之產生的能量代謝障礙及細胞損傷可能是導致該類患者體內LDH升高的原因。MDS患者通常伴有貧血,腫瘤壞死及炎癥因子的釋放等易使細胞處于缺氧環境下,無氧酵解加重代謝產物蓄積與代謝紊亂,也可能導致LDH加速釋放入血。在絕大多數血液疾病的異常造血干細胞上,TIM-3均高表達,提示TIM-3可能是急性髓系白血病造血干細胞的標志物。
同時,本研究還探究了TIM-3和LDH在MDS疾病中的診斷價值,發現TIM-3、LDH聯合檢測診斷MDS的敏感性與特異性分別為83.67%和91.67%,診斷效能均顯著高于TIM-3、LDH單項檢測。由此我們可以認為,MDS患者體內TIM-3、LDH表達水平均升高,二者聯合檢測有助于提高MDS的臨床診斷效能。馮愛梅等[22]認為,LDH具有維持其腫瘤、白血病細胞生長的作用。考慮到白血病、巨幼細胞性貧血以及MDS患者均會出現LDH水平升高的現象,故僅將LDH作為MDS的診斷參考指標存在一定局限性,易造成漏診或者誤診的情況出現。生理條件下,造血微環境中分泌的細胞因子、趨化因子等,以及其中的細胞成分包括骨髓間充質干細胞、血管內皮細胞、成骨細胞、單核巨噬細胞可通過與造血干、祖細胞之間的交流而維持正常造血,而疾病狀態下微環境中失調的炎癥因子可擾亂造血干細胞正常功能,有利于腫瘤細胞的異常累積[23]。人體內的TIM-3可以調控巨噬細胞的免疫應答,降低M1型巨噬細胞極化,減輕M1型巨噬細胞浸潤,同時TIM-3的特異性配體Gal9對促炎或趨化因子等也均有抑制作用[24],故TIM-3表達水平一定程度上可以反映MDS疾病的嚴重程度。TIM-3與LDH聯合檢測可以彌補LDH等血液常規指標在疾病診斷中的不足之處,進而幫助臨床醫師準確對患者進行診治。本研究中,不同預后分級患者的TIM-3和LDH表達水平比較差異無統計學意義,可能與研究納入樣本量較少有關,具體機制有待進一步研究。
綜上所述,MDS患者外周血TIM-3和LDH表達水平異常升高,二者聯合檢測有助于提高對MDS疾病的診斷準確率,方便醫師后續治療計劃與方案的擬定與實施。

