矢車菊素-3-O-葡萄糖苷對人原代成骨細胞JNK/ FOXO1的影響
陳 琳 胡博森 周 波 陳 擁
1.沈陽醫學院公共衛生學院,遼寧沈陽 110034;2.沈陽醫學院附屬中心醫院骨科,遼寧沈陽 110024
骨質疏松癥是常見的慢性病,伴有骨量及微結構系統性損傷,易引發脆性骨折。21 世紀以來,隨著老齡化加劇,慢性病發病率逐年升高。骨質疏松癥等慢性病已是全球性公共衛生問題[1]。矢車菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)是花色苷最常見的形式[2-3],因其具有抗氧化的作用,可對多種慢性病的防治產生積極效應,如糖尿病[4]、癌癥[5]、神經系統疾病[6]和心血管疾病[7]等。研究顯示[8-10],花色苷可減緩骨質流失。亦有研究發現,C3G 能促進成骨細胞增殖分化,但機制尚未明確[11]。叉頭盒蛋白O1(forkhead box O1,FOXO1)是成骨過程中的氧化調節因子,與成骨細胞活性關系密切[12]。c-Jun 氨基末端激酶(c-Jun Nterminal kinase,JNK)通路與骨質疏松有關,但調節方向不明。有研究顯示,JNK/FOXO1 與氧化應激及成骨細胞增殖和分化有關[12-14]。本研究將探討C3G 對人原代成骨細胞JNK/FOXO1的影響,及對轉錄激活因子-4(activiating transcripition factor-4,ATF4)和骨保護素(osteoprotegerin,OPG)mRNA 表達水平的影響,對以C3G 為主成分的骨質疏松類保健品開發提供參考。
1 材料與方法
1.1 材料與儀器
C3G(大連美侖生物技術有限公司,純度>98%,批號:7084-24-4);MTT 試劑盒(南京建成生物工程研究所,批號:G020-1-1);Trizol 試劑、反轉錄試劑盒、實時熒光定量PCR 試劑盒(日本TaKaRa 公司,批號:9108、RR037A、RR820A)。
細胞培養箱(BB-15,Thermo Fisher Scientific);酶標儀(SpectraMax Plus 384,Moleclar Devices);核酸分析儀(Nano,Thermo Fisher Scientific);實時熒光定量PCR 儀(7500FAST,ABI)。
1.2 實驗方法
1.2.1 人原代成骨細胞的分離與培養
本研究方案經學校倫理學委員會批準,患者均簽署知情同意書。收集2017 年6 月至2018 年6 月沈陽醫學院附屬中心醫院60~90 周歲的骨質疏松且股骨頸或股骨粗隆間骨折行人工股骨頭或全髖置換患者的松質骨組織。將其剪碎至直徑約3 mm,PBS 沖洗后,加入紅細胞裂解液。室溫條件下充分混勻。隨后,棄裂解液,加胰蛋白酶,再加入雙酶消化液。離心取沉淀即為人原代成骨細胞。將細胞沉淀重懸,移至培養瓶中(α-MEM 細胞培養液含有10% FBS),37℃、5%CO2培養箱中培養,每4 天換液1 次,細胞1∶2 傳代。第三代及以后的細胞可用于后續實驗。
1.2.2 MTT 法檢測C3G 對人成骨細胞增殖的影響
設置分組:control 組(含0 μmol/L C3G的α-MEM培養液)、C3G 組(含100 μmol/L C3G的α-MEM 培養液)。細胞以4000 個/孔的密度接種于96 孔板,各組經無血清同步化處理24 h 后加入各處理因素。24 h后使用MTT 法分析成骨細胞增殖的情況,按試劑盒說明操作。使用酶標儀在570 nm 處測定吸光度。
1.2.3 實時熒光定量PCR 法檢測基因表達
1.2.3.1 C3G 對細胞FOXO1、ATF4 和OPG的基因表達的影響 實驗分組同“1.2.2”項下。細胞以1.4×106個/皿接種在10 cm 培養皿中,待細胞貼壁后使用無血清培養基處理24 h,同步化處理后處理各組細胞,繼續培養24 h,收集樣本。使用Trizol 法抽提細胞總RNA,隨后反轉錄合成cDNA。以GAPDH 基因為內參,2-ΔΔCt方法計算基因相對表達量。使用Primer Blast 設計引物,由上海生工生物公司合成,FOXO1、ATF4 和OPG的引物序列見表1。按TaKaRa 試劑盒要求配置反應混合液:TB Green Premix Ex Taq Ⅱ10 μl,ROX Reference Dye Ⅱ0.4 μl;,RNase-Free ddH2O 0.6 μl,引物預混液1 μl,稀釋好的cDNA 8 μl,總體系為20 μl。反應條件為:95℃條件下,預變性2 min,接著40 個循環,95℃、5 s;冷卻到60℃、34 s,延伸到68℃、30 s;然后進行PCR 擴增,收集熒光信號,進行熔解曲線分析。

表1 引物序列
1.2.3.2 JNK 信號通路抑制劑和C3G 對細胞FOXO1基因表達的影響 設置分組:SP600125-control 組(含0 μmol/L C3G 和50 μmol/L SP600125的α-MEM 培養液)、SP600125-C3G 組(含100 μmol/L C3G 和50 μmol/L SP600125的α-MEM 培養液)。將細胞密度調節至1.4×106個/皿后接種在10 cm 培養皿中。細胞貼壁后,無血清培養基同步化處理。在同步化處理結束前4 h使用含有50 μmol/L的SP600125 抑制劑的α-MEM培養基對兩組細胞進行預孵。待孵育結束后按上述實驗分組分別加入相應的干預因素處理細胞,繼續培養24 h。用“1.2.3.1”項下方法進行樣品總RNA 提取和FOXO1 基因表達檢測。
1.3 統計學方法
采用SPSS 22.0 統計學軟件進行數據分析,計量資料用均數±標準差()表示,兩組間比較采用t 檢驗。以P <0.05 為差異有統計學意義。
2 結果
2.1 C3G 對人原代成骨細胞增殖活力的影響
C3G 組人原代成骨細胞增殖率高于control 組,差異有統計學意義(P <0.05)。見圖1。
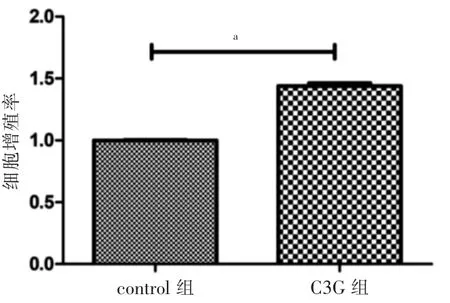
圖1 control 組與C3G 組細胞增殖率比較(n=3)
2.2 C3G 對人原代成骨細胞FOXO1、ATF4 和OPG mRNA 表達水平的影響
C3G 組人原代成骨細胞FOXO1、ATF4、和OPG mRNA 相對表達量低于control 組,差異有統計學意義(P <0.05)。見圖2。
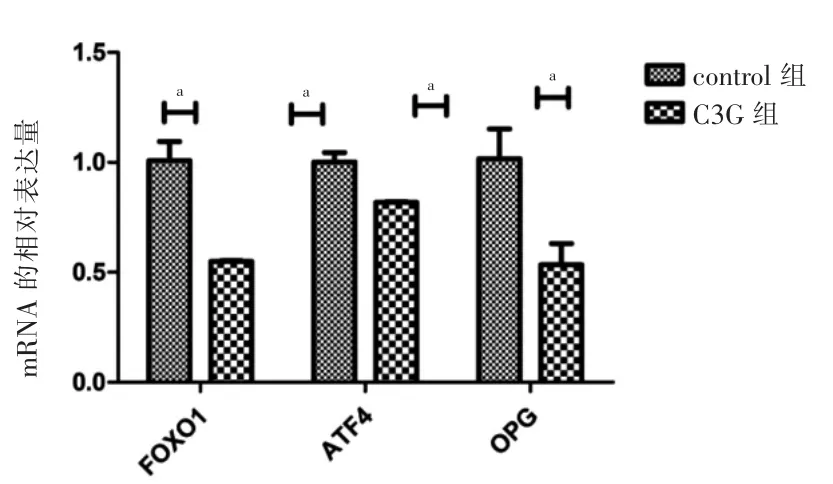
圖2 control 組與C3G 組FOXO1、ATF4 和OPG mRNA 表達水平比較(n=3)
2.3 JNK 信號通路抑制劑處理后C3G 對人原代成骨細胞FOXO1 mRNA 表達水平的影響
SP600125-control 組和SP600125-C3G 組FOXO1的mRNA 相對表達量比較,差異無統計學意義(P >0.05)。見圖3。
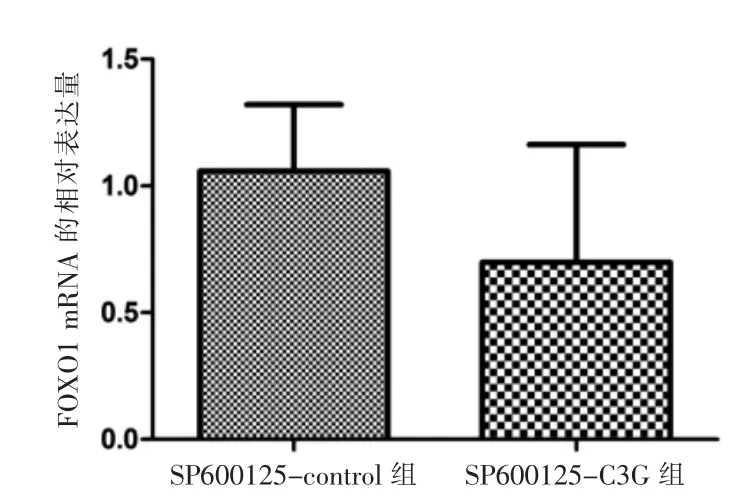
圖3 SP600125 處理后control 組與C3G 組FOXO1 基因表達量比較(n=3)
3 討論
骨質疏松實質是骨重塑和吸收異常[15],而成骨細胞在骨重塑中發揮著重要作用,而氧化應激是其影響因素[16]。C3G 具有抗氧化能力[11,17-19],在骨代謝中可促進成骨細胞的增殖分化,但未闡明機制。
FOXO1 被證明是骨質量的調節因子,與ATF4 和OPG 等基因聯系密切,在成骨細胞中相互影響[21]。ATF4位于FOXO1 通路下游,是關鍵的轉錄因子,其表達受FOXO1的調控,FOXO1 與ATF4 相互作用可調節成骨細胞的蛋白合成和氧化應激[22]。FOXO1 基因缺失,常伴隨OPG 表達水平降低[23]。Guo 等[24]研究發現,C3G能使脂肪細胞FOXO1的含量下降,從而改善機體的炎癥水平。本研究結果顯示,C3G 能下調FOXO1、ATF4和OPG的表達,故認為C3G 在成骨細胞中發揮抗氧化抗炎作用與FOXO1 有關。
研究顯示,成骨細胞發生氧化應激損傷時,JNK/FOX 信號軸能產生抵抗作用[11],FOXO1 向核的移動能促進JNK 活化[25]。Yan 等[26]研究發現,以C3G 為主成分的花色苷能消除氧化應激導致的HepG2 細胞p-JNK 和FOXO1 上調。使用JNK 通路的抑制劑SP600125對細胞進行處理后,兩組FOXO1 表達量比較,差異無統計學意義(P >0.05)。提示當JNK 受到抑制時,C3G的加入不能改變FOXO1的基因表達,C3G 可能通過JNK 通路對人成骨細胞FOXO1 mRNA的表達量產生影響。
綜上所述,本研究使用人原代成骨細胞模型,觀察C3G 對人原代成骨細胞增殖活力的影響以及對FOXO1、ATF4 和OPG 表達的影響,發現C3G 能促進人原代成骨細胞的增殖,C3G 可以下調人原代成骨細胞中的FOXO1、ATF4 和OPG的基因表達。同時發現C3G 能夠通過影響JNK 來進一步影響FOXO1。本研究結果為以C3G 為主成分的骨質疏松類保健品開發提供理依據。由于轉錄因子調控機制的復雜性及體外實驗與實際的體內情況存在差異性,關于C3G影響成骨細胞增殖的具體分子機制仍需要大量實驗驗證。

