長鏈非編碼RNA FAL1 對胃癌細胞增殖和凋亡能力的影響及機制研究
曹獻馗 謝 斌 邵 旸 林 杰
遼寧省腫瘤醫院普外科,遼寧沈陽 110042
胃癌(gastric cancer,GC)是常見的消化道腫瘤[1],患者早期無明顯癥狀[2],導致診斷延遲,轉移率高[3],尋找有效的靶點對治療GC 至關重要[4]。GC 的發生發展與基因調控網絡的失衡密切相關[5],人類基因組中存在大量的非編碼蛋白質的RNA[6]。其中,長鏈非編碼RNA(long non-coding RNAs,lncRNAs)參與轉錄調控和染色質修飾等生理過程,在腫瘤發生中具有重要作用[7],與腫瘤的發展密切相關[8-9]。本研究顯示lncRNA FAL1 在GC 細胞中過表達,參與腫瘤增殖和凋亡。現報道如下:
1 資料與方法
1.1 細胞培養及轉染
人胃腺癌細胞株SGC-7901、BGC-823 及正常胃黏膜細胞GES-1 取自遼寧省腫瘤醫院中心實驗室。所有細胞系均在含10%胎牛血清(Hyclone,通用生命科學,美國)DMEM 培養基(Dulbecco’s Modified Eagle Medium,sigma,美國)中培養,另加100 U/ml 鏈霉素和100 U/ml 青霉素(Thermo Fisher Scientific,美國)。培養條件為37℃,5%CO2。設計并合成了2 種以FAL1為靶點的小干擾RNA(small interfering RNA,siRNA;genechem,中國),分別為si-FAL1#1 組及si-FAL1#2組。構建STAT3 過表達pcDNA3.1 質粒(Invitrogen,美國)。細胞接種于六孔板,密度1.8×105/孔,并置于37℃培養條件24 h。細胞于含10%胎牛血清、不含抗生素的DMEM 中培養基轉染相應載體48 h。收集細胞進行相關實驗。
1.2 RT-PCR
TRIzol 法提取樣本總RNA,檢測純度及濃度。逆轉錄和PCR 反應均嚴格按照TAKARA 公司說明書進行,以U6 作為內參進行相對定量,每組設3 個復孔,ROCHE 實時定量熒光PCR 儀進行檢測。FAL1 的正向引物序列:5’-CCTGGCCAAGAAGCTCATAG-3’,反向引物序列:5’-TGAGGACACCGACTACTGAGAA-3’;STAT3 的正向引物序列:5’-CAGCAGCTTGACACACGGTA-3’,反向引物序列:5’-AAACACCAAAGTGGCATGTGA-3’;U6 的正向引物序列:5’-TTATGGGTCAGGCAGAAGCAGAGGTAGCTAGCCTGAC-3’,反向引物序列:5’-CACTATTGCGGGCTGC-3’。采用2-△△Ct法計算兩者的相對表達量。△Ct=Ctmarker-CtU6。PCR 條件:95℃,5 min;95℃,30 s;8℃,30 s;72℃,45 s;32 個循環,72℃,10 min。
1.3 Western blot
提取總蛋白,經10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE;Beyotime,中國)。隨后,轉移到硝基纖維素膜(Millipore,美國)。室溫下用5%脫脂牛奶封閉膜1 h,然后與STAT3(1∶1000,Proteintech,美國)和β-actin(1∶5000,Proteintech,美國)孵育過夜。膜洗滌3 次,二抗(1∶5000,Proteintech,USA)室溫孵育1 h,顯影成像,ImageJ 分條帶灰度值。
1.4 CCK-8
依據CCK-8 系統(Dojindo,日本)測定細胞活力。細胞接種在96 孔板中(每孔1×104個細胞)。細胞于37℃黑暗孵育,于培養0、24、48、72 h 每孔加入10 μl CCK-8 溶液,再孵育4 h。然后使用酶標儀(Tecan,瑞士)在450 nm 處評估每個孔的吸光度。
1.5 Annexin V-FITC PI 雙染色檢測細胞凋亡
細胞處理后,用4℃PBS 對細胞進行胰蛋白酶化和洗滌。根據操作手冊,使用Annexin V/PI 檢測試劑盒(Molecular Probes Inc.Eugene,OR)在黑暗中孵育細胞懸液15 min。流式細胞術檢測細胞凋亡(Beckman Coulter,USA),實驗重復3 次。
1.6 統計學方法
采用SPSS 22.0 軟件對所得數據進行統計分析。計量資料以均數±標準差()表示,采用t 檢驗或方差分析。計數資料以例數表示。以P <0.05 為差異有統計學意義。
2 結果
2.1 FAL1、STAT3 在GC 細胞及胃黏膜上皮細胞中表達情況
RT-PCR 顯示,FAL1 在人胃腺癌細胞株SGC-7901和BGC-823 中RNA 的表達高于胃黏膜細胞GES-1中表達,差異有統計學意義(P <0.05),見圖1A。RTPCR 和Western blot 顯 示,STAT3 在SGC-7901 和BGC-823 中mRNA 表示高于GES-1,差異有統計學意義(P <0.05),見圖1B~C。
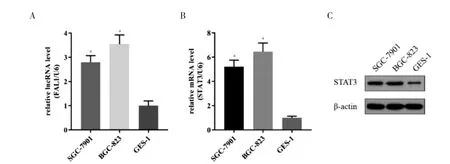
圖1 FAL1、STAT3 在GC 細胞及胃黏膜上皮細胞中表達情況
2.2 下調FAL1 對STAT3 表達的影響
RT-PCR 顯示,轉染后GC 細胞中FAL1 表達量降低(P <0.05),見圖2A。胃癌細胞中STAT3 的表達同樣下降(P <0.05),見圖2B。其中第2 條序列(si-FAL1#2)具有更好的沉默效果,用于后續表型實驗。
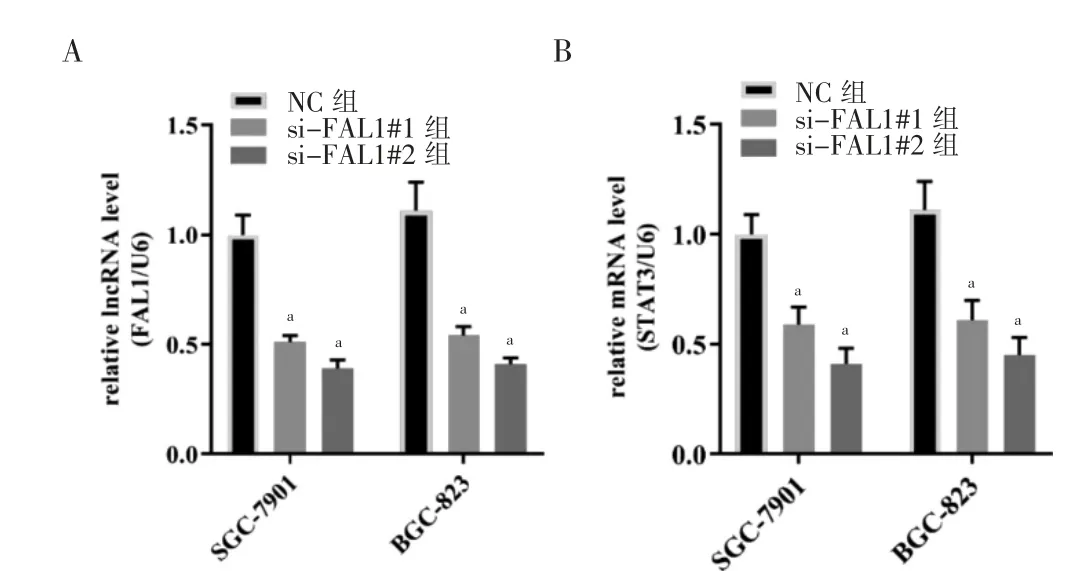
圖2 下調FAL1 對STAT3 表達的影響
2.3 FAL1、STAT3 對GC 細胞增殖能力的影響
將si-FAL1#2 序列轉染SGC-7901 和BGC-823細胞后,細胞增殖減緩。在此基礎上過表達STAT3,被抑制的細胞的增殖能力部分恢復(P <0.05)。見圖3。
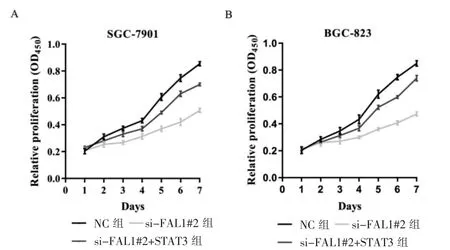
圖3 FAL1 和STAT3 對GC 細胞增殖能力的影響
2.4 FAL1、STAT3 對GC 細胞凋亡能力的影響
將si-FAL1#2 轉 染SGC-7901 和BGC-823 細胞,細胞早期凋亡明顯增加,過表達STAT3 后,凋亡細胞降低(P <0.05)。見圖4。
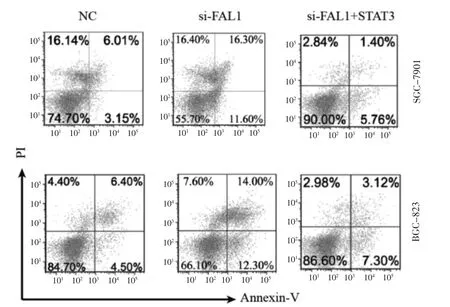
圖4 FAL1 和STAT3 對GC 細胞凋亡能力的影響
3 討論
闡明胃癌進展的遺傳和表觀遺傳學機制是研究重點,但其機制仍未明確[10-11]。LncRNAs 作為轉錄組的重要組成部分,根據其位置及轉錄方式可分為:反義,內含子,重疊,長鏈基因間lncRNA,頭對頭及eRNA等多種類型[12]。lncRNA 在不同腫瘤中異常表達[13-14],通過表觀遺傳修飾、轉錄調控及轉錄后修飾,調控腫瘤相關基因表達,參與腫瘤發生發展[15-16]。報道顯示lncRNA 作為抗乳腺癌治療腫瘤的靶點,具有一定的臨床價值[17]。血液中游離的lncRNA 是肺癌診斷的分子標志物[18]。lncRNAs 在GC 中也存在異常表達:Zhang等[19]對GC 患者組織及正常組織中LncRNA 進行了篩選,發現TINCR、CCAT2、AOC4P、BANCR、LINC00857等在GC 中表達上調。Wang 等[20]發現LncRNA UCA1通過促進Cbl-c 介導的GRK2 泛素化調節GRK2 蛋白的穩定性,提高GC 細胞的轉移能力。
FAL1 是一條新發現的lncRNA,在腫瘤中發揮重要的功能:FAL1 在骨肉瘤組織和細胞中高表達,同腫瘤的轉移、分期和生存率密切相關,下調FAL1 可以抑制骨肉瘤的增殖、侵襲、遷移和上皮-間質轉化,從而抑制骨肉瘤的進展[21]。FAL1 可與PRC1 的BMI1 亞基結合,抑制靶基因p21 的啟動子,導致細胞周期失衡,加速卵巢癌進展[22]。FAL1 作為“海綿”,與miR-1236 結合促進細胞增殖和轉移[23]。然而,FAL1 在胃癌中的作用尚不清楚。
STAT3 參與AK/STAT 通路的激活,該通路廣泛參與細胞增殖、遷移和侵襲[24]。Wu 等[25]研究發現腫瘤相關成纖維細胞分泌IL-6,激活GC 細胞的JAK2/STAT3 信號通路,促進GC 細胞的遷移和上皮間質轉化。本研究發現,在抑制FAL1 的表達后,STAT3 的mRNA 和蛋白表達均下降。而且在下調FAL1 的表達后,細胞增殖能力下降,凋亡增加;在此基礎上過表達STAT3,被削弱的惡性表型恢復,這提示FAL1 在GC中的促癌作用是通過STAT3 實現的。
綜述所述,lncRNA FAL1 和STAT3 協同作用,促進GC 的惡性增殖,并抑制細胞凋亡,后續將在在體模型中對此進行驗證,并探討STAT3 在GC 中的下游調控機制。

