《2020 ERS聲明:慢性血栓栓塞性肺動脈高壓》解讀*
尹琪楠,韓麗珠,邊原,黃雪飛,雷洋,宋玉潔,童榮生
(四川省醫學科學院·四川省人民醫院/電子科技大學附屬醫院藥學部·個體化藥物治療四川省重點實驗室,成都 610072)
慢性血栓栓塞性肺動脈高壓(chronic thromboembolic pulmonary hypertension,CTEPH)是一種罕見的急性肺栓塞并發癥,無論有無癥狀,近端肺動脈發生血栓以及<500 μm的次微血管病變,導致肺血管阻力增加并進展為右心力衰竭。在肺動脈高壓患者中,當肺通氣灌注掃描顯示不匹配的灌注缺損并通過右心導管和血管成像證實時,即懷疑為CTEPH。目前除了終身抗凝,治療方式還包括手術,血管成形術和根據病灶的位置和特點進行治療。2020年12月,歐洲呼吸學會(European Respiratory Society,ERS)發布《ERS聲明:慢性血栓栓塞性肺動脈高壓》[1],該聲明內容涵蓋CTEPH的定義、診斷、流行病學、隨訪、病理生理學、肺動脈內膜切除治療、球囊肺血管成形術、藥物以及聯合治療、康復管理等,筆者對該聲明進行解讀。
1 CTEPH的定義
2015年,歐洲心臟病學會(European Society of Cardiology,ESC)/ERS肺高血壓診斷和治療指南[2]中,說明CTEPH的診斷是基于至少3個月有效抗凝治療后,表現為平均肺動脈壓(mean pulmonary arterial pressure,mPAP)≥25 mmHg(1 mmHg=0.133 kPa)與肺動脈楔壓(pulmonary artery wedge pressure,PAWP)≤15 mmHg,經肺動脈CT血管造影(computed tomography pulmonary angiography,CTPA)、磁共振成像(MRI)可見CTEPH的特定診斷跡象,如環形狹窄、網/縫和慢性全閉塞(袋狀病變或錐形病變)。
根據靜息時是否存在肺動脈高壓,目前有兩個術語用于描述有癥狀的慢性血栓栓塞性肺動脈閉塞患者:CTEPH和慢性血栓栓塞性疾病(chronic thromboembolic disease,CTED)。降低的mPAP、肺血管阻力(pulmonary vascular resistance,PVR)閾值可能影響CTED患者被認定為CTEPH患者[3-7]。對于慢性血栓栓塞性肺疾病(chronic thromboembolic pulmonary disease,CTEPD)患者,肺動脈高壓(pulmonary hypertension,PH)的存在不僅是有血栓阻塞近端血管的結果,還可能與繼發性微血管病變以及潛在的肺部疾病或左心疾病有關。心肺功能運動試驗(cardiopulmonary exercise test,CPET)和運動狀態下右心導管檢查(exercise right heart catheterisation,ex-RHC)有助于定義CTEPD。CPET的應用包括每分鐘通氣量/每分鐘二氧化碳產生量(VE/VCO2)斜率和呼氣末二氧化碳分壓(PETCO2),CPET不僅用于預后,還用于疑似肺血管疾病患者呼吸困難的鑒別診斷。在許多CTEPH患者中,mPAP通過手術或多種藥物治療得以恢復,患者雖感覺無明顯異常,但所有肺血管難以恢復至發病前的狀態。此外,預期壽命可能在一定程度上受到終身抗凝相關的潛在治療風險影響。
2 CTEPH的診斷
對于PH患者,V/Q掃描顯示不匹配的灌注缺損,懷疑CTEPH時,診斷流程見圖1。V/Q掃描仍然是排除CTEPD的最有效篩選工具。VQ單光子發射計算機斷層掃描(single photon emission computed tomography,SPECT)已被證明優于平面成像,是首選方法。
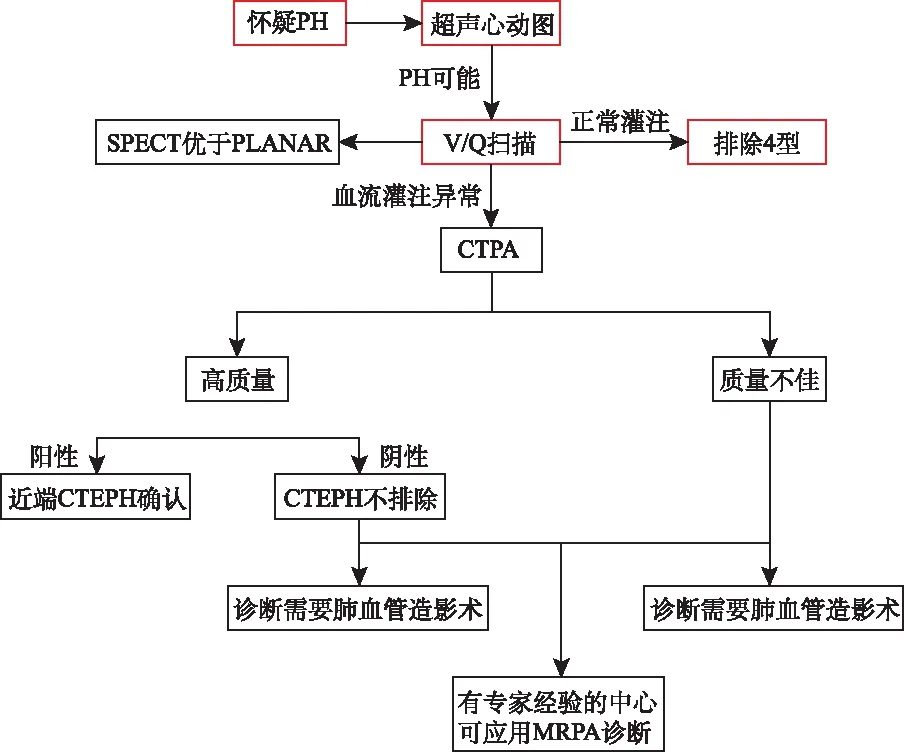
圖1 CTEPH診斷流程
3 CTEPH的流行病學
CTEPH是一種罕見且不易診斷的肺栓塞并發癥,首次出現時可能被誤診為急性肺栓塞。根據不同國家CTEPH的流行病學分析估計,日本患病率為19‰,美國和歐洲患病率30‰~50‰[8]。目前文獻尚不能證明靜脈血栓栓塞(venous thromboembolism,VTE)患者使用維生素K拮抗劑(vitamin K antagonist,VKAs)和非維生素K拮抗劑口服抗凝劑(non-vitamin K antagonist oral anticoagulant,NOACs)治療時CTEPH發病率的差異。但在某些特定情況下,如《ESC急性肺栓塞診斷和治療指南》(2019版)推薦使用NOACs而不是VKA,因為NOACs使用方便,耐受性更好[9-10]。在其他特殊臨床情況下,如肥胖患者體質量指數>40 kg·(m2)-1或體質量>120 kg,伴隨質子泵抑制劑或可減少達比加群胃腸道吸收的H2拮抗劑等,藥動學必須仔細考慮優化這些藥物的風險/效益,以預防血栓栓塞事件和CTEPD復發[11-12]。臨床上永久性血管內裝置(起搏器、輸液室、VA分流器)、炎癥性腸病和原發性血小板血癥已被確定為CTEPH的危險因素[13-14]。
4 CTEPH的病理生理學
解剖學角度,大彈性肺動脈近端栓塞和<500 μm肺血管繼發性微血管病變參與CTEPH患者PVR的增加。在近端,這些病變似乎是組織學上與血管成像上所知的縫隙、網、狹窄或囊袋相對應的病變。此外,大而有彈性的肺動脈長期受到肺動脈壓升高的影響,導致動脈瘤樣病變,血管壁厚度增加。不同的是,典型的阻塞性慢性血栓栓塞性病變表現為血管閉塞,偶爾還會出現多發性繼發性腔,稱為碎屑狀病變。微血管病變的特點是在毛細血管前動脈、毛細血管(嚴重者為肺血管瘤樣病變)和肺小靜脈(肺小靜脈閉塞樣病變)的水平上重塑。
5 手術治療CTEPH
肺動脈內膜切除術(pulmonary endarterrectomy,PEA)是可手術患者的首選治療方法,可使血流動力學和臨床改善,降低早期死亡率。PEA是否成功沒有明確標準,PEA術后殘余肺動脈高壓(pulmonary hypertension,PH)亦無標準,復發的PH更為罕見,在英國的系列研究中,356例患者中只有6例在PEA后出現新的肺栓塞[17]。PEA術后早期對嚴重殘余PH的處理具有挑戰性,是最常見的院內死亡原因。體外膜肺氧合(extra corporeal membrane oxygenation,ECMO)可成功幫助挽救嚴重殘余PH和血流動力學衰竭的患者,并允許橋接肺移植,但經驗有限[18]。藥物治療在早期階段尚未證明有益。PEA后患者長期預后也受到殘余PH的影響,數據顯示,重新評估時mPAP≥38 mmHg和PVR≥425 dynes·s-1·cm-5可預測與CTEPH相關的死亡[15]。開始藥物治療的建議閾值為mPAP>30 mmHg[16]。對于術后PVR>300 dynes·s-1·cm-5的患者,有證據表明在CHEST-1研究中使用利奧西呱可降低PVR并改善6 min步行距離(6MWD)[19]。2018WSPH治療算法建議對PEA后持續癥狀性PH的患者使用藥物治療并考慮使用肺血管球囊擴張成形術(balloon pulmonary angioplasty,BPA)或重做PEA[20]。
BPA不能替代PEA或CTEPH的藥物靶向治療,BPA填補CTEPH患者不符合PEA條件的干預空白,可以考慮將BPA與任何一種療法結合作為一種補充治療方式[21-23]。BPA通過改善肺循環的血流,改善肺功能、右心室功能、肺血流動力學、6MWD、功能分級和生活質量。目前普遍認為BPA相關的肺損傷是由鋼絲操作或球囊過度擴張期間的機械性血管損傷引起的[24]。結果表明,不同人群BPA后并發癥發生率與BPA時PH的嚴重程度密切相關。BPA的治療仍有致死風險。在較短的時間,BPA已經從一種實驗性治療方式發展成為不能手術的CTEPH的既定治療方案。
6 CTEPH的治療
6.1藥物治療 除了終身抗凝外,CTEPH的基礎治療還包括右心力衰竭時給予的利尿劑和低氧血癥患者氧氣。傳統上,VKAs是PAH和CTEPH抗凝治療的主要藥物,但NOACs的應用越來越多。關于NOACs在CTEPH中的有效性和安全性,目前還沒有強有力的數據。此外,在CTEPH中NOACs和肺血管擴張劑之間的藥物相互作用還需要了解。在BPA治療的情況下,大多數專家似乎都在進行不間斷的持續VKA治療。VKAs(INR靶點2.5)也在血栓性抗磷脂綜合征(狼瘡抗凝劑、抗心磷脂抗體和同一同種型抗-β2-糖蛋白I抗體呈三重陽性)的高危患者中具有比NOACs更多的益處和更少的風險[25]。
鳥苷酸環化酶刺激劑利奧西呱顯著增加6MWD,并降低PVR[19]。利奧西呱被批準用于不能手術的CTEPH或PEA后持續性/復發性PH的患者。此外,在不能手術的CTEPH患者中使用內皮素抑制劑聯合磷酸二酯酶-5抑制劑或利奧西呱進行初始口服聯合治療[26]與單藥治療相比,首次口服聯合治療導致PVR更明顯的降低。西地那非是一種磷酸二酯酶5型抑制劑,未被批準用于CTEPH。雙重內皮素受體拮抗劑(endothelin receptor antagonist,ERA)波生坦不被批準用于CTEPH。對于不能手術的CTEPH或PEA后持續性/復發性PH患者,曲前列尼爾的上市許可是有效的,6MWD、PVR、功能分級和NT-proBNP均有改善。
大多數CTEPH患者在BPA和(或)PEA治療后臨床和血流動力學都有明顯改善。即使PEA和(或)BPA在休息時肺血流動力學正常,終身抗凝也是強制性的,而通常不再需要利尿劑和氧氣。同樣,在成功的BPA和(或)PEA后,可以考慮停止或減少PH藥物。
6.2綜合治療 目前的治療模式已經演變為包括多模式綜合應用。這種方法包括采用PEA、BPA和藥物治療的組合,分別針對近端病變、遠端病變和微血管病變。肺移植很少被考慮其中。在可手術的CTEPH患者中,對術前PVR較高患者采用PH靶向治療可改善術前肺血流動力學,并有可能降低PEA的發病率和死亡率。目前還不能根據結果確定可手術性CTEPH患者術前PH靶向治療是否能提高生存率。根據PH的嚴重程度,具有混合性解剖病變的低風險患者可在術后隨訪期間進行PEA,必要時進行BPA,高危患者(術前PVR高)可能受益于聯合治療,采用BPA(術前或術中同時)和PEA降低手術風險,提高最終療效。然而,到目前為止,關于該策略對術后結果影響的數據非常有限,需要進一步的研究來證實其臨床相關性。
7 康復
盡管康復的有益效果尚未完全了解,但在肺動脈高壓和CTEPH的動物模型中,骨骼肌毛細血管的增加以及康復后右心室功能的改善都能測量。盡管與PAH相比,CTEPH的運動生理學略有不同,但有理由相信,兩種情況下康復的積極作用是相似的。大多數關于CTEPH和PAH康復的關鍵試驗都是基于三級轉診機構的住院培訓。PH的運動訓練應該由PH專家和在嚴重受損患者的康復方面有經驗的物理醫師單獨調整和密切監督。患者在執行有監督的康復計劃之前,應接受優化的目標治療,并處于穩定的臨床狀態[1]。康復的另一個潛在作用是在PEA和BPA后的恢復階段。
本文雖對PH的藥物進行介紹,但是未對其每一類藥物進行具體的用法用量說明以及其可能的不良反應,也沒有進行推薦級別的分級。《中國肺動脈高壓診斷與治療指南(2021版)》[27]及《2020 加拿大心血管學會/加拿大胸科學會立場聲明:肺動脈高壓》[28]進行治療PH藥物的總結以及比較,見表1。
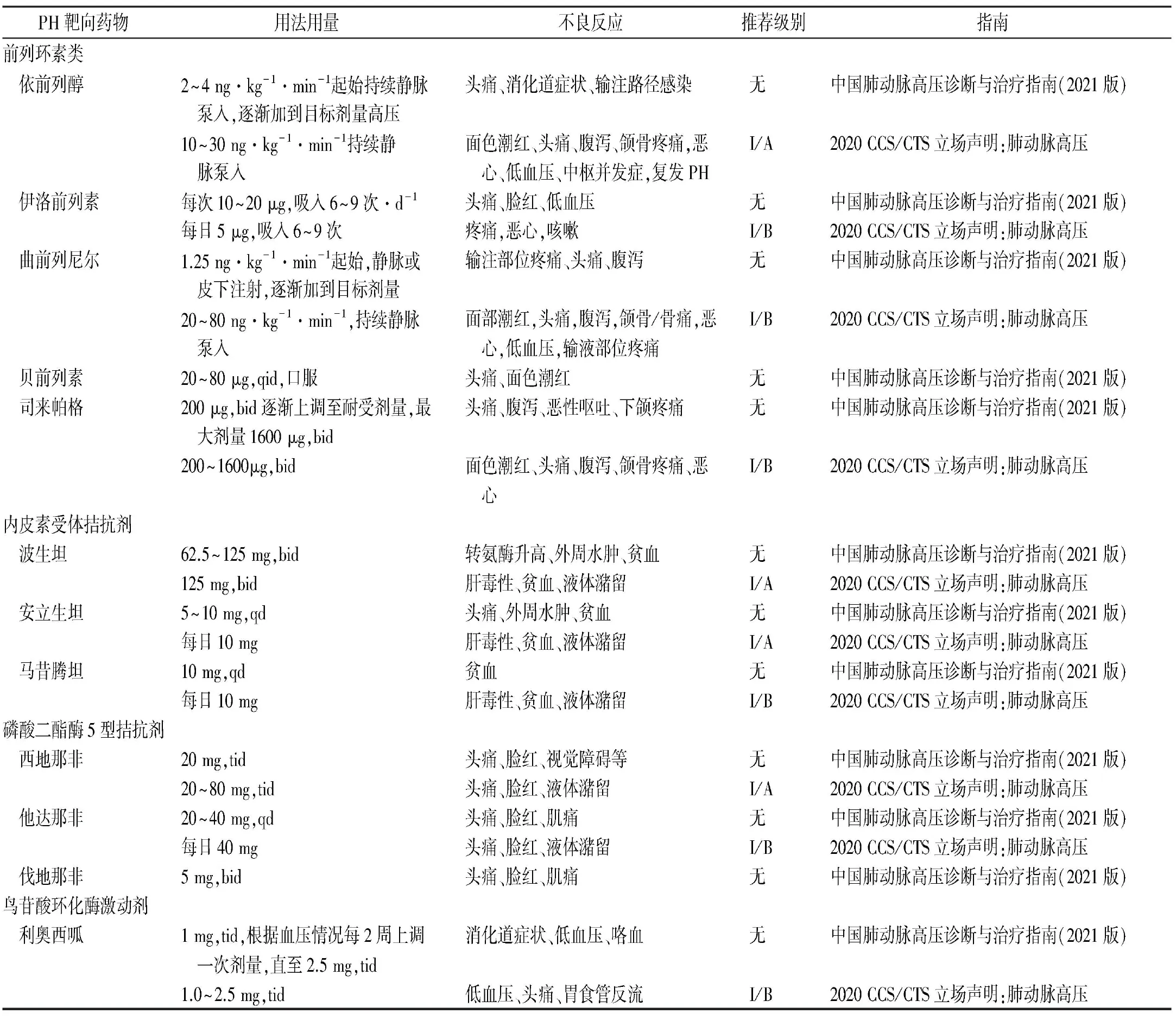
表1 PH靶向藥物在不同指南間的比較
總之,本聲明概述了有關診斷的文獻和當前實踐的回顧,以及CTEPH的管理。聲明總結目前的知識,并且對于未來進一步的研究給出了建議,為CTEPH的規范化管理提供了參考。

