S/R構(gòu)型煙堿與胃膜素的作用機(jī)制
楊 繼,朱瑞芝,向能軍,司曉喜,何 沛,劉春波,唐石云,張鳳梅,王 強(qiáng),劉志華,蔡炳彪*
1.云南中煙工業(yè)有限責(zé)任公司技術(shù)中心,昆明市北市區(qū)紅錦路367號(hào) 650231
2.紅塔煙草(集團(tuán))有限責(zé)任公司工藝質(zhì)量部,云南省玉溪市紅塔區(qū)紅塔大道118號(hào) 653100
胃膜素(Gastrin I Human,GIh)又稱(chēng)胃黏膜素,是從豬胃黏膜中提取的一種以黏蛋白為主要成分的生化藥物[1]。胃膜素有重要的生理和藥理功能[2-5]。煙堿約占煙草中總生物堿的90%,是煙草制品的主要化學(xué)成分。煙堿具有兩種不同的旋光異構(gòu)體,即S-(-)-煙堿和R-(+)-煙堿[6-7]。煙草中的煙堿主要為S-(-)-煙堿,R-(+)-煙堿僅占煙草原料中煙堿總量的1%(質(zhì)量分?jǐn)?shù),下同)左右,但隨著燃燒過(guò)程中的熱解和外消旋作用,R-(+)-煙堿的量可達(dá)到2%~3%。許多動(dòng)物實(shí)驗(yàn)和體外模型實(shí)驗(yàn)表明,兩者在生物體內(nèi)的代謝過(guò)程有所不同,S-(-)-煙堿比R-(+)-煙堿具有更強(qiáng)的生理活性和毒性[7]。因此,兩種構(gòu)型煙堿的分離及作用機(jī)理在藥學(xué)和吸煙與健康研究方面具有重要意義[8]。口含煙作為新型的煙草制品,已成為煙草消費(fèi)的重要補(bǔ)充形式,日益受到關(guān)注。不同于傳統(tǒng)卷煙,口含煙沒(méi)有經(jīng)過(guò)燃燒過(guò)程,而是經(jīng)口腔咀嚼或口含來(lái)吸食,通過(guò)味覺(jué)消費(fèi)。其煙堿攝入由傳統(tǒng)卷煙煙絲燃燒-上呼吸道攝入模式轉(zhuǎn)向口腔-胃腸消化道攝入模式。一部分煙堿透過(guò)口腔黏膜被吸收后進(jìn)入血液使人產(chǎn)生生理滿(mǎn)足感;另一部分轉(zhuǎn)入胃腸道吸收,并與胃腸道內(nèi)生物大分子發(fā)生相互作用。攝入模式的改變導(dǎo)致煙堿在體內(nèi)外的溶出和吸收規(guī)律發(fā)生變化,因此必須重新認(rèn)識(shí)煙堿在口腔及胃腸道中的釋放、吸收、滲透、擴(kuò)散行為及影響因素。同時(shí),研究S-(-)-煙堿和R-(+)-煙堿與消化道胃腸部位關(guān)鍵生物大分子相互結(jié)合方式及影響因素,以了解不同構(gòu)型煙堿的生物活性,對(duì)深入了解煙堿的作用機(jī)理具有重要意義。因此,本研究中從實(shí)驗(yàn)角度對(duì)S/R型煙堿與GIh 的結(jié)合行為進(jìn)行對(duì)比考察,總結(jié)出配體分子的構(gòu)型對(duì)結(jié)合過(guò)程的影響,旨在探究不同構(gòu)型煙堿在人體內(nèi)與生物蛋白的相互作用,為新型煙草的產(chǎn)品開(kāi)發(fā)、質(zhì)量控制及安全性評(píng)價(jià)提供理論依據(jù)。
1 材料與方法
1.1 材料、試劑和儀器
胃膜素(96%~99%,美國(guó)Sigma-Aldrich 生物技術(shù)公司):S型煙堿(陜西港華生物科技有限公司);R型煙堿(>99%,加拿大TRC 化學(xué)品公司);PBS 緩干粉(AR,杭州昊鑫生物科技股份有限公司);超純水[自制,電阻率18.2 MΩ·cm(25 ℃)]。
Cary Eclipse 分子熒光光譜儀(美國(guó)Varian 公司);FluoroLog-3 時(shí)間分辨熒光光譜儀(法國(guó)Horiba 公司);Aviv Model 400 圓二色譜儀(美國(guó)Aviv 公司);BS224S 型電子天平(北京賽多利斯儀器系統(tǒng)有限公司);YASARA v16.7.22 軟件(美國(guó)Scripps 研究所Olson 實(shí)驗(yàn)室);Milli-Q 超純水制備儀(法國(guó)默克化工技術(shù)公司)。
1.2 方法
1.2.1 溶液制備
(1)PBS 緩沖液:將一包PBS 緩干粉固體全部倒入燒杯中,用超純水溶解并定容至2 L 容量瓶中,得pH=7.4、濃度為0.01 mol/L 的PBS 緩沖液。
(2)GIh 儲(chǔ)備液:準(zhǔn)確稱(chēng)取5 mg GIh,用pH=7.4的PBS 緩沖液定容至100 mL,即得2.0×10-5mol/L的GIh 儲(chǔ)備液。
(3)S/R型煙堿(S/R-Nic)儲(chǔ)備液:準(zhǔn)確吸取16 μL 煙堿,用PBS 緩沖液溶解并定容于10 mL 容量瓶中,得0.01 mol/L 的煙堿儲(chǔ)備液。用錫紙包裹容量瓶避光放置。
1.2.2 分子熒光光譜法
取6 只2 mL 的離心管,分別加入250 μL 2.0×10-5mol/L 的GIh 儲(chǔ)備液,然后再分別加入0、20、80、160、320 和480 μL 的煙堿儲(chǔ)備液,最后依次加入pH=7.4 的PBS 緩沖液750、730、670、590、430和270 μL。忽略溶液混合帶來(lái)的體積誤差,配制成1 mL 的混合溶液,使得GIh 最終濃度為5.0×10-6mol/L,煙堿最終濃度分別為0、0.2×10-3、0.8×10-3、1.6×10-3、3.2×10-3和4.8×10-3mol/L,置于旋渦混合器上使其混合均勻,避光置于恒溫水浴鍋中,30 min 后進(jìn)行熒光發(fā)射光譜測(cè)定。設(shè)定測(cè)試樣品溫度為298 和310 K,激發(fā)波長(zhǎng)為280 nm,激發(fā)與發(fā)射的夾縫寬度分別為20 和10 nm,測(cè)定范圍為300~500 nm,記錄熒光發(fā)射光譜的峰值強(qiáng)度。
1.2.3 時(shí)間分辨熒光光譜法
配制兩份試樣溶液:按比例混合GIh 儲(chǔ)備液和煙堿儲(chǔ)備液,并以PBS 緩沖液定容,使得GIh 最終濃度為5.0×10-6mol/L,煙堿濃度分別為0 和8.0×10-4mol/L,置于旋渦混合器上使其混合均勻,靜置30 min 后進(jìn)行熒光測(cè)定。激發(fā)波長(zhǎng)和發(fā)射波長(zhǎng)分別設(shè)定為280 和338 nm,測(cè)定溫度為298 K。
1.2.4 同步熒光光譜法
測(cè)定發(fā)射波長(zhǎng)與激發(fā)波長(zhǎng)差值分別為15 和60 nm(Δλ=15、60 nm)條件下的熒光強(qiáng)度。在Δλ=15 nm 的同步熒光實(shí)驗(yàn)中,掃描范圍為200~600 nm,激發(fā)夾縫寬度為5 nm,發(fā)射狹縫寬度為20 nm,GIh 和S型/R型煙堿的混合溶液濃度為分子熒光光譜法實(shí)驗(yàn)中溶液的1/10。在Δλ=60 nm 的同步熒光實(shí)驗(yàn)中,設(shè)定掃描范圍為200~400 nm,激發(fā)夾縫寬度為20 nm,發(fā)射狹縫寬度為10 nm,GIh和S型/R型煙堿的混合溶液樣品配制方法與熒光發(fā)射光譜一致。
1.2.5 三維熒光光譜法
按1.2.3 節(jié)的方法配制兩份試樣溶液,靜置30 min 后進(jìn)行三維熒光光譜測(cè)定。設(shè)定激發(fā)波長(zhǎng)范圍為200~500 nm(間隔為10 nm),發(fā)射波長(zhǎng)范圍為200~500 nm,激發(fā)與發(fā)射的夾縫寬度分別為20和10 nm,溫度為室溫。
1.2.6 圓二色光譜法
按1.2.3 節(jié)的方法配制兩份試樣溶液,靜置30 min 后進(jìn)行圓二色光譜測(cè)定。設(shè)置步長(zhǎng)為1 nm,掃描范圍為190~280 nm,每個(gè)樣品重復(fù)掃描3 次,取平均值。
2 結(jié)果與討論
2.1 熒光淬滅及淬滅機(jī)理的研究
熒光是物質(zhì)吸收光照或其他電磁輻射后發(fā)出的光。光照射某些原子時(shí),光的能量使原子核周?chē)囊恍╇娮訌幕鶓B(tài)躍遷到激發(fā)態(tài)。激發(fā)態(tài)具有較高能量而不穩(wěn)定,可通過(guò)多種途徑釋放能量再回到基態(tài),其中,以光量子發(fā)射形式的能量釋放,可產(chǎn)生熒光。用熒光光譜技術(shù)分析的樣品,首先要有含吸光結(jié)構(gòu)的熒光物質(zhì)[9]。蛋白質(zhì)分子中的內(nèi)源性熒光主要來(lái)自Trp(色氨酸,348 nm)、Tyr(酪氨酸,303 nm)和Phe(苯丙氨酸,282 nm)3 種氨基酸殘基。Trp、Tyr 和Phe 之間的熒光強(qiáng)度比為FTrp∶FTyr∶FPhe=100∶9∶0.5,且Phe 氨基酸殘基在水溶液中多以離子形式存在,其熒光量子產(chǎn)率較低,對(duì)蛋白質(zhì)水溶液的熒光貢獻(xiàn)難以觀測(cè)得到,且同一蛋白分子中的Phe 和Tyr 吸收的能量通常會(huì)傳遞給Trp,因此,蛋白質(zhì)分子水溶液多表現(xiàn)為T(mén)rp 的熒光特性[9-10]。通常認(rèn)為,當(dāng)有機(jī)小分子與蛋白受體結(jié)合后,會(huì)影響該蛋白發(fā)色團(tuán)周?chē)奈h(huán)境,在光譜上直觀地表現(xiàn)出蛋白的內(nèi)源性熒光發(fā)生淬滅,通過(guò)利用蛋白熒光強(qiáng)度與有機(jī)小分子濃度之間的關(guān)系進(jìn)行相關(guān)定性和定量研究,從而得到激發(fā)光譜、發(fā)射光譜以及熒光強(qiáng)度等物理參數(shù),和結(jié)合機(jī)理、結(jié)合模式、結(jié)合常數(shù)、結(jié)合位點(diǎn)數(shù)以及分子間的距離等分子間相互作用信息[11-12]。因此熒光光譜法成為研究小分子藥物與蛋白之間相互作用的重要手段之一。
在本實(shí)驗(yàn)中,首先考察激發(fā)波長(zhǎng)的選擇。常選擇280 和295 nm 作為蛋白質(zhì)溶液的激發(fā)波長(zhǎng)(λex)。當(dāng)λex為280 nm 時(shí),Trp、Tyr 和Phe 均被激發(fā),主要考慮蛋白質(zhì)分子整體受外加物質(zhì)或試劑的影響;當(dāng)λex為295 nm 時(shí),得到的熒光譜圖顯示為T(mén)rp 熒光特征。因此本研究中考察兩種激發(fā)波長(zhǎng)。S型和R型煙堿分別與GIh 結(jié)合的熒光強(qiáng)度淬滅的歸一化情況見(jiàn)圖1。可以看出,隨S型/R型煙堿的不斷加入,GIh 的熒光強(qiáng)度逐漸降低,即發(fā)生了熒光淬滅現(xiàn)象,表明S型和R型煙堿分子均與GIh 之間存在相互作用。對(duì)比280 和295 nm 兩種激發(fā)下的熒光淬滅效果發(fā)現(xiàn),無(wú)論是S型還是R型煙堿,均在280 nm 的激發(fā)波長(zhǎng)下有比較大的熒光淬滅,因此選擇此激發(fā)波長(zhǎng)更有利。同時(shí),對(duì)于S型煙堿來(lái)說(shuō),280 nm 激發(fā)波長(zhǎng)下熒光淬滅比295 nm 強(qiáng)很多;而對(duì)于R型煙堿來(lái)說(shuō),280 nm 激發(fā)波長(zhǎng)下熒光淬滅比295 nm 激發(fā)下僅有微弱優(yōu)勢(shì)。因此也可以判斷出,S型煙堿與GIh 的結(jié)合對(duì)蛋白內(nèi)部的3 種含有熒光發(fā)色團(tuán)的氨基酸均有影響,而R型煙堿主要對(duì)色氨酸殘基有影響。
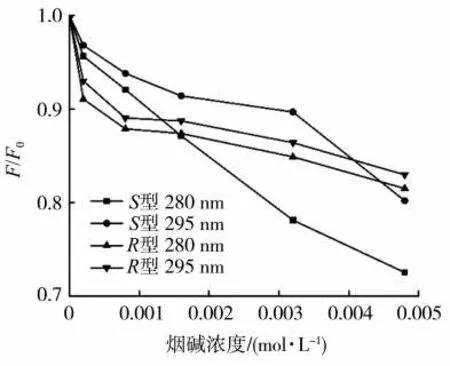
圖1 280 和295 nm 激發(fā)波長(zhǎng)下S 型/R 型煙堿對(duì)GIh 在338 nm 處熒光強(qiáng)度淬滅的歸一化圖Fig.1 Normalized diagram of fluorescence intensity quenching of GIh at 338 nm induced by S/R-nicotine at excitation wavelengths of 280 and 295 nm
不同濃度的煙堿溶液對(duì)GIh 的熒光淬滅情況如圖2 所示。GIh 的最大熒光發(fā)射峰約出現(xiàn)在358 nm 位置,隨著S型/R型煙堿的不斷加入,GIh的熒光強(qiáng)度逐漸降低,即發(fā)色團(tuán)的熒光發(fā)生了淬滅,并由此可斷定煙堿與GIh 間發(fā)生了相互作用,且煙堿均與GIh 存在一定程度的結(jié)合。同時(shí),可以看出加入相同濃度的S型和R型煙堿,S型對(duì)GIh的熒光淬滅強(qiáng)度均比R型煙堿強(qiáng)很多,因此也可以初步判斷S型煙堿與GIh 的作用強(qiáng)度大于R型。

圖2 298 K 下S 型/R 型煙堿與GIh 作用的熒光發(fā)射譜Fig.2 Fluorescence emission spectra of S/R-nicotine acting on GIh at 298 K
熒光淬滅主要指動(dòng)態(tài)淬滅和靜態(tài)淬滅兩種。判斷一個(gè)淬滅過(guò)程是動(dòng)態(tài)還是靜態(tài),可以依據(jù)其對(duì)溫度的依賴(lài)性。當(dāng)溫度升高時(shí)分子之間的碰撞會(huì)加劇,導(dǎo)致動(dòng)態(tài)淬滅常數(shù)增加;而在靜態(tài)淬滅機(jī)理下形成的復(fù)合物會(huì)發(fā)生解離,從而導(dǎo)致淬滅常數(shù)下降。考慮到內(nèi)濾效應(yīng)的影響,為確保實(shí)驗(yàn)結(jié)果的準(zhǔn)確性,本研究中用于分析計(jì)算的熒光數(shù)據(jù)均采用文獻(xiàn)中使用較多的公式(1)進(jìn)行數(shù)據(jù)校正。

式中:Fcor和Fobs分別為校正后和實(shí)驗(yàn)實(shí)測(cè)的熒光強(qiáng)度;A1和A2分別為GIh 和不同濃度的煙堿混合溶液在激發(fā)和發(fā)射波長(zhǎng)下的紫外吸光度,Abs。后續(xù)數(shù)據(jù)處理均使用校正后的數(shù)據(jù)。本研究中采用Stern-Volmer 方程(2)在不同溫度(298 和310 K)下的線性擬合分析熒光淬滅類(lèi)型[12]。
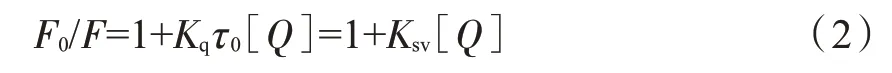
式中:F和F0分別為煙堿存在和不存在時(shí)GIh的熒光強(qiáng)度;Kq為熒光淬滅速率常數(shù),L/(ns·mol);τ0為GIh 的平均熒光壽命(298 K 下,τ0值為2.13 ns,由時(shí)間分辨熒光實(shí)驗(yàn)測(cè)定,見(jiàn)表1);[Q]為煙堿的濃度,mol/L;Ksv為Stern-Volmer 淬滅常數(shù),L/mol。
在不同溫度下,F(xiàn)0/F對(duì)[Q]的線性回歸分析擬合曲線見(jiàn)圖3。可知,不同溫度下的Stern-Volmer曲線線性關(guān)系良好。根據(jù)公式(2)計(jì)算得到的淬滅常數(shù)Ksv以及淬滅速率常數(shù)Kq見(jiàn)表1。可以看出,隨溫度升高,S型和R型煙堿對(duì)GIh 的淬滅常數(shù)Ksv逐漸減小,這表明兩種構(gòu)型煙堿和GIh 相互作用的過(guò)程為靜態(tài)淬滅,有復(fù)合物形成[13]。此外,S型和R型煙堿在不同溫度下的淬滅速率常數(shù)Kq值均大于最大散射碰撞淬滅速率常數(shù)值[2.0×1010L/(s·mol)],這進(jìn)一步表明,無(wú)論是S型還是R型煙堿與GIh 之間相互作用的淬滅機(jī)理均為靜態(tài)淬滅。
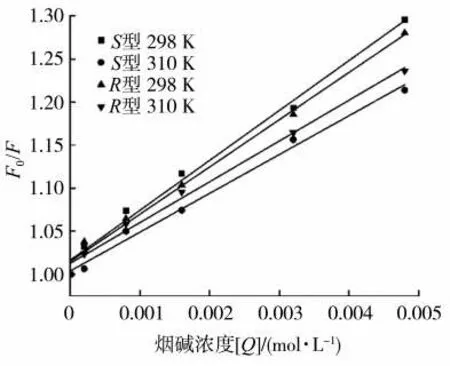
圖3 S 型和R 型煙堿與GIh 作用體系在不同溫度下的Stern-Volmer 擬合結(jié)果Fig.3 The Stern-Volmer plots of F0/F for GIh against S/R-nicotine at two different temperatures
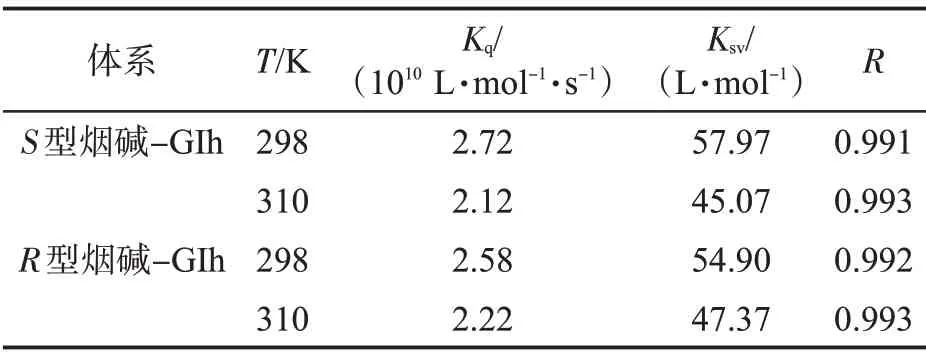
表1 S 型和R 型煙堿與GIh 作用體系在不同溫度下的Stern-Volmer 熒光淬滅常數(shù)Tab.1 Fluorescence quenching constants of S/R-nicotine and GIh systems in Stern-Volmer equation at different temperatures
動(dòng)態(tài)、靜態(tài)淬滅的區(qū)分也可通過(guò)對(duì)比加入煙堿前后GIh 的熒光壽命實(shí)現(xiàn)。若S型/R型煙堿與GIh 之間的淬滅類(lèi)型為動(dòng)態(tài)淬滅,隨著煙堿濃度增加,碰撞增加,GIh 熒光壽命衰減更快,表現(xiàn)為GIh熒光壽命減小;若S型/R型煙堿與GIh 之間的淬滅類(lèi)型為靜態(tài)淬滅,煙堿和GIh 形成無(wú)熒光或弱熒光復(fù)合物,不會(huì)改變GIh 激發(fā)態(tài)的熒光壽命。圖4為加入S型/R型煙堿后GIh 的熒光衰減曲線,可知,S型和R型煙堿加入后,均未使GIh 的熒光壽命發(fā)生較為明顯的變化。此外為了對(duì)結(jié)果進(jìn)行定量分析,通過(guò)雙指數(shù)迭代擬合(Bi-exponential iterative fitting)處理該體系的時(shí)間分辨熒光衰減數(shù)據(jù),見(jiàn)公式(3)[14-15],結(jié)果見(jiàn)表2。

使用卡方檢驗(yàn)(χ2)評(píng)估擬合結(jié)果的性能,若χ2<1.3,則擬合結(jié)果在可接受的容忍區(qū)間內(nèi)。通過(guò)熒光衰減時(shí)間(τ1、τ2、τ3)和正交化指前因子(α1、α2、α3)可計(jì)算其平均熒光壽命(τ)。由表2 可知,χ2<1.15,表明擬合結(jié)果可信。PBS(pH=7.4)緩沖溶液中熒光衰減曲線擬合熒光壽命參數(shù)見(jiàn)表2。空白GIh 的加權(quán)平均熒光壽命為2.13 ns,分別加入蛋白與配體的物質(zhì)的量比為1∶160 的S型、R型煙堿后,GIh 的加權(quán)平均熒光壽命為2.01 和1.94 ns。S型/R型煙堿-GIh 作用體系未發(fā)生動(dòng)態(tài)淬滅,結(jié)合圖4 可以確定S型/R型煙堿與GIh 作用形成有非熒光或弱熒光復(fù)合物。若將儀器誤差考慮在內(nèi),并除去高濃度S型/R型煙堿與蛋白形成復(fù)合物的熒光壽命的影響,空白GIh 的熒光壽命未變。因此,進(jìn)一步明確S型/R型煙堿與GIh 之間的淬滅機(jī)理均為靜態(tài)淬滅。
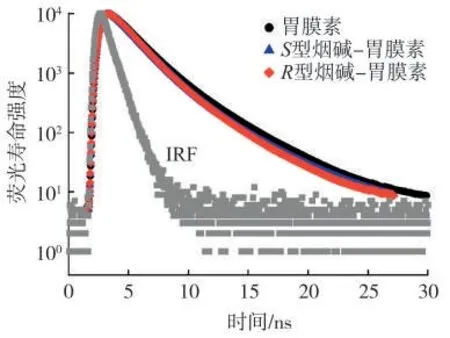
圖4 S 型/R 型煙堿與GIh 相互作用的時(shí)間分辨熒光Fig.4 Time-resolved fluorescence of S/R-nicotine and GIh
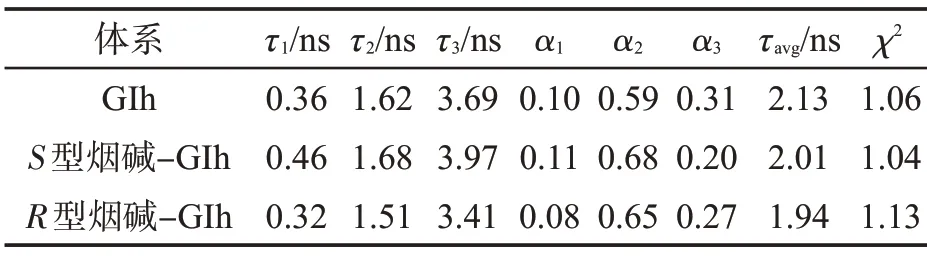
表2 S 型/R 型煙堿與GIh 體系的熒光衰減曲線擬合參數(shù)Tab.2 Fitting parameters of fluorescence lifetime curve of S/R-nicotine and GIh system
2.2 結(jié)合常數(shù)及結(jié)合位點(diǎn)數(shù)
當(dāng)S型/R型煙堿與GIh 之間的淬滅機(jī)理均為靜態(tài)淬滅時(shí),假定小分子配體S型/R型煙堿在GIh上有n個(gè)相同且獨(dú)立的結(jié)合位點(diǎn),那么熒光強(qiáng)度、淬滅劑的濃度與結(jié)合常數(shù)及結(jié)合位點(diǎn)數(shù)之間的關(guān)系符合雙對(duì)數(shù)方程,即修正過(guò)的Stern-Volmer 方程,也稱(chēng)為雙對(duì)數(shù)曲線[16-17]。
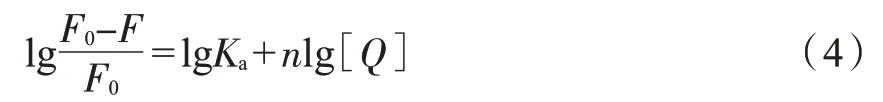
式中:Ka為小分子配體與蛋白的結(jié)合常數(shù),L/mol;n(斜率)表示結(jié)合位點(diǎn)數(shù)。lg[(F0-F)/F0]對(duì)lg[Q]的擬合曲線見(jiàn)圖5,計(jì)算結(jié)果見(jiàn)表3。從Ka值分析,S型和R型煙堿與GIh 形成基態(tài)復(fù)合物的能力均較弱,說(shuō)明煙堿不易與GIh 發(fā)生結(jié)合,或生成煙堿-GIh 復(fù)合物的穩(wěn)定性差。結(jié)合常數(shù)均表現(xiàn)出隨溫度升高而增加的趨勢(shì),表示升高溫度均有利于復(fù)合物的生成。同時(shí)可以發(fā)現(xiàn)在兩個(gè)溫度下,S型煙堿與GIh 的結(jié)合常數(shù)均比R型煙堿強(qiáng),說(shuō)明在模擬人體環(huán)境下,S型煙堿更易與GIh 發(fā)生結(jié)合并形成基態(tài)復(fù)合物。

圖5 不同溫度下S型和R型煙堿-GIh體系的lg[(F0-F)/F0]對(duì)lg[Q]擬合曲線Fig.5 Fitting curves of lg[(F0-F)/F0]to lg[Q]for S/R-nicotine-GIh systems at different temperatures
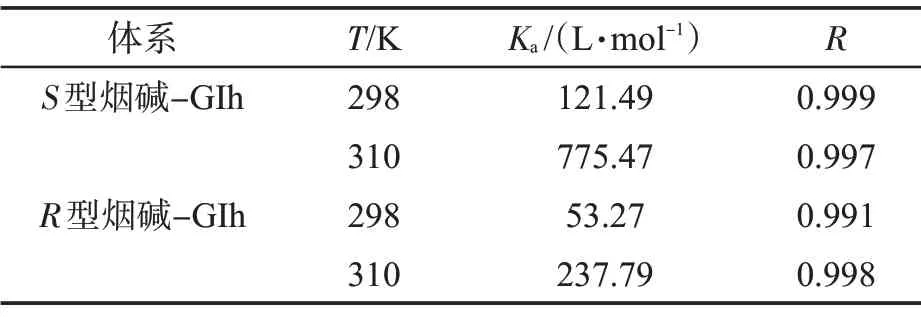
表3 不同溫度下S 型/R 型煙堿與GIh 結(jié)合的相關(guān)參數(shù)Tab.3 Binding constants of S/R-nicotine and GIh at different temperatures
2.3 作用力類(lèi)型
有機(jī)小分子與蛋白質(zhì)之間的結(jié)合依賴(lài)弱的非共價(jià)作用力,其類(lèi)型主要包括氫鍵、靜電作用、疏水作用和范德華力等[18]。Ross 和Sun 根據(jù)大量的實(shí)驗(yàn)和理論[19-20],總結(jié)出了判斷蛋白質(zhì)與小分子結(jié)合作用力類(lèi)型與熱力學(xué)函數(shù)之間的關(guān)系。由Van’t Hoff 方程(5)和Gibbs-Helmholtz 方程(6),可根據(jù)不同溫度下結(jié)合常數(shù)的變化計(jì)算得到有機(jī)小分子與蛋白質(zhì)的相互作用熱力學(xué)參數(shù)。
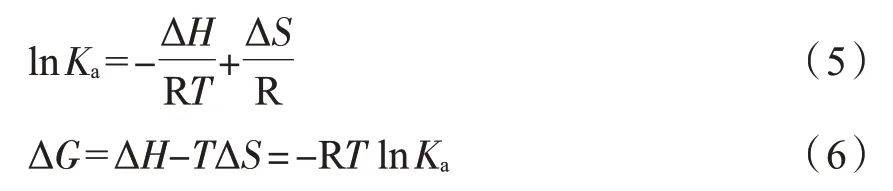
式中,T為實(shí)驗(yàn)溫度,K;Ka為相應(yīng)溫度下的結(jié)合常數(shù),L/mol;R 為摩爾氣體常數(shù),J/(mol·K);ΔH為焓變,kJ/mol;ΔS為熵變,J/(mol·K);ΔG為吉布斯自由能,kJ/mol。
在溫度變化不大時(shí),一般認(rèn)為ΔH為恒定值,分子間的相互作用力類(lèi)型可由ΔS判斷:ΔH<0,ΔS>0,為靜電作用力;ΔH>0,ΔS>0,為典型的疏水作用力;ΔH<0,ΔS<0,為氫鍵和范德華力[18,21]。S型/R型煙堿與GIh 作用體系的Van’t Hoff 擬合曲線如圖6 所示,擬合結(jié)果列于表4。ΔG為負(fù)值表明S型煙堿和R型煙堿與GIh 的相互作用是一個(gè)自發(fā)的過(guò)程,且ΔH、ΔS均為正值,表明疏水作用力在該相互作用體系的結(jié)合中占主導(dǎo)地位。

圖6 S型/R型煙堿與GIh作用體系的Van’t Hoff擬合曲線Fig.6 Van’t Hoff fitting lines of the interaction system of S/R-nicotine and GIh

表4 不同溫度下S 型/R 型煙堿與GIh 結(jié)合的相關(guān)參數(shù)Tab.4 Thermodynamic parameters of S/R-nicotine and GIh at different temperatures
2.4 S型/R型煙堿與GIh結(jié)合對(duì)構(gòu)型和構(gòu)象的影響
當(dāng)S型/R型煙堿與GIh 發(fā)生相互作用時(shí),由于分子間或分子內(nèi)作用力的改變,會(huì)導(dǎo)致蛋白的二級(jí)或三級(jí)結(jié)構(gòu)發(fā)生改變,進(jìn)而影響蛋白質(zhì)的整體構(gòu)象。本實(shí)驗(yàn)中,利用同步熒光光譜、三維熒光光譜和圓二色光譜分析了由S型/R型煙堿引起的GIh 的微環(huán)境變化和結(jié)合引起的煙堿構(gòu)型的改變。
(1)同步熒光光譜
同步熒光光譜同時(shí)掃描激發(fā)和發(fā)射兩個(gè)單色器波長(zhǎng),得到熒光信號(hào)強(qiáng)度與激發(fā)波長(zhǎng)(或發(fā)射波長(zhǎng))相對(duì)應(yīng)的熒光譜圖。一般按掃描方式不同,分為恒波長(zhǎng)、恒能量、恒基體和可變角法[22]。在有機(jī)小分子與蛋白質(zhì)結(jié)合過(guò)程中,常用恒波長(zhǎng)法,設(shè)定發(fā)射波長(zhǎng)對(duì)激發(fā)波長(zhǎng)的增數(shù)恒定(即Δλ=λem-λex,為常數(shù)),該增數(shù)不同,會(huì)導(dǎo)致同步熒光光譜反映出蛋白質(zhì)分子內(nèi)源性熒光發(fā)色團(tuán)氨基酸殘基周?chē)煌奈h(huán)境,例如當(dāng)Δλ=60 nm 時(shí)表現(xiàn)為T(mén)rp 氨基酸殘基的熒光;Δλ=15 nm 時(shí)表現(xiàn)Tyr 氨基酸殘基的光譜特征。該方法的優(yōu)勢(shì)在于將內(nèi)源性熒光發(fā)色基團(tuán)(對(duì)蛋白質(zhì)而言,為T(mén)rp、Tyr 和Phe)的峰譜重疊從發(fā)射峰中區(qū)分出來(lái),能簡(jiǎn)明觀測(cè)到有機(jī)小分子的進(jìn)攻對(duì)蛋白質(zhì)特定氨基酸殘基周?chē)h(huán)境的影響。
圖7 為S型/R型煙堿與GIh 作用的同步熒光譜圖。當(dāng)Δλ=15 nm 時(shí),滴加S型/R型煙堿并未看到兩個(gè)同步熒光峰有明顯位移,表明GIh 的發(fā)色團(tuán)微環(huán)境(疏水或親水性)未受S型/R型煙堿加入的影響。當(dāng)Δλ=60 nm 時(shí),在測(cè)試濃度范圍內(nèi)S型/R型煙堿的加入使GIh 在280 nm 處的同步熒光峰輕微降低且有一定程度的紅移;而在350 nm 前后的同步熒光峰表現(xiàn)出明顯的熒光增強(qiáng)現(xiàn)象和紅移,表明S型/R型煙堿的加入主要對(duì)色氨酸殘基本身的熒光和周?chē)h(huán)境產(chǎn)生明顯影響,增加了色氨酸殘基周?chē)臉O性并降低了疏水性。且通過(guò)對(duì)比兩種煙堿異構(gòu)體可以發(fā)現(xiàn),S型煙堿對(duì)色氨酸和酪氨酸殘基均有影響,而R型煙堿主要對(duì)色氨酸周?chē)h(huán)境影響較大。

圖7 Δλ=15、60 nm 時(shí)不同S 型/R 型煙堿濃度下GIh 的同步熒光光譜圖Fig.7 Synchronous fluorescence spectra of S/R-nicotine and GIh at Δλ=15,60 nm
(2)三維熒光光譜
三維熒光是通過(guò)固定激發(fā)(或發(fā)射)波長(zhǎng)來(lái)掃描發(fā)射(或激發(fā))波長(zhǎng)得到熒光強(qiáng)度隨波長(zhǎng)變換的二維平面圖。三維熒光技術(shù)同時(shí)考慮激發(fā)和發(fā)射兩個(gè)函數(shù)的變化,能夠獲得兩個(gè)波長(zhǎng)同時(shí)變化的熒光圖譜,繪制得到的立體三維投影圖分別以x、y、z軸作為發(fā)射波長(zhǎng)(λex)、激發(fā)波長(zhǎng)(λem)和熒光強(qiáng)度,可直接觀察到蛋白特征峰位置和高度的光譜學(xué)特性,并根據(jù)λex,λem和熒光強(qiáng)度及峰形變化等參數(shù)考察蛋白質(zhì)的構(gòu)象變化[23]。在三維熒光譜圖的特征峰為二倍銳利散射峰Peak A(λex=2λem),銳利散射峰Peak B(λex=λem),蛋白多肽骨架特征峰Peak 1(π→π*躍遷引起,λex/λem=225 nm/340 nm附近)以及Trp 和Tyr 氨基酸殘基n→π*躍遷峰Peak 2(λex/λem=280 nm/350 nm 附近)[24]。該熒光法得到的蛋白質(zhì)構(gòu)象的熒光信息相對(duì)全面。
圖8 為空白GIh 和加入S型/R型后的煙堿-GIh 體系的三維熒光的二維輪廓圖。S型和R型煙堿的加入使Peak 1 分別下降了約1.45%和9.46%,變化很小,且斯托克斯(Stokes)位移幾乎未移動(dòng),表明煙堿與GIh 發(fā)生了結(jié)合,但基本不影響蛋白多肽骨架。對(duì)于Peak 2 來(lái)說(shuō),S型和R型煙堿的加入分別使熒光強(qiáng)度增加了64.07%和96.13%,并伴有較大的斯托克斯位移(表5),說(shuō)明對(duì)Trp 和Tyr 氨基酸殘基的微環(huán)境影響較大,且R型煙堿的影響更大。該結(jié)果與同步熒光結(jié)果一致,不僅能證明蛋白的構(gòu)象變化,也能輔助說(shuō)明同步熒光光譜結(jié)果的可信度。
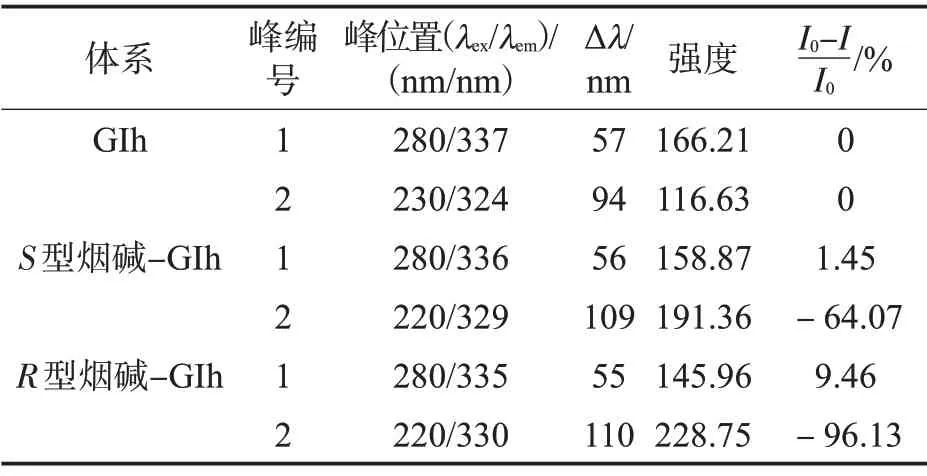
表5 GIh 和S/R 型煙堿-GIh 體系的三維熒光光譜參數(shù)Tab.5 Three-dimensional fluorescence spectrum parameters of GIh and S/R-nicotine-GIh systems
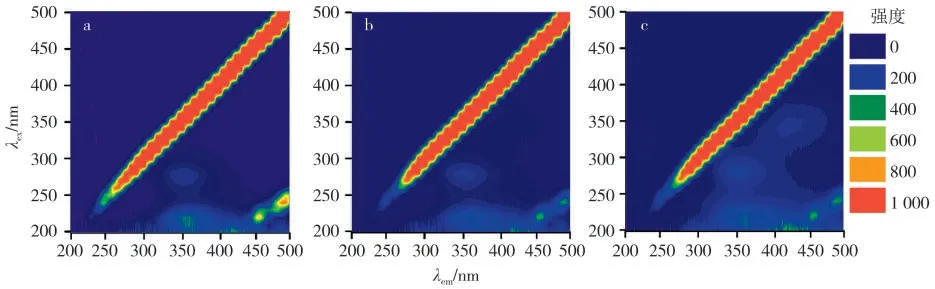
圖8 煙堿-GIh 體系三維熒光的二維輪廓譜圖Fig.8 Two-dimensional fluorescence profile of GIh and S/R-nicotine-GIh systems obtained from three-dimensional fluorescence
(3)圓二色光譜法
圓二色譜法從1960 年開(kāi)始被廣泛用于蛋白質(zhì)、多肽等生物大分子的二級(jí)結(jié)構(gòu)信息研究。其測(cè)試原理是利用化合物使平面偏振光變成橢圓偏振光的圓二色性[25]。對(duì)于蛋白質(zhì)而言,其中的不對(duì)稱(chēng)氨基酸殘基提供了剛性的肽鏈骨架和自由旋轉(zhuǎn)的α-碳側(cè)鏈,氨基化合物基團(tuán)經(jīng)偏振光后,會(huì)在遠(yuǎn)紫外區(qū)域波段存在n→π*和π→π*躍遷,從而影響多肽骨架的幾何結(jié)構(gòu),蛋白質(zhì)由于氨基酸序列及氨基酸殘基周?chē)h(huán)境的不同呈現(xiàn)出不同的二級(jí)結(jié)構(gòu)形態(tài),掃描樣品圓二色譜(蛋白質(zhì)樣品多為190~260 nm 遠(yuǎn)紫外區(qū)域),可得到二級(jí)結(jié)構(gòu)的不同組成部分[25-26]。例如,α-螺旋的在190 nm 附近(π→π*)有一個(gè)較高正峰,208 nm(π→π*)和220 nm(n→π*)附近有兩個(gè)程度相近的負(fù)峰;β-折疊會(huì)隨蛋白質(zhì)主螺旋結(jié)構(gòu)的不同而產(chǎn)生不同的方向性,故特征峰型及位置會(huì)有所不同,多數(shù)在195~202 nm 有正峰信號(hào),在215~220 nm 有負(fù)峰信號(hào);β-轉(zhuǎn)角在180~190 nm 有一個(gè)寬幅吸收帶(常因溶液效應(yīng)而在實(shí)際圖譜上觀察不到),200~205 nm(π→π*)和225 nm(n→π*)有負(fù)峰;而無(wú)規(guī)則卷曲構(gòu)象則在200 nm 附近有負(fù)信號(hào)[27-28]。
由圖9 可明顯看出,S型和R型煙堿有明顯的圓二色性,因此,在為了消除煙堿的影響,對(duì)反應(yīng)后的樣品峰進(jìn)行了差譜處理。對(duì)比空白S型/R型煙堿及其差譜峰(圖9a)可以發(fā)現(xiàn),S型和R型一直是呈對(duì)稱(chēng)分布的,且差譜后的峰與空白峰相比呈現(xiàn)倒峰關(guān)系,具有一定的規(guī)律性。原因可能是S型和R型煙堿與GIh 之間發(fā)生相互作用后兩種構(gòu)型的煙堿發(fā)生異構(gòu)化,在結(jié)合中發(fā)生了構(gòu)型的翻轉(zhuǎn),這表明煙堿與生物大分子的結(jié)合可能是由構(gòu)型翻轉(zhuǎn)誘導(dǎo)的[29]。此外,圖9b 顯示的是單獨(dú)GIh的圓二色圖譜,可以看到GIh 在測(cè)試范圍(190~280 nm)內(nèi)均呈現(xiàn)負(fù)吸收,且在208 和212 nm 處有兩個(gè)負(fù)蜂,這是α-螺旋的特征峰,屬于螺旋結(jié)構(gòu)中肽鏈上n→π*和π→π*的躍遷。用平均殘基橢圓率(Mean residueellipticity,MRE)計(jì)算圓二色譜結(jié)果,其單位為deg·cm2·dmol-1,計(jì)算公式如下:
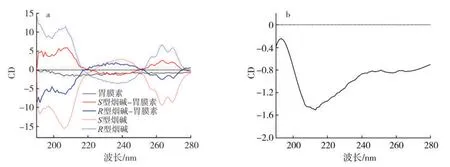
圖9 煙堿-GIh 體系的圓二色光譜圖Fig.9 Circular dichroism of nicotine-Gih system
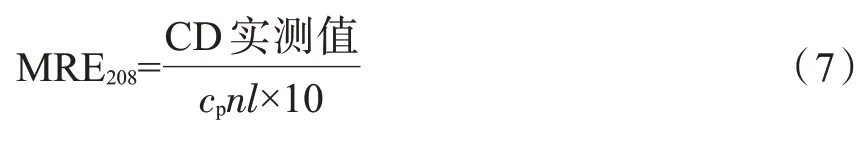
式中:cp是蛋白的濃度,mol/L;n為蛋白的氨基酸殘基個(gè)數(shù),17 個(gè);l為測(cè)試皿的光徑,0.1 cm。GIh 二級(jí)結(jié)構(gòu)中α-螺旋質(zhì)量百分比的計(jì)算式為:

計(jì)算結(jié)果顯示,GIh 的α-螺旋的質(zhì)量百分比約為38.83%。雖然目前仍未得到GIh 的單晶數(shù)據(jù),但從CD 結(jié)果可以看出,GIh 的二級(jí)結(jié)構(gòu)中含有一定量的α-螺旋結(jié)構(gòu)。由于GIh 的分子量很小,圓二色信號(hào)較弱,加入兩種構(gòu)型的煙堿后主要顯示出煙堿的特征吸收峰。因此,無(wú)法通過(guò)圓二色光譜法來(lái)研究S型和R型煙堿與GIh 之間的結(jié)合對(duì)蛋白二級(jí)結(jié)構(gòu)的影響。
3 結(jié)論
①兩種構(gòu)型的煙堿與GIh 之間均存在由疏水作用力占主導(dǎo)的較弱的相互作用,S型煙堿與GIh間的結(jié)合強(qiáng)度略強(qiáng)于R型,且均對(duì)溫度比較敏感,一定程度提高溫度有利于兩種構(gòu)型的煙堿與GIh間的結(jié)合。②S型/R型煙堿對(duì)GIh 的熒光淬滅機(jī)理相同,均為靜態(tài)淬滅方式。③兩種構(gòu)型的煙堿作用于GIh 時(shí)均會(huì)引起一定程度的氨基酸殘基周?chē)h(huán)境的改變,且CD 結(jié)果顯示在與GIh 結(jié)合時(shí)具有構(gòu)型翻轉(zhuǎn)的現(xiàn)象,表明煙堿構(gòu)型對(duì)于與GIh的結(jié)合具有重要影響。

