南苕溪溶解性有機質光譜特性及其與水質參數的相關性研究*
徐兵兵
(上海太和水環境科技發展股份有限公司,上海 200433)
溶解性有機質(DOM)普遍存在于水域環境中,是水域生態系統中重要的化學組分。自然水體中的DOM含有豐富的碳、氮、磷等營養元素,能夠參與多種物理、化學和生物過程,在水體生態系統物質循環、污染物遷移轉化、生物降解等方面扮演著重要的角色[1]。因此,關于DOM的組成及其特征的研究,對于明晰水體生態系統物質循環、水環境保護、水體生物地球化學等具有重要意義[2]。DOM中能夠吸收紫外光和低波長可見光并著色的部分,主要由腐殖酸、富里酸、脂肪族及芳香烴類物質組成,稱為有色溶解性有機質(CDOM),部分CDOM在吸收紫外光后發射長于激發波長的熒光,稱為熒光溶解性有機質(FDOM)[3-4]。
紫外—可見吸收光譜及三維熒光光譜因具有靈敏度高、成本低、操作簡便、測量快速等優點[5],被廣泛應用于河流[6]、湖泊[7]、河口[8]、海洋[9]等天然水體中DOM的結構、組成以及來源等信息的表征。為此,人們開始越來越多地了解到DOM的特征,并據此追溯DOM的來源,識別其性質的改變。鑒于DOM在水體生態環境系統中的重要作用,DOM的性質常常被用來作為監測水體污染的重要表征,如DOM的三維熒光特性能夠便捷地反映水體水質、外源污染、內源污染等[10-12],DOM的光譜特性也可以便捷地表征BOD5、COD等指標的濃度,且與其他相關的生物地球化學變量存在相關性[13]。目前國內外學者已經運用三維熒光光譜等技術對DOM組成、分布特征及來源等做了大量研究,但主要集中在一些富營養化湖泊水體(水庫)以及大江大河中,在源頭溪流中的報道還十分有限,尤其是位于山區的天然河流系統。
源頭溪流是河流、湖、庫水系統的重要組成部分,是匯水區物質匯集和向下游水體傳輸的重要載體和通道。各等級小河流攜帶的泥沙、有機質、木質殘體和營養物經逐級匯流、傳輸,最終進入更高等級河流或湖、庫、海灣中,影響這些水體的生態學特征[14]。苕溪是太湖最大的入湖河流,其上游支流南苕溪位于浙西丘陵區,是杭嘉湖平原的重要飲用水源,而且是太湖的上游發源地。因此,研究該流域的水質狀況對居民健康及太湖富營養化防治具有重要意義。為了解源頭溪流DOM的特征和來源,本研究選擇南苕溪作為研究對象,運用紫外—可見吸收光譜、三維熒光光譜測定及平行因子分析,結合水體理化特征,闡釋南苕溪水體DOM的組成及來源,初步揭示其與水質的相關性,以期為源頭溪流水質監測及污染預警提供有益的參考。
1 材料與方法
1.1 研究區概況
南苕溪是東苕溪的主源,東苕溪是太湖最大入湖水系之一。南苕溪屬山溪性河流,87%的水域分布于浙江臨安境內,境內段長55 km,流域面積620.8 km2。南苕溪有浪口溪、南溪、錦溪3條主要支流,南流浪口溪經里畈水庫至浪口匯南溪后匯入南苕溪,東流穿過臨安城區于青龍口匯錦溪后入青山水庫。浪口溪和南溪河段地處浙西山丘區,河道坡降較大,土地利用類型也存在差異,浪口溪以天然林覆被為主,南溪沿岸雷竹林廣泛分布。錦溪河段地勢相對平坦,依次流經上游農業區、玲瓏工業區、臨安城區。流域地處亞熱帶季風氣候區,溫和濕潤,降水豐沛,多年平均氣溫15.8 ℃,多年平均降水量約為1 460 mm,降水量年內分配不勻,受地形、氣候諸多因素制約。
1.2 樣品采集與測試
對南苕溪全流域實地考察后,于南苕溪干流以及主要支流布設16個采樣點,其中浪口溪布設4個采樣點(記為L1~L4),南溪布設4個采樣點(記為N1~N4),錦溪布設6個采樣點(記為J1~J6),南苕溪干流布設2個采樣點(記為S1、S2)(見圖1),自2013年4月至12月逐月(8月和11月未采樣)進行水樣采集。為消除暴雨事件對DOM遷移的影響,在基流期采集水樣,共得到樣品112個。南苕溪上游各支流水淺(水深<1.5 m)、河窄(寬度<5 m),于溪流中心采集水樣;下游河道變寬,采集河道中心及兩側的水樣按等比例混合。現場采用SensION 156型多參數水質分析儀(美國哈希)測定并記錄水溫、pH、溶解氧(DO)、電導率(EC)等理化指標,用Phyto-PAM型浮游植物葉綠素熒光儀(德國Walz)測定葉綠素a(Chl-a)含量。采集到的水樣在冷藏條件下運回實驗室,進行營養鹽分析以及紫外—可見吸收光譜、三維熒光光譜測試。
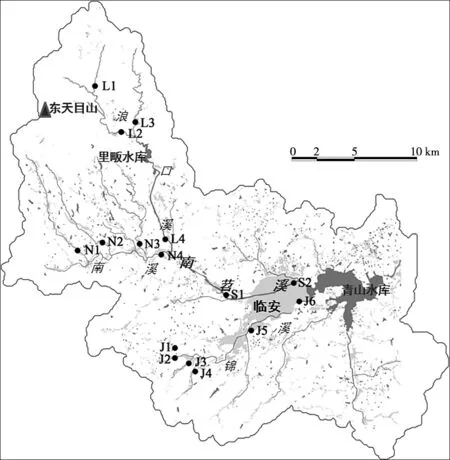
圖1 南苕溪水系采樣點布設Fig.1 Sampling sites in the South Tiaoxi River
1.2.1 營養鹽分析
原水用于測試總氮(TN)和總磷(TP)濃度。取適量原水經0.45 μm醋酸纖維濾膜過濾后,濾液用于測定溶解性有機碳(DOC)、溶解性總氮(DTN)、氨氮、硝態氮、亞硝態氮、溶解性總磷(DTP)、溶解性正磷酸鹽(SRP)的濃度。TN、DTN采用堿性過硫酸鉀分光光度法測定;硝態氮采用紫外吸收法測定;氨氮采用納氏試劑分光光度法測定;亞硝態氮采用重氮偶合分光光度法測定;TP、DTP、SRP采用鉬酸銨分光光度法測定。利用TOC-VCPN型總有機碳分析儀(日本島津)測定DOC濃度,由于水樣中DOC濃度較低,采用不可吹脫有機碳法測定。溶解性有機氮(DON)和溶解性有機磷(DOP)濃度采用差減法求得,其中,DON為DTN與3種無機氮(氨氮、硝態氮、亞硝態氮)之差,DOP為DTP與SRP之差。
1.2.2 紫外—可見吸收光譜分析
用TU-1901型雙光束紫外—可見分光光度計對樣品進行吸收光譜掃描,使用5 cm石英比色皿,掃描范圍為200~800 nm,步長1 nm。為校正儀器波動,每個波長下的吸光度需減去680~700 nm的吸光度平均值,根據式(1)計算吸收系數,根據式(2)計算比吸收系數。
aλ=2.303×Aλ/r
(1)
SUVAλ=aλ/cDOC
(2)
式中:aλ為波長λnm處的吸光系數,m-1;Aλ為校正后波長λnm處的吸光度;r為比色皿厚度,m;SUVAλ為波長λnm處的比吸收系數,L/(mg·m);cDOC為DOC質量濃度,mg/L。
參考文獻[15],采用波長355 nm處的吸收系數(a355)表示CDOM含量;參考文獻[16],采用波長254 nm處的比吸收系數(SUVA254)反映芳香性碳的含量,SUVA254越大表明DOM的芳香性越強。
1.2.3 三維熒光光譜測定及平行因子分析
用AquaLogTM型熒光光譜分析儀(法國HORIBA)對水樣進行三維熒光光譜掃描,掃描范圍為:激發波長(Ex)240~400 nm,步長3.00 nm ;發射波長(Em)300~550 nm,步長3.34 nm;積分時間1 s。樣品光譜數據經過內濾效應校正[17],扣除空白和拉曼歸一化處理后,運用平行因子分析模型PARAFAC識別不同的熒光組分[18]。參考文獻[19]、[20]計算水樣熒光指數(FI)、腐殖化指數(HIX)和生物源指數(BIX)。FI用于識別DOM的來源,FI <1.4時表明DOM來源于陸源(外源);FI >1.9時表明DOM來源于微生物源(內源)[19]。HIX用于表征DOM的腐殖化程度,HIX越大表明DOM腐殖化程度越高,當HIX>16時認為DOM具有強腐殖質化特征或陸源貢獻顯著; HIX介于6~10時,認為DOM腐殖化特征較明顯且新近自生源成分較弱;HIX介于4~6時認為腐殖化特征較弱且新近自生源成分顯著;HIX<4時表明DOM為生物或水生細菌來源。BIX可用于衡量新近自生源對DOM的貢獻,BIX越大表明新近自生源對DOM的貢獻越大,BIX為0.6~0.7時表明新近自生源DOM較少;BIX為>0.7~0.8時表明新近自生源DOM中等;BIX為>0.8~1.0時表明新近自生源DOM較多;BIX>1.0時表明DOM來源為生物或水生細菌[20]。
1.3 數據處理
數據分析前,利用Z分數標準化法對數據中的異常值予以剔除,并將各參數標準化。各參數之間的相關分析采用Pearson相關系數及雙尾顯著性檢驗,顯著性水平為p<0.05;采用多元回歸分析建立水質參數與CDOM含量及熒光組分的回歸方程,為避免回歸模型中變量間的共線性,檢驗模型的條件指標值(CI),當CI小于30時,認為變量間不存在共線性。數據處理和統計分析采用SPSS 16.0軟件,繪圖采用Origin 8.5軟件。
2 結果與討論
2.1 南苕溪水體理化性質
南苕溪水體呈中性偏弱堿性,pH為7.89±0.69;DO質量濃度相對較高,為(9.92±1.94) mg/L,表明水體的有氧狀態占主導地位。水體EC為(223.58±109.37) μS/cm,標準偏差較大,且上游源頭EC(45.30 μS/cm)明顯低于下游河段(495.00 μS/cm),與南苕溪下游流經臨安城區,城鎮生活污水、工業廢水排放有關[21];Chl-a質量濃度為(7.10±7.74) μg/L,低于其下游東苕溪及太湖[22-23];DOC為(2.53±1.14) mg/L,高于DON和DOP,與MATTSSON等[24]在芬蘭、丹麥、英國和法國等國家多條河流的監測結果相似。南苕溪水體氮含量總體偏高,DTN為(3.15±1.47) mg/L,平均值為《地表水環境質量標準》(GB 3838—2002)Ⅴ類限值的1.5倍,硝態氮是最主要的氮形態,平均質量濃度為(2.41±1.28) mg/L,占DTN的77%(質量分數,下同),DON和氨氮分別占DTN的12%、7%,與其受納水體太湖中氮素比例一致[25]。南苕溪水體磷含量總體偏低,DTP平均質量濃度為(0.08±0.06)mg/L,介于GB 3838—2002的Ⅰ~Ⅱ類,SRP和DOP占DTP的比例分別為68%、32%。
2.2 南苕溪水體DOM的光譜特征
對112個樣品的三維熒光光譜數據進行平行因子分析,共識別出4種組分,包括兩個類蛋白組分(記為C1、C2)和兩個類腐殖質組分(記為C3、C4),4個組分的三維熒光光譜見圖2。熒光峰類型與已報道的其他水域環境相似[26-27],組分C1(Ex/Em為273 nm/320 nm)具有單一激發峰和發射峰,為類酪氨酸熒光峰,對應傳統組分的T峰。組分C2(Ex/Em為<240 nm/340 nm和282 nm/340 nm)具有2個激發峰和1個發射峰,為類色氨酸熒光峰。組分C3(Ex/Em為<240 nm/402 nm和321 nm/402 nm)具有2個激發峰和1個發射峰,可以被歸類為陸源類腐殖質A峰(Ex/Em為230~260 nm/380~460 nm)和海源類腐殖質M峰(Ex/Em為290~310 nm/370~420 nm)。先前的研究表明,該組分可能來源于陸源,或者在水域環境中利用陸源有機質產生的自生源[28]。組分C4(Ex/Em為275/471 nm和365 nm/471 nm)同樣具有2個激發峰和1個發射峰,代表從陸源輸出的腐殖質物質,該組分與傳統的陸源類腐殖質C峰相似。相對于C3組分,C4組分的熒光峰發生了紅移,表明其具有更高程度的芳香性縮聚作用和更大的化學穩定性。不同水域熒光峰值位置和強度的差異暗示了不同水域DOM來源和組成的差異。每個組分的熒光強度由其最大熒光強度(Fmax)表示,每個組分的相對貢獻由各個組分的Fmax在所有組分的熒光強度之和中的占比計算而得。C1~C4組分的熒光強度平均值分別為0.17±0.27、0.22±0.28、0.21±0.11、0.11±0.06,以類色氨酸熒光峰最強,陸源類腐殖質A峰次之,內源生產的類蛋白組分相對貢獻略高于外源輸入的類腐殖質組分。然而,類蛋白組分的標準偏差較大,說明其在時空上存在較大差異,與流域從上游河源到下游河口土地利用類型由天然林、經濟林變遷為城鎮,及其相應污染梯度變化特征有關。
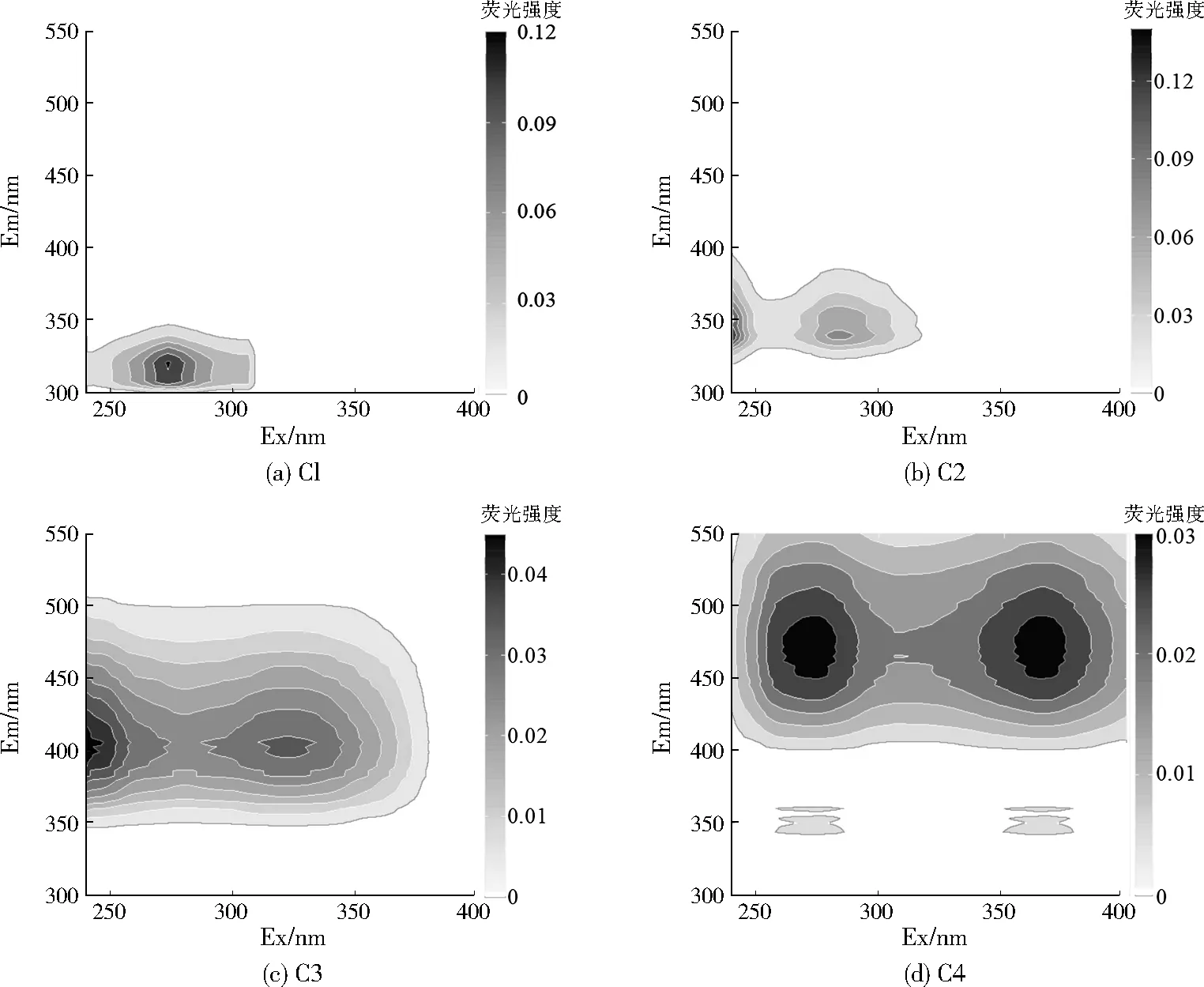
圖2 PARAFAC模型鑒別出的4個熒光組分Fig.2 Four fluorescent components identified by PARAFAC model
南苕溪水體a355的變化范圍為0.13~6.84 m-1,平均值為(1.46±0.88) m-1。用水樣在275~295 nm的光譜斜率(S275-295,nm-1)判斷CDOM來源和組成。南苕溪水體S275-295的變化范圍為0.007 6~0.019 6 nm-1,平均值為(0.013 2±0.002 7) nm-1。S275-295的變化一般來自于CDOM組成的差異,水樣S275-295較低,且其標準偏差較小,表明CDOM中陸源組分的比例較高,且各子流域CDOM組成相似[29]。FI的變化范圍為1.59~2.11,平均值為1.83±0.10,可見DOM介于微生物源特征和陸源特征之間,表明南苕溪DOM的來源既有植物枯枝落葉、根系分泌物及人類活動等陸源輸入,又有內部微生物活動參與。HIX的變化范圍為0.14~8.96,平均值為4.19±2.05,表明南苕溪水體DOM腐殖化特征較弱且新近自生源成分顯著。BIX的變化范圍為0.64~1.63,平均值為0.88±0.20,表明南苕溪水體新近自生源DOM較多。綜合3個熒光參數,說明在基流期,南苕溪水體DOM表現出腐殖化程度低,新近自生源高的特點。
2.3 光譜特征與水質參數的相關分析
分別以水溫、DO為自變量,水體DOM熒光參數及組分為因變量進行相關分析,對具有顯著相關性的參數進行匯總(見表1)。BIX與水溫和DO均呈顯著正相關關系,表明在高溫或富氧環境下,水域中微生物的活性較強,DOM的內源生產過程較強。a355、C3、C4與水溫呈顯著正相關關系,與DO呈顯著負相關關系。研究區域雨熱同期,水溫高的時期,往往流量越大,DOM的外源輸入過程也越強。外源DOM的輸入,刺激微生物活動,從而消耗水體中的DO。由此推斷,外源DOM的輸入也是導致水體DO含量減少的原因之一[30]。分別用4月、6月、10月、12月代表春、夏、秋、冬季,4個典型月CDOM吸收系數與浮游植物Chl-a濃度回歸結果見圖3。4個典型月Chl-a濃度與a355均呈顯著線性相關,表明CDOM的濃度受到浮游植物的影響。浮游植物產生的DOM多數不具有熒光特性,但是在水體微生物作用下可轉化為具有熒光特性的DOM,會產生類腐殖質熒光信號[31]。張運林等[32]觀測到梅梁灣和大太湖夏季水華暴發期CDOM吸收系數與Chl-a濃度存在正相關,李素菊[33]在巢湖Chl-a濃度較高時,也觀測到相似結果。本研究中,盡管南苕溪Chl-a質量濃度較低(<35 μg/L),同樣觀測到CDOM吸收系數與Chl-a濃度存在正相關。在2013年10月,“菲特”臺風引起的暴雨徑流攜帶大量陸源物質輸入河流,河流藻類濃度較低(Chl-a小于6 μg/L),亦觀測到相同趨勢,說明南苕溪浮游植物降解對水體中CDOM有重要貢獻,浮游植物殘體腐爛降解的產物是水體中CDOM的重要來源。
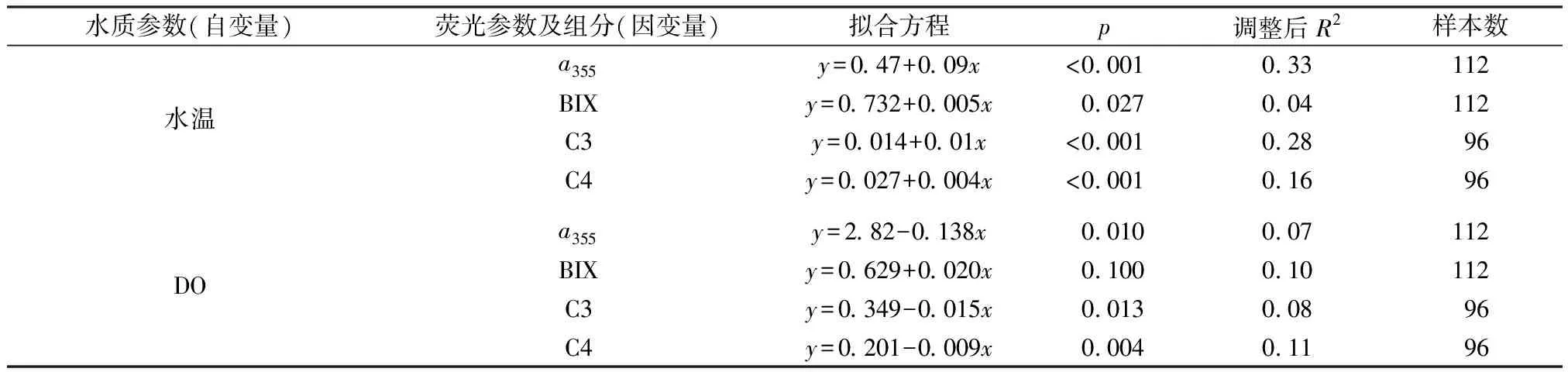
表1 熒光參數及組分與水溫和DO的相關關系
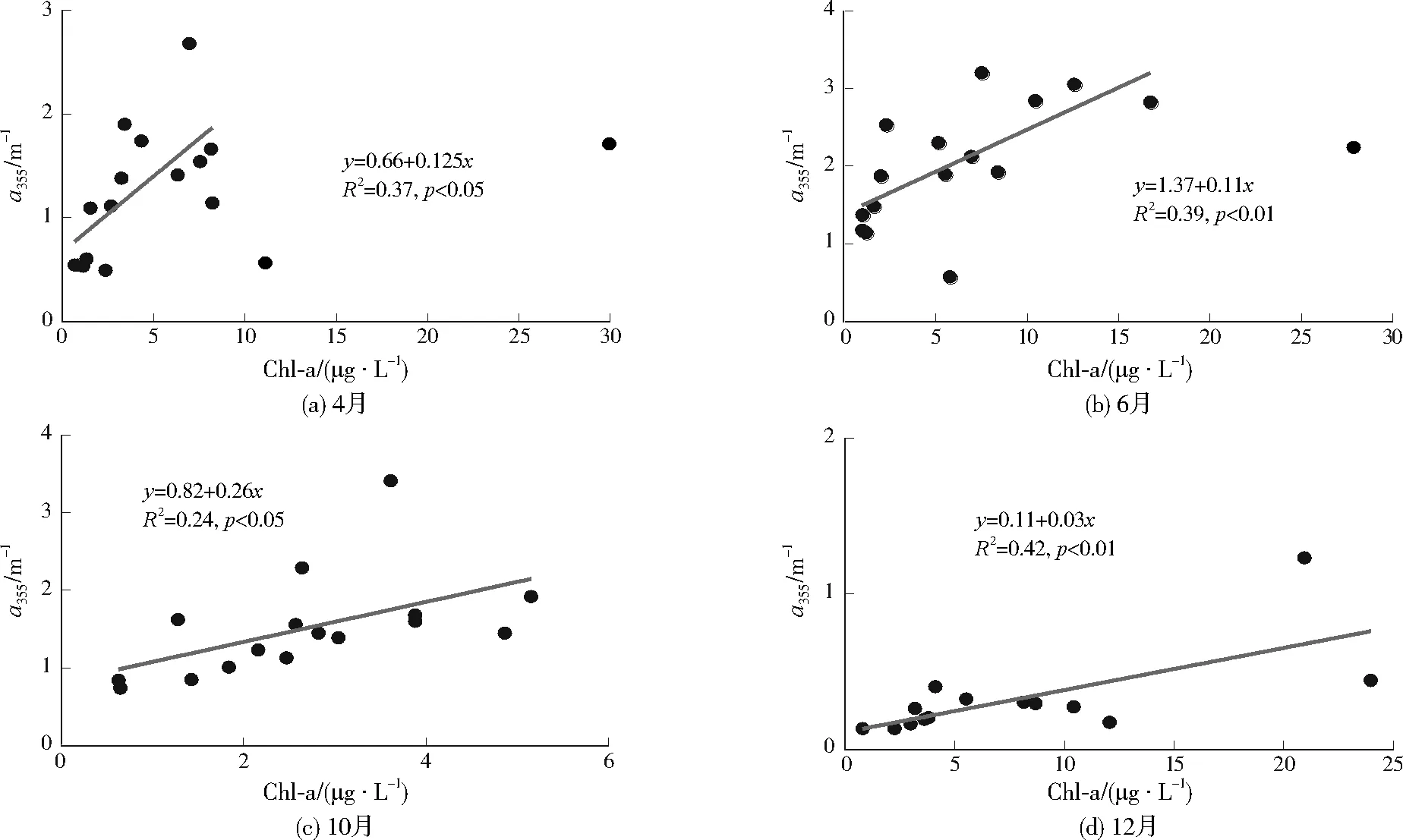
圖3 a355與Chl-a質量濃度的關系Fig.3 Correlations between a355 and Chl-a mass concentration
將水質理化參數與熒光參數作為逐步回歸方程的自變量,建立與a533及熒光組分的回歸方程,結果見表2。共篩選出3個對a355有顯著影響的限制因子,分別為SUVA254、DOC和C3,且都為正相關。在河口與海洋研究中,眾多結果觀測到CDOM的吸收系數與DOC濃度之間存在著較強的線性正相關,并據此建立線性模型反演DOC濃度[34-35]。雖然DOC作為第2限制因子入選回歸方程,本研究中并未發現DOC和a355間存在明顯相關性(p>0.05),這可能和無色DOM組分在DOM中所占比例較不穩定有關[36]。通常,來自河流攜帶的陸源物質含有更多的CDOM,而浮游植物釋放的有機質含有更多的無色DOM。其一,南苕溪位于上游源頭,生長著大量附著在河床底部礫石上的生物膜,其中的微生物作用使有機質礦化或分解成小分子無色DOM,還可以將無色DOM轉化為CDOM,從而使得a355與DOC濃度相關性明顯下降。其二,紫外輻射的光降解也是無色DOM增多的原因,尤其是夏季到達水面的紫外輻射較強,CDOM吸收紫外輻射后產生光降解將喪失顏色,增加無色DOM成分。其三,南苕溪不同支流DOM受農業經營活動、城市生活污水及工業廢水等不同陸源輸入的影響,使非熒光物質在DOM中所占的比例存在差異,也是導致DOC與a355之間相關性較差的原因。
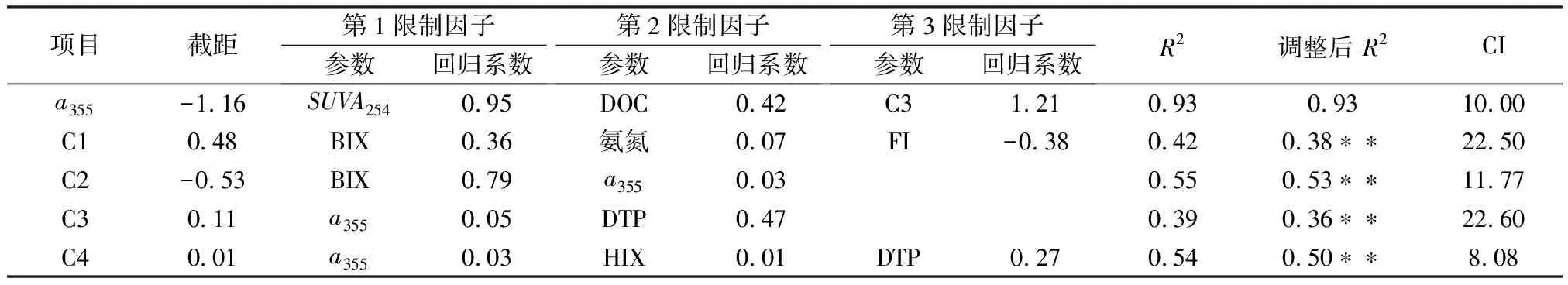
表2 a355及熒光組分的多元回歸方程1)
BIX作為第1限制因子入選兩類類蛋白(C1、C2)組分的回歸方程,且氨氮作為第2限制因子入選C1組分的回歸方程。可見,除了藻類生產來源外,生活、工業和農業污水的輸入同樣是南苕溪水體中類蛋白組分的重要來源。來源于污水的DOM中通常含有大量由微生物活動產生的類蛋白物質,通過對類蛋白物質的追蹤有助于了解污水對受污染河流的影響[37]。在英格蘭城市河流兩次污染事件中,均觀測到河水中類蛋白熒光與氨氮呈顯著正相關,并出現同時劇烈增加的現象。對污染物進行追蹤后,這種現象被認為是由未經處理的污水直接排入河道導致的[38]。
a355和DTP均作為限制因子入選兩類類腐殖質(C3、C4)組分的回歸方程。普遍認為磷在土壤中易被固定吸持,而且難以向水體遷移[39]。但陸源DOM的存在能夠明顯改變土壤中磷的行為,阻礙土壤對磷的吸附,并導致土壤徑流液中磷的含量顯著增加[40]。陸源DOM主要由陸地的植物凋落物、富含有機質的土壤降解產物和外源有機物料組成,含有大量的功能基團且具有較高的化學活性,對Fe、Al、Ca、Zn和Mg等金屬離子有著很強的親和力,能夠形成DOM-金屬-磷絡合物,在增加金屬離子水溶性和遷移能力的基礎上降低了金屬離子對磷的固定作用[41]。此外,陸源DOM還可以直接與磷酸根競爭土壤表面吸附位或與磷酸根發生絡合、溶解作用,進而增強了土壤中磷的遷移能力和生物有效性。因此在陸源DOM豐富的地區,土壤磷的淋失和遷移風險會明顯提高,進而對藻類的生長產生影響。
3 結 論
南苕溪DOM主要由兩個類蛋白組分和兩個類腐殖質組分組成,具有內源生產和外源輸入的雙重特征,且以內源生產為主,外源輸入為輔。DOM的熒光特征表現為新近自生源特征更加明顯,腐殖化程度較低;研究區雨熱同期,水溫高的時期,DOM的外源輸入過程也越強,而外源DOM的輸入會刺激微生物活動,從而消耗水體中的DO;在高溫或富氧環境下,水域中微生物的活性較強,DOM的內源生產過程有所增強;盡管Chl-a濃度較低,浮游植物殘體腐爛降解的產物是水體中CDOM的重要來源。
BIX和氨氮濃度能夠較好地表征類蛋白組分,說明除了藻類生產來源外,生活、工業和農業污水的輸入同樣是南苕溪水體中類蛋白組分的重要來源。而a355和DTP濃度能夠較好地表征類腐殖質組分,表明在陸源DOM豐富的地區,磷素的淋失和遷移風險會明顯提高。

