胸主動脈腔內修復術聯合體外開窗技術治療累及主動脈弓的復雜胸主動脈疾病
張 濤, 紀東華, 王 峰
Dake 等[1]1994年報道單純血管腔內治療胸主動脈病變以來, 胸主動脈腔內修復術(thoracic endovascular aortic repair,TEVAR)已廣泛應用于臨床。 TEVAR 與傳統開放手術相比具有創傷小、死亡率低、并發癥發生率低等優點[2-3]。 但某些累及主動脈Z0~Z3 區的復雜胸主動脈病變,仍是目前腔內治療重點和難點。 支架體外開窗技術作為治療方法之一, 最初于1999年報道應用于近腎腹主動脈瘤腔內修復術重建內臟分支動脈[4-5],盡管經過20 余年手術技術和器材進步,完全腔內重建弓上分支血流仍處于探索階段。 本文回顧性總結單中心采用TEVAR 聯合體外開窗技術治療累及主動脈弓的復雜主動脈疾病患者的初步經驗,探討該手術的可行性、安全性和有效性。
1 材料與方法
1.1 一般資料
收集2017年2月至2019年11月大連醫科大學附屬第一醫院在TEVAR 術中采用體外開窗技術治療的15 例累及主動脈弓的復雜胸主動脈疾病患者臨床資料。 其中3 例為胸主動脈瘤,2 例為胸主動脈瘤伴發腹主動脈瘤,1 例為胸主動脈瘤伴發主動脈夾層,4 例為主動脈壁間血腫伴發穿透性潰瘍,4例為主動脈夾層,1 例為TEVAR 術后支架近端Ⅰ型內漏。患者基本資料見表1。所有患者術前均接受主動脈全程+股動脈近段CTA 檢查, 詳細評估病變形態、近遠端錨定區長度、主動脈解剖特征與變異、主動脈鈣化和附壁血栓等情況,以及是否有合適入路。排除標準:①近端錨定區直徑>42 mm;②病變累及主動脈弓大彎側;③無合適主體支架入路;④難以耐受全身麻醉和手術。 患者和/或家屬術前均得到關于手術流程、手術相關風險和獲益、支架移植物改造和超適應證應用以及目前標準治療方案的充分解釋,并簽署知情同意書。

表1 患者基本資料
1.2 開窗支架制備
CTA 明確主動脈弓大彎側中心線作為弓上分支動脈開口定位基線,以此確定開窗位置。 支架輸送系統操縱柄遠端明確標記點,體外部分釋放主體覆膜支架,充分展開前段需開窗部分并適當向后延伸1~2 節段,期間標記點始終保持垂直向上,與此點同一直線視為主動脈弓大彎側中心線,支架近端開窗部位可以此為定位基線。 根據術前影像學測量結果標記開窗位置,手術刀破膜并修剪適當窗口大小。 完全原位回裝改制后的覆膜支架送入輸送系統內,并注水充分排氣。
1.3 手術方法
全身麻醉生效后,左肱動脈穿刺置入5 F 短鞘,Pigtail 導管送達升主動脈,造影明確病變范圍、主動脈弓上分支開口情況;股總動脈穿刺置入6 F 短鞘,預置兩把ProGlide 血管縫合器(美國Abbott 公司),通過真腔送入標記Pigtail 導管于升主動脈并沿途造影證實,根據術前影像學資料調整至主動脈弓切線位造影,精確測量各項數據,主動脈、弓上分支開口及病變輪廓于透視屏幕上用馬克筆標記,交換入Lunderquist 導絲于升主動脈;全身肝素化(75 U/kg),沿Lunderquist 導絲推送開窗主體支架至計劃釋放區域,推送過程中助手固定操縱柄,保證標記點始終垂直向下;收縮壓降至90 mmHg(1 mmHg=0.133 kPa),開窗支架精確對位并勻速釋放,完全釋放后打開前端后釋放裝置;再次造影,評估各重建分支血流情況和病變隔絕情況,視分支血流和病變隔絕情況決定是否采取主動脈支架遠端覆膜支架銜接、分支支架植入等措施,或隨診觀察,或二期處理;收緊縫線,穿刺點壓迫止血,送回普通病房或重癥監護病房。
1.4 技術成功定義、術后處理和隨訪
技術成功:術后即刻造影顯示病變區域隔絕滿意,無明顯內漏;重建的弓上分支血管血流通過速度滿意,分支開口無明顯狹窄。 術后常規給予抗生素抗感染,針對分支支架給予低分子肝素皮下注射(1 次/12 h)并過渡至口服抗血小板藥物。 術后7~30 d、3 個月、6 個月、1年及此后每年復查主動脈CTA。 門診或電話隨訪內漏、分支是否通暢、支架位置等。
2 結果
15 例患者中, 主體開窗支架近端植于主動脈Z0 區5 例,Z1 區5 例,Z2 區5 例。 開窗所用主體支架15枚均選用Valiant (Captivia 輸送系統, 美 國Medtronic 公司),1 例加用Endurant 髂支延長段(美國Medtronic 公司)。 覆膜支架單開窗9 例,雙開窗4例,三開窗2 例。 總計重建26 條分支血管,其中無名動脈(innominate artery,IA)3 條、左頸總動脈(left common carotid artery,LCCA)8 條、 左鎖骨下動脈(left subclavian artery,LSA)11 條、迷走右鎖骨下動脈(aberrant right subclavian artery,ARSA )2 條及IA、LCCA 共干各1 條;人工遮蓋LSA 4 條。 4 例患者8條分支血管植入分支支架。 術后所有重建分支血管即刻造影顯示血流通暢,技術成功率100%。 手術相關資料見表2, 典型病例見圖1。 圍術期死亡2 例(13.3%):1 例胸主動脈瘤伴主動脈夾層患者術后1周于家中猝死,考慮夾層進展或肺栓塞所致;1 例胸主動脈瘤伴腹主動脈瘤患者術后2 周肺部重癥感染死亡。 無缺血性腦卒中、截癱等嚴重并發癥。
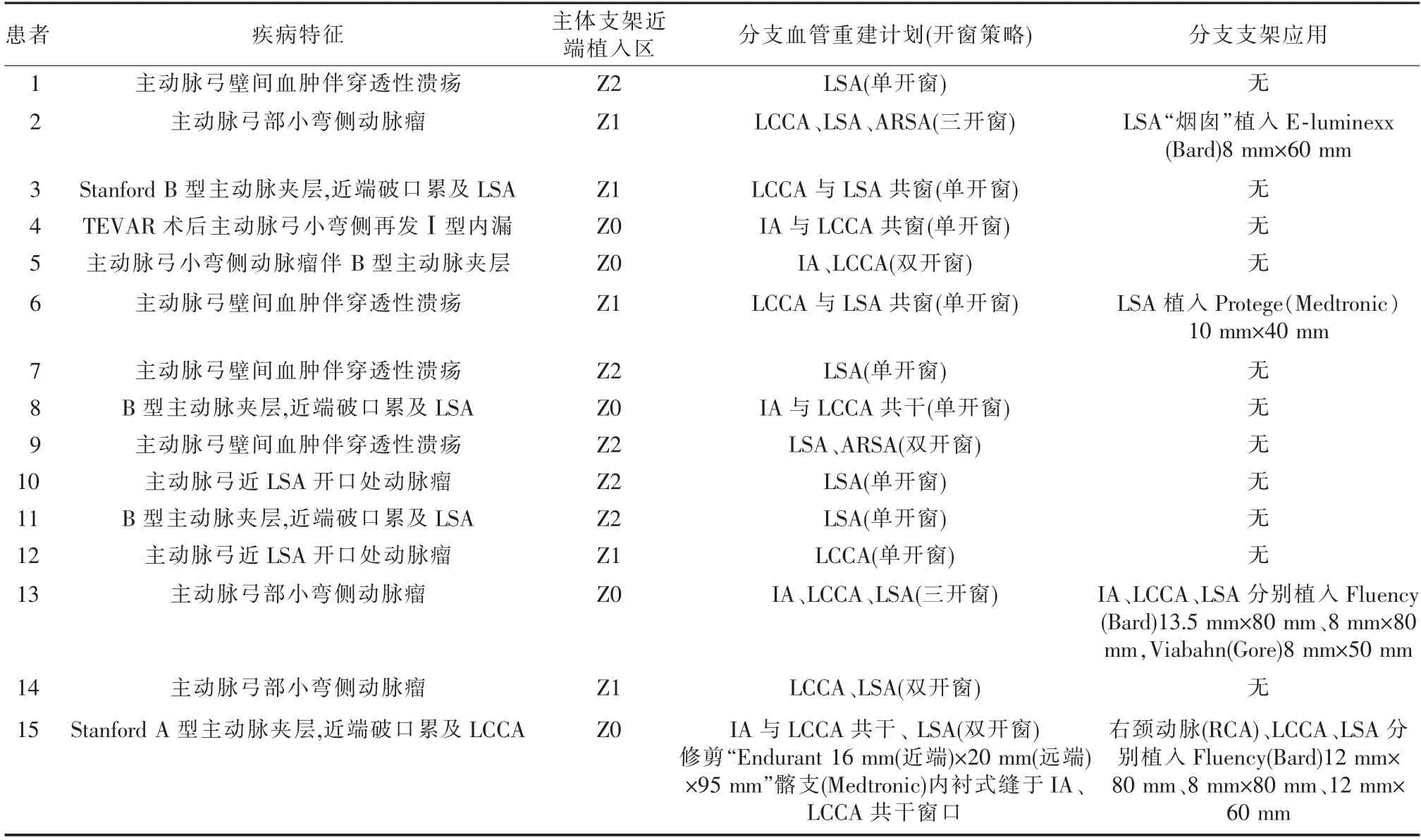
表2 手術相關資料

圖1 TEVAR 結合體外開窗技術治療主動脈弓部動脈瘤影像
中位隨訪時間24 個月(2~37 個月)。 失訪2 例(3 條分支血管)。 術后2 個月1 例出現LSA 開口狹窄,無左上肢缺血和腦缺血癥狀,予隨診觀察。 2 例(13.3%)見少許內漏,均在隨訪中內漏減少。 2 例死亡,其中1 例TEVAR 術后支架近端再發Ⅰ型內漏,術后8 個月死亡,死因不明,1 例胸主動脈瘤術后2個月新發急性Stanford B 型夾層并接受TEVAR 術,死于多臟器衰竭。
3 討論
傳統開放手術治療主動脈病變創傷大、 死亡率高,體外循環、低溫停循環等技術相關并發癥較多[2-3,6]。 復合手術作為一種新型治療方式,有手術時間短、創傷小、再干預率低等優點,但國內可開展此類手術的高級中心較少,也面臨神經系統并發癥發生率高、圍術期死亡率高等問題[6],需要遠期研究數據支持。 隨著腔內手術技術和器材不斷進步,胸主動脈疾病腔內治療適應證不斷擴大。 但對于累及主動脈弓上分支血管的主動脈病變, 傳統TEVAR 術面對錨定區不足需遮蓋弓上分支血管等難題,無法滿足治療需要。有文獻報道認為,54%內膜第一破口距離LSA 較近,使TEVAR 需要15~25 mm 近端錨定區的要求受限[7],所有接受TEVAR 患者中40%~50%需要重建弓上分支血流, 以獲得足夠長度的健康錨定區[8],弓上分支血管的處理則是當前的重點與難點。 綜上,此類病變腔內治療的關鍵,在于既要有足夠的健康錨定區隔絕病變,又要良好地重建弓上血流。 體外開窗技術可以解決此類傳統TEVAR 術難題,多項研究早期結果證明,該技術安全可行[9-12]。
本研究采用的體外開窗技術并非弓上血流重建的唯一微創治療策略,分支型支架移植物、原位開窗技術、平行支架技術(“煙囪” 技術、“潛望鏡” 技術等)、多層裸支架技術等也是目前腔內治療選擇[11-12]。 定制分支支架需要生產周期,術前準備時間長,價格較為昂貴,無法應用于急診情況,國內目前難以普及;原位開窗技術需要激光等特殊器材破膜,破膜時人工封堵弓上血管及應用腦血流保護裝置,可增加神經系統并發癥發生率,也有脫落覆膜致遠端動脈栓塞等風險;平行支架技術操作簡單、學習曲線短,受到國內外研究一致好評,有文獻報道其一期內漏發生率為21.6%,近期療效較好,中遠期療效不確定[13]。 體外開窗技術與其他技術相比,優點在于:①個體化支架制備簡單,現有商品覆膜支架即可滿足,可應對急診情況;②使更多累及主動脈弓甚至升主動脈、近端錨定區條件較差等復雜、高危患者,得到腔內治療機會;③支架應用數量較少,減少患者經濟負擔。 體外開窗技術應用存在一定難度,成功的關鍵在于窗口與分支血管能否良好對位,不僅需要術前、術中精確的影像學測量,還需要合理選擇支架移植物、主體支架入路等。
本組患者術前均接受主動脈全程+股動脈近段CTA 檢查,掃描層厚達到1 mm,甚至0.5 mm,并通過3D 工作站精確、標準測量主動脈內徑、形態,病變累及范圍,入路迂曲程度等。 本研究建議圖像刻錄光盤備用, 有條件可通過3D 打印主動脈模型輔助評估,術中主動脈造影若與術前影像學資料存在偏差,則以造影為 “金標準”。 術后CTA 隨訪評估手術效果,如有無內漏及重建分支通暢率等。
術中開窗支架制備取決于精準的影像學測量,窗口選擇較大口徑可提高窗口對位不準的容錯率,但可能會導致窗口處發生內漏,且較大部分移除覆膜會損害覆膜支架的整體結構,導致支架結構不穩定, 甚至在收回釋放系統時發生金屬結構相互嵌頓。 陸清聲[14]研究認為,夾層病變、小彎側病變可予開大窗,利于保持分支動脈通暢、避免分支支架植入;大彎側病變或動脈瘤適合開小窗,利于預防內漏及避免遠期移位。 本組4 例患者(8 條分支血管)接受2 支血管 “共窗”,其中1 例(患者13)胸主動脈瘤近LSA 開口,予三開窗重建IA、LCCA、LSA,開窗支架釋放后造影顯示IA、LCCA 經覆膜支架第1 窗口顯影,LSA 經瘤體供血顯影, 予以補救措施:IA、LCCA 分別植入覆膜分支支架, 近端第1 窗口進入主動脈,LSA 超選入第2 窗口植入覆膜分支支架,另植入主動脈覆膜支架隔絕瘤腔及封堵開窗支架第3 窗口,后球囊擴張各分支支架,造影示少許內漏,弓上各分支顯影良好(圖2)。 窗口對位不準的補救措施,應根據術者經驗靈活應用。 至于雙開窗還是三開窗,應根據術前、術中精確測量,第1 開窗對位精準,其余窗口皆可精準對位;建議由經驗較多的醫師行多開窗手術。
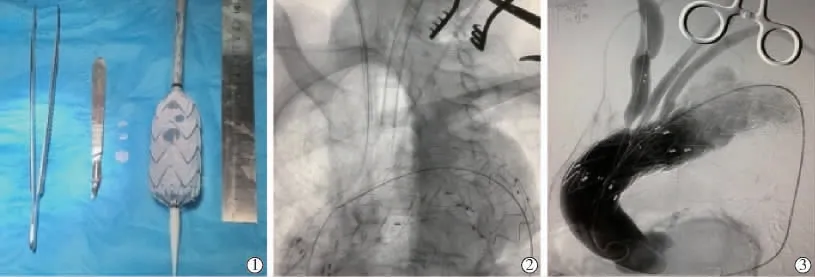
圖2 術中主動脈支架定位誤差及補救措施
本組1 例主動脈夾層患者(患者15)破口緊鄰LCCA 開口,為避免內漏、保持分支血管通暢,制備IA 和LCCA 共干、LSA 雙開窗支架, 并體外修剪Endurant 16 mm(近端)×20 mm(遠端)×95 mm” 髂支呈 “兩分支” 式人工血管,內襯式縫于IA 和LCCA共干窗口, 兩分支前端懸于主體開窗支架內前方;術后造影顯示病變隔絕良好,無內漏形成,各分支動脈血流通暢(圖3)。 此為體外開窗技術的拓展應用,不失為一種個體化的合適選擇。
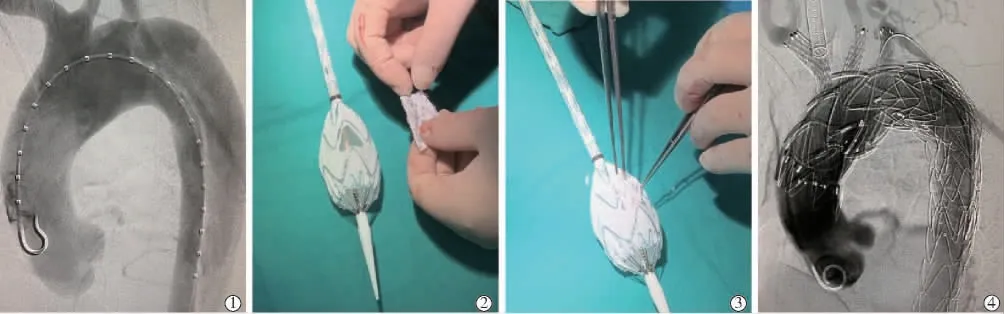
圖3 體外開窗和縫制分支支架技術
本組15 例患者中4 例(26.7%)人工遮蓋LSA。Buth 等[15]研究認為TEVAR 圍術期截癱或脊髓損傷與LSA 遮蓋顯著相關。 Cooper 等[16]研究 認 為遮 蓋LSA 可能會提高截癱發生率,但預防性LSA 重建對腦血管意外無保護作用。 臨床實踐中面臨的問題是,為減少Ⅰ型內漏,能否選擇性覆蓋LSA。 本研究經驗認為, 患者病變個體化較強, 術前通過考量Willis 環完整性、 評估缺血性腦卒中風險權衡風險與獲益,如病變距LSA 較近、非左椎動脈優勢供血、缺血性腦卒中風險較低, 可選擇性覆蓋LSA。 該4例LSA 覆蓋患者,術后隨訪均未發生截癱和缺血性腦卒中。
本研究局限性為樣本量較小、 由單中心實施,患者主動脈病變多樣性, 分支血管重建方式多樣性,隨訪時間較短,無其他技術作為對照組。 但本研究認為體外開窗技術提供了一種新的治療策略,具有支架易得、個體化開窗支架制作相對簡單、可滿足急診手術需要等優點。 替代開放手術或復合手術的單純腔內手術治療錨定區位于Z0 區或更近端的復雜主動脈病變,既往已有報道[17]。 但國內外對此類手術尚未達成共識。 隨著手術技術和器材進步,可能逐漸放寬主動脈夾層腔內治療適應證。 腔內治療雖然存在再次干預風險, 但可避免開放手術,讓更多累及主動脈弓部,甚至升主動脈的復雜型胸主動脈疾病患者受益。
本研究采用的弓上血流重建技術,均為現有腔內器材超適應證應用,尚需要進一步器材革新和更大規模研究加以證實和評估。 由于胸主動脈疾病患者個體化較強,應靈活選擇或聯合各種技術,完全攻克主動脈弓部病變仍需進一步研究。
本研究結論認為,TEVAR 體外開窗技術治療累及主動脈弓的復雜主動脈疾病可行、 安全有效,近期效果滿意。 但缺乏大樣本遠期研究及與其他技術,或聯合其他技術隨機對照研究。

