BMP-9在膽道閉鎖肝纖維化中的作用機制研究
葛亮 ,茍慶云,趙金鳳 ,張聰,陳靈芝 ,胡曉麗 ,詹江華
膽道閉鎖(biliary atresia,BA)是嬰兒期嚴重的肝膽系統疾病,以肝內、外膽管進行性炎癥和纖維性梗阻為特征,繼而導致膽汁淤積、肝纖維化和肝硬化。國內外研究表明進行性肝纖維化是影響肝門-空腸吻合術(Kasai 手術)預后的關鍵因素[1-3]。如何有效阻斷肝纖維化進展是目前亟需解決的問題。研究表明轉化生長因子β(TGF-β)/SMAD 信號通路在BA 肝纖維化中發揮了重要作用[4]。骨形態發生蛋白 9(bone morphogenetic protein 9,BMP-9)屬 于TGF-β超家族成員,參與調節多種生物功能,包括鐵離子平衡、軟骨形成、血管生成、神經元分化及脂質代謝等。此外,研究表明BMP-9具有促進肝纖維化的作用[5]。但 BMP-9 在 BA 肝組織中的表達情況尚不明確。本研究檢測了BMP-9 及其下游通路蛋白/基因在BA肝組織中的表達情況,并通過細胞實驗探討其促進纖維化進程的作用機制。
1 材料與方法
1.1 材料 采用簡單隨機法抽取天津市兒童醫院2018 年1 月—2019 年 1 月收治的 14 例 BA 患兒 Kasai 手術時肝組織標本為 BA 組,其中男 6 例,女 8 例,手術日齡 40~82 d,平均(67±11)d。BA 診斷標準:手術探查及術中膽道造影確診為Ⅲ型膽道閉鎖。簡單隨機法抽取同期5 例膽總管囊腫(congenital biliary dilatation,CBD)患兒手術時肝組織標本為CBD組,其中男2例,女3例,手術日齡287~752 d,平均(479±181)d。CBD 診斷標準:術前根據腹部超聲及磁共振檢查確診。肝組織標本均取自術中肝右葉前緣組織,10%福爾馬林溶液固定,用于HE、免疫組織化學染色;部分新鮮肝組織獲取后放置無菌EP 管中,-80 ℃冰箱內保存,用于實時熒光定量逆轉錄聚合酶鏈反應(qPCR)檢測。LX-2 人肝星狀細胞(341818)購自BNCC 公司。DMEM 高糖培養液購自江蘇凱基生物技術股份有限公司;SYBR Green 購自北京全式金生物技術有限公司;NP-40 蛋白裂解液、PMSF 蛋白酶抑制劑、BCA 蛋白濃度測定試劑盒均購自天根生化科技有限公司;RNA 提取試劑盒購自Omega;逆轉錄試劑盒(B532435)購自生工生物工程有限公司;人重組BMP9(rBMP-9,3209-BP)購自R&D systems;人重組TGF-β1(r-TGF-β1)、兔抗人單克隆BMP-9 抗體(bs-6909R)、鼠抗人單克隆磷酸化SMAD1/5(p-SMAD1/5)抗體(bs-3418R)、DNA結合抑制因子1(inhibitor of DNA binding 1,ID1)抗體(bs-3529R)、α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)重組兔單克隆抗體、辣根過氧化物酶標記的山羊抗兔IgG 聚合物均購自北京博奧森生物技術有限公司;SMAD1/5抗體購自 Cell Signaling Technologies;β-actin 抗體(A01010)購自Abbkine。普通光學顯微鏡購自Olympus公司;臺式高速低溫離心機購自Thermo 公司;LightCycler 96 qPCR 儀購自Roche公司;Tanon5200 全自動數碼凝膠成像系統購自上海滬析實業有限公司。
1.2 方法
1.2.1 肝纖維化程度評估 BA 組及CBD 組患兒HE 染色的病理切片由我院專業病理科醫師在光學顯微鏡下進行肝纖維化分級,參照METAVIR分級標準[6]。0級:無纖維化;1級:匯管區纖維性擴大,無間隔;2級:匯管區纖維性擴大,少量間隔;3級:大量間隔伴結構紊亂,無肝硬化;4級:肝硬化。本研究將1級和2級定義為輕度肝纖維化;將3級和4級定義為重度肝纖維化。
1.2.2 免疫組織化學染色檢測肝組織中BMP-9、p-SMAD1/5的表達情況 病理切片脫蠟至水,枸櫞酸鹽緩沖液進行抗原修復15 min,冷卻至室溫,PBS 緩沖液沖洗5 min×3 次,于3%H2O237 ℃中孵育10 min,再用PBS沖洗5 min×3次,滴加一抗(BMP-9、p-SMAD1/5),于冰箱中4 ℃過夜,次日取出置于室溫,PBS 洗 5 min×3 次,加二抗于 37 ℃下孵育 30 min,PBS 洗5 min×3 次,經DAB 顯色5~10 min,鏡下觀察染色情況,充分水洗,蘇木素液染核,脫水、透明、中性樹膠封片,于低倍鏡(×100)下觀察染色(棕色)區域,高倍鏡(×200)下辨別陽性細胞種類及表達情況。定性分析:根據染色強度分為無棕黃色(陰性)、淡棕黃色(弱陽性)、棕黃色(陽性)、棕褐色(強陽性)。半定量分析:每張切片陽性部位處取5個不同視野100倍顯微鏡下圖片,經IPP(Image pro-plus)5.0 分析圖片,計算BMP-9 及p-SMAD1/5 蛋白的平均光密度值(AOD),AOD=肝組織陽性細胞光密度總和/陽性面積。
1.2.3 qPCR檢測患兒肝組織中BMP-9 及ID1 mRNA的表達情況 經Trizol 法提取人肝組織總RNA,使用酶標儀檢測總RNA濃度。按照逆轉錄試劑盒說明,取500 ng RNA進行10 μL體系逆轉錄。將獲得cDNA 稀釋10 倍,用PCR 反應體系在Light Cycler 96實時熒光定量PCR儀上得出Ct值。實驗條件為:預變性95 ℃ 180 s;95 ℃ 30 s,57 ℃ 15 s,72 ℃ 15 s,40個循環;熔解95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。采用 2-ΔΔCt法計算每組樣品中mRNA相對表達量。實驗所用引物序列見表1。

Tab.1 Sequence of primers for qPCR表1 qPCR引物序列
1.2.4 LX-2 細胞培養及分組 將人肝星狀細胞LX-2 置于37 ℃恒溫,5%CO2條件下用DMEM 高糖培養液培養,加入10%胎牛血清、1%雙抗(100 U/mL 青霉素/鏈霉素),0.3%胰酶消化傳代。分組干預方法:(1)空白對照組(正常培養的LX-2 細胞)、BMP-9 組(加入100 μg/L rBMP-9)、TGF-β1 組(加入50 μg/L rTGF-β1)、BMP-9+TGF-β1 組(同時加入100 μg/L rBMP-9 及50 μg/L rTGF-β1)。(2)根據加入rBMP-9 含量不同分為0、10、50及100 μg/L組。
1.2.5 蛋白印跡法檢測LX-2 細胞中SMAD1/5、p-SMAD1/5、ID1、α-SMA 蛋白表達情況 細胞加入適量RIPA 裂解液重懸,裂解液中含有1×Cock Tai(l蛋白酶抑制劑混合物),反復吹打幾次混合均勻,在冰上靜置10 min,4 ℃,12 000 r/min離心10 min,取上清于新的離心管中獲得總蛋白。用BCA蛋白濃度測定試劑盒定量提取總蛋白,細胞經1×loading buffer提取總蛋白。將獲得的蛋白進行SDS-PAGE,濕轉法將蛋白轉移至PVDF膜上(250 mA恒流90 min),封閉液孵育70 min,4 ℃一抗 α-SMA(1∶1 000)、ID1(1∶1 000)、SMAD1/5(1∶1 000)、p-SMAD1/5(1∶1 000)、β-actin(1∶10 000)孵育過夜,洗膜后37 ℃孵育二抗(1∶5 000)50 min,采用ECL化學發光法顯色。通過數字圖像處理系統獲得Western blot圖像。以β-actin為對照內參,目的蛋白/內參蛋白的灰度值作為蛋白的相對表達量。
1.2.6 qPCR 檢測 LX-2 細胞中 α-SMA和 ID1 mRNA 的表達情況 經RNA提取試劑盒提取細胞總RNA。嚴格按照試劑盒說明書進行操作,使用酶標儀檢測總RNA濃度。按照逆轉錄試劑盒說明,取500 ng RNA進行10 μL體系逆轉錄。將獲得 cDNA 稀釋 10 倍,用 PCR 反應體系在 Light Cycler 96 qPCR儀上得出Ct 值。反應條件同1.2.3。實驗所用引物序列見表1。
1.3 統計學方法 采用SPSS 22.0 軟件及Graphpad prism 8軟件進行統計分析。計量資料數據以表示,2組間比較采用t檢驗,多組間比較采用單因素方差分析,組間多重比較采用Tukey 檢驗;細胞水平各項實驗均重復3 次,以P<0.05 為差異有統計學意義。
2 結果
2.1 肝纖維化程度評估結果 5例CBD患兒肝組織中鏡下肝小葉結構存在,匯管區無增寬,膽管及纖維組織無增生,可見少量炎性細胞浸潤,肝纖維化均為0級。14例BA患兒肝組織中可見匯管區增寬,膽管增生,纖維組織增生、橋接纖維化現象普遍,部分患兒可見假小葉形成,伴炎性細胞浸潤,其中輕度肝纖維化8例,重度肝纖維化6例,見圖1。
2.2 肝組織中BMP-9、p-SMAD1/5蛋白的表達情況
2.2.1 免疫組化定性分析 BMP-9、p-SMAD1/5 在CBD 患兒肝組織中肝細胞、匯管區膽管上皮細胞及血管內皮細胞呈弱陽性表達;在輕度肝纖維化BA患兒肝組織中肝細胞、膽管上皮細胞及血管內皮細胞呈陽性表達;在重度肝纖維化BA患兒中膽管上皮細胞、肝細胞及血管內皮細胞呈強陽性表達,見圖2。

Fig.1 HE staining of liver tissue in CBD and BA groups(×40)圖1 CBD、BA組肝組織HE染色情況(×40)
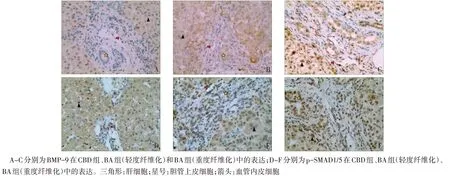
Fig.2 The expression of BMP-9 and p-SMAD1/5 in liver tissues(IHC,×200)圖2 BMP-9、p-SMAD1/5在肝臟組織中的表達情況(免疫組化,×200)
2.2.2 免疫組化半定量分析 BA 組患兒肝組織中BMP-9 及 p-SMAD1/5 表 達水平 均 高于 CBD 組(BMP-9:0.154±0.028vs.0.120±0.016,t=2.555;p-SMAD1/5:0.151±0.017vs.0.129±0.018,t=2.317;均P<0.05)。重度肝纖維化患兒BMP-9 的表達高于輕度肝纖維化患兒(0.172±0.026vs.0.141±0.023,t=2.335,P<0.05);而p-SMAD1/5 在輕度與重度肝纖維化患兒中的表達差異無統計學意義(0.154±0.019vs.0.148±0.017,t=0.573,P>0.05)。
2.3 肝組織中BMP-9 及ID1 mRNA 表達水平 BA組 BMP-9 mRNA 表達水平高于 CBD 組(7.011±3.867vs. 1.000±0.370,t=3.282,P<0.01);重度肝纖維化患兒BMP-9 mRNA 表達高于輕度肝纖維化患兒(2.569±0.522vs. 1.000±0.480,t=7.379,P<0.01)。BA 組 ID1 mRNA 表達高于 CBD 組(2.456±0.973vs.1.000±0.365,t=3.088,P<0.01);重度肝纖維化患兒ID1 mRNA 表達高于輕度肝纖維化患兒(1.759±0.442vs.1.000±0.298,t=3.547,P<0.01)。
2.4 LX-2細胞α-SMA表達情況 BMP-9組、TGF-β1 組和 BMP-9+TGF-β1 組 LX-2 細胞中 α-SMA 蛋白表達均較空白對照組升高(n=3,F=544.100,P<0.05),見圖 3。BMP-9 組、TGF-β1 組和 BMP-9+TGF-β1 組 LX-2 細胞中 α-SMA mRNA 表達水平分別為 2.037±0.124、3.108±0.275 和 3.506±0.484 均較空白對照組(1.000±0.140)升高(n=3,F=29.450,P<0.01)。
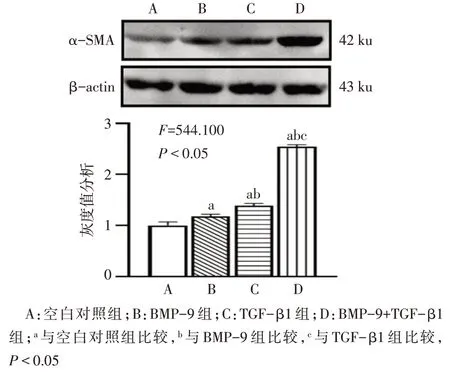
Fig.3 The expression of α-SMA after treatment with rBMP-9(and/or rTGF-β1)圖3 rBMP-9和(或)rTGF-β1處理后細胞α-SMA表達情況
2.5 不同濃度rBMP-9干預后LX-2細胞SMAD/ID1信號通路蛋白和ID1、α-SMA mRNA 表達情況 將LX-2 細胞加入不同劑量rBMP-9 后,其下游信號蛋白 p-SMAD1/5、SMAD1/5、ID1 及 α-SMA 表達增多,ID1及α-SMA mRNA 表達水平增加(P<0.05),見圖4、表2。
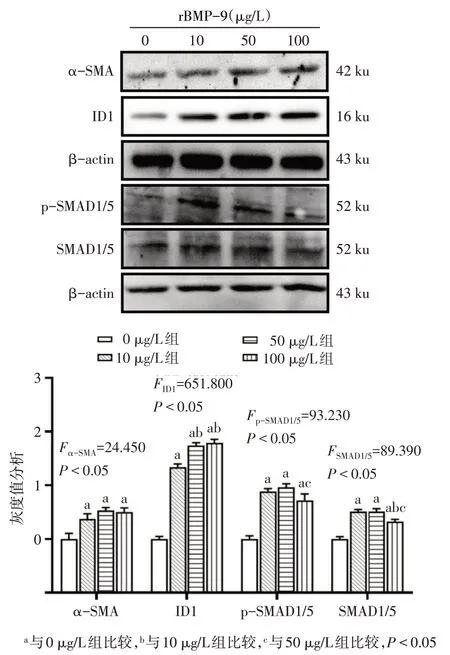
Fig.4 The expression of proteins in SMAD/ID1 signaling pathway after treatment with different doses of rBMP-9圖4 不同劑量rBMP-9處理后SMAD/ID1信號通路蛋白表達情況
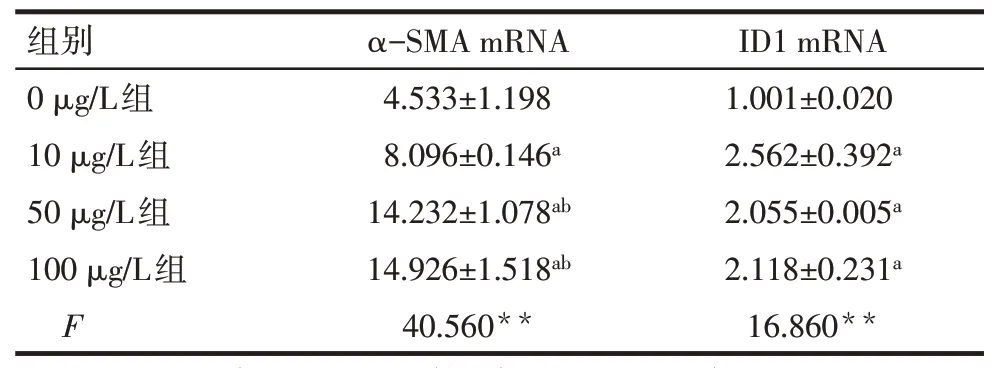
Tab.2 Comparison of ID1 and α-SMA mRNA expression levels after treatment with different doses of rBMP-9 between five groups表2 不同劑量rBMP-9處理后各組ID1及α-SMA mRNA表達水平比較
3 討論
BA肝纖維化進展迅速且不可逆,部分肝細胞和膽管上皮細胞發生上皮-間質轉分化(EMT)以及肝星狀細胞(HSC)被激活后轉化為肌成纖維細胞,分泌細胞外基質,促進肝纖維化發生發展。研究認為快速進展的肝纖維化與促纖維化通路密切相關,其中TGF-β1/SMAD 信號通路在BA 肝纖維化的發生發展過程中起到至關重要的作用[4]。BMP-9是從骨基質中提取的一組誘導異位軟骨及骨形成的細胞因子,屬于TGF-β 超家族成員,和TGF-β 信號通路中的配受體結合形式存在相似性。BMP-9 具有廣泛的生物學作用,包括影響細胞的增殖、分化和凋亡,參與組織的再生和修復等[7-8]。BMP-9 主要表達于肝臟,在健康人體中呈低表達狀態[9]。
3.1 BMP-9 參與BA 肝纖維化 本研究結果顯示,相較于CBD 組,BA 組患兒肝組織中BMP-9 及p-SMAD1/5 蛋白,BMP-9 及 ID1 mRNA 表達均顯著增加,而且在 BA 組中 BMP-9 蛋白、BMP-9 及 ID1 mRNA表達水平伴隨著肝纖維化程度加重呈增高趨勢。盡管p-SMAD1/5在BA 亞組間的表達無明顯差異,但是在重度肝纖維化肝組織的匯管區p-SMAD1/5具有強陽性表達。由此可見,BA 患兒肝組織中BMP-9/SMAD/ID1 信號通路蛋白表達水平增加,且與肝纖維化輕重程度有關。BMP-9主要通過SMAD途徑調節靶基因的轉錄和表達[10]。BMP-9 與Ⅰ型受體(ALK1、ALK2)和Ⅱ型受體(BMPR2、ActRⅡ)結合后,導致SMAD 1/5/8磷酸化,磷酸化的SMAD 1/5/8與SMAD 4 形成一個多聚肽復合物,并向細胞核遷移,與靶基因中的SMAD 反應元件結合并誘導基因表達。BMP-9在肝臟可表達于肝星狀細胞,隨著肝纖維化逐漸加重,BMP-9及其靶基因ID1表達增多,抑制BMP-9能夠延緩肝纖維化進展[5]。作為BMP-9的靶基因,ID1 在HSC 向成纖維細胞的轉化以及HSC的EMT中起重要作用[11]。HSC中ID1的缺失會影響α-SMA 的合成,表明ID1 在纖維化過程中起著至關重要的作用[12]。在肝纖維化過程中,BMP-9激活的ALK1 通過SMAD1 途徑激活靶基因ID1,從而誘導HSC 分化為成纖維細胞,產生細胞外基質蛋白[13]。結合本研究結果及相關研究,BMP-9參與BA肝纖維化的進程,其可能具有促進BA肝纖維化的作用。
3.2 BMP-9通過SMAD1/5-ID1通路促進LX-2纖維化 本研究以rTGF-β1 處理LX-2 細胞后,α-SMA蛋白及mRNA表達含量較空白對照組明顯升高。以rBMP-9 處理 LX-2 細胞后,α-SMA 蛋白及 mRNA 表達含量也較空白對照組明顯升高。TGF-β1 是目前已知最強的促纖維化細胞因子之一[14]。TGF-β1/SMAD 通路在 BA 肝纖維化中起到了重要作用[15]。整合素蛋白ανβ6等因素激活TGF-β1配體,后者與受體結合誘導細胞內SMAD2/3 磷酸化,磷酸化的SMAD2/3 與SMAD4 形成絡合物,并向細胞核移動,啟動包括細胞外基質蛋白的基因轉錄,增加細胞外基質蛋白的表達,同時生成基質金屬蛋白酶組織抑制劑1(TIMP-1)及纖溶酶原激活物抑制劑1(PAI-1),抑制細胞外基質的降解[16-17]。本研究中TGF-β1 與BMP-9 表現出相似的功效,具有激活肝星狀細胞、促進纖維組織增生的作用,以不同劑量的rBMP-9干預LX-2 細胞后,其下游通路p-SMAD1/5、ID1、α-SMA蛋白,及ID1、α-SMA mRNA在細胞中的表達均較0 μg/L 組升高。BMP-9 可通過激活經典的SMAD/ID1信號通路觸發并激活肝星狀細胞,從而調節肝纖維化的進展。Li等[18]通過腺病毒介導的基因敲低技術證實攜帶BMP9-shRNA 的腺病毒可以減輕小鼠的肝纖維化。本研究結果表明BMP-9 可通過磷酸化SMAD1/5 誘導肝星狀細胞核內ID1 表達,導致細胞外基質α-SMA表達增高,促進纖維化進程。
綜上所述,在BA 患兒肝組織中BMP-9、p-SMAD1/5、ID1 表達水平較 CBD 患兒增加,且與肝纖維化程度有關。BA 患兒肝組織及細胞實驗結果提示BMP-9 可以通過SMAD/ID1 信號通路促進BA 肝纖維化進程。持續性肝纖維化是影響BA 患兒預后的關鍵因素,抑制BMP-9可能作為一個潛在的治療靶點,在一定程度上提高抗肝纖維化藥物的治療效果,從而延長BA患兒的自體肝生存時間。

