高血壓腦出血患者血清Adropin ZO-1水平變化及臨床意義
張 濱,孟 偉,高維軍,賈 軍
(遼寧省盤錦市中心醫院神經外科,遼寧 盤錦 124010)
高血壓腦出血發病急驟、病情進展迅速,致殘致死率高,發病后3個月內,超過1/3的患者出現神經功能損傷,2.5~17%的患者死亡[1]。早期明確診斷并通過手術清除血腫,解除顱內占位,能有效減輕神經功能損傷,提前預測患者預后并及時采取針對性干預措施,可降低病死率,改善預后。高血壓腦出血病理機制為長期高血壓引起腦內小動脈血管壁纖維素樣改變或者缺血壞死,血管壁強度降低呈局部擴張,形成微小動脈瘤,在各種內外環境誘因下血壓驟然升高,最終損傷血管內皮損細胞而出現血管滲血或破裂。Adropin是由Enho基因編碼的能量守恒調節因子,在人體中主要參與調控脂質和葡萄糖代謝,Adropin能抑制腫瘤壞死因子-α(TNF-α)等炎癥細胞因子的合成而起到保護血管內皮細胞的作用[2]。研究顯示[3],Adropin異常表達參與了冠心病、急性心肌梗死等心血管疾病發病過程。緊密粘連蛋白-1(zonula occludens-1,ZO-1)是主要在內皮細胞膜深層表達的緊密連接蛋白,參與維持血腦屏障結構的完整性,腦組織缺血缺氧破壞血腦屏障,ZO-1大量進入血液循環,因此,ZO-1可反映顱腦損傷[4]。本研究旨在探討兩指標與高血壓腦血管病情嚴重性及預后的關系,從而為指導臨床制定治療方案提供參考。現報道如下:
1 資料與方法
1.1一般資料:收集2017年3月至2020年3月我院收治的143例確診為高血壓腦出血患者為研究對象(病例組)。納入標準:①典型臨床癥狀體征如頭痛、嘔吐,伴有不同程度意識障礙,經顱腦影像學證實為高血壓腦出血,并符合《臨床診療指南》中關于高血壓腦出血的診斷標準[5];②高血壓史;③首次發病,且發病至入院時間<24h;④手術治療患者。排除標準:①妊娠期和哺乳期的女性患者;②心臟功能不全患者;③肝、腎功能障礙患者;④雙側腦疝以及腦干出血等;⑤顱腦內惡性腫瘤;⑥急、慢性炎癥反應性疾病和自身免疫性疾病患者;⑦其他惡性腫瘤患者;⑧其他代謝性疾病患者。其中男97例,女46例;年齡32~79歲,平均(56.12±8.39)歲;體質量指數(body mass index,BMI)22~27 kg/m2,平均(24.15±2.03)kg/m2;高血壓病程3~34年,平均(9.38±2.64)年;高血壓分級:I級38例,Ⅱ級50例,Ⅲ級55例;發病至入院時間3~23h,平均(18.90±5.16)h;出血部位:基底節49例,皮質37例,丘腦32例,小腦25例;出血量17~98mL,平均(33.09±8.12)mL;根據美國國立衛生研究院卒中量表(NIHSS)評分[6]分為輕型組69例(NIHSS評分1~14分),中型組43例(NIHSS評分15~20分),重型組31例(NIHSS評分21~42分);根據格拉斯哥預后評分(GOS)[7]分為預后良好組107例(GOS評分4~5分),預后不良組36例(GOS評分1~3分)。并于同期隨機選取71例健康體檢者為對照組,研究對象無心血管疾病、內分泌系統疾病等,近期未服用任何藥物,也無任何外傷史。其中男43例,女28例;年齡29~75歲,平均(54.79±8.85)歲;BMI 22~26kg/m2,平均(23.53±2.27)kg/m2。研究組和對照組基線資料比較無統計學差異(P>0.05),具有可比性。
1.2方法:抽取病例組患者入院時空腹肘靜脈血4mL,對照組于入院體檢當日清晨抽取,將血液標本置于含EDTA的抗凝試管中室溫下靜置50min,以3500r/min的轉速離心8min,離心半徑為13.5cm,留取血清標本在-30℃環境下保存,留待檢測。采用酶聯免疫吸附法檢測血清Adropin、ZO-1水平,其中Adropin試劑盒由武漢華美生物有限公司提供,ZO-1試劑盒由上海西唐生物科技有限公司提供,酶聯免疫檢測儀由美國Thermo Fisher Scientific公司提供。檢測過程嚴格參照試劑盒上說明進行。
1.3NIHSS評分、GOS評分標準:入院時采用NIHSS評分對患者神經功能缺損情況進行評價,包括意識、凝視、視野、面癱、上肢運動、下肢運動、共濟失調、感覺、語言、構音障礙、忽視癥等內容,總分為42分,評分與患者神經功能損傷缺損程度呈正相關,并根據患者NIHSS評分分級,1~14分為輕型,15~20分為中型,21~42分為重型[7]。采用GOS評分對患者預后情況進行評價,評分與預后呈負相關,并根據患者預后分級,4~5分為預后良好,1~3分為預后不良[8]。
1.4隨訪:治療后通過門診或電話等方式對患者進行隨訪,隨訪時間至少6個月,隨訪的內容主要是采用GOS評分對患者預后進行評價。
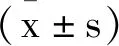
2 結 果
2.1病例組與對照組血清Adropin、ZO-1水平比較:與對照組比較,病例組血清Adropin水平減低,ZO-1水平升高,差異均有統計學意義(P<0.05),見表1。
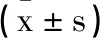
表1 比較病例組與對照組血清Adropin ZO-1水平
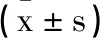
表2 比較不同神經功能缺損程度患者血清Adropin ZO-1水平
2.2不同神經功能缺損程度患者血清Adropin、ZO-1水平比較:不同神經功能缺損程度患者血清Adropin、ZO-1水平經方差分析,差異有統計學意義(F=97.460、100.149,P<0.05),兩兩比較,重型組、中型組血清Adropin水平低于輕型組,ZO-1水平高于輕型組,且重型組血清Adropin水平低于中型組,ZO-1水平高于中型組(P<0.05),見表2。
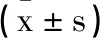
表3 比較預后良好組與預后不良組血清Adropin ZO-1水平
2.3預后良好組與預后不良組血清Adropin、ZO-1水平比較:與預后良好組比較,預后不良組血清Adropin水平減低,ZO-1水平升高,差異均有統計學意義(P<0.05),見表3。
2.4病例組患者血清Adropin、ZO-1水平與NIHSS評分、GOS評分的相關性:經Pearson積矩相關分析,高血壓腦出血患者血清Adropin與NIHSS評分呈負相關性(r=-0.792,P<0.05),與GOS評分呈正相關性(r=0.761,P<0.05);血清ZO-1與NIHSS評分呈正相關性(r=0.708,P<0.05),與GOS評分呈負相關性(r=-0.673,P<0.05)。
2.5血清Adropin、ZO-1對預后不良的預測價值:ROC曲線下結果顯示,血清Adropin、ZO-1對高血壓腦出血患者預后不良均有預測價值,AUC分別為0.790、0.761,聯合檢測的AUC為0.837,靈敏度、特異性分別為83.04%、78.65%。血清Adropin、ZO-1聯合檢測的預測價值優于單一指標,差異有統計學意義(P<0.05)。見表4。

表4 血清Adropin ZO-1對高血壓腦出血患者治療后6個月預后不良的預測價值

圖1 血清Adropin、ZO-1預測高血壓腦出血患者預后不良的ROC曲線
3 討 論
Adropin通過自分泌及旁分泌等方式介導能量代謝平衡、胰島素抵抗,通過激活PI3K-Akt信號通路,使Akt磷酸化,可促進一氧化氮合酶(eNOS)表達及一氧化氮(NO)大量合成,進而保護血管內皮細胞功能[8]。Adropin作為抗炎因子,通過激活過氧化物酶體增殖產物的γ受體而發揮抗炎作用。王金花等[9]將Adropin注入高脂血癥大鼠腹腔后發現機體炎癥反應減弱,推測與Adropin誘導eNOs表達,抑制腫瘤壞死因子-α及白細胞介素-6的mRNA表達有關。本研究中,高血壓腦出血患者血清Adropin水平降低,可能與腦出血損傷血管內皮細胞,機體通過消耗血清Adropin以抵抗這種損傷而代償性保護血管內皮有關;此外,腦出血血腫內部及周圍聚集了大量活化的巨噬細胞和中性粒細胞等炎癥細胞,并分泌炎性因子觸發炎癥反應,抑制Adropin的表達。
血腦屏障主要由星形膠質細胞、內皮細胞、周細胞及基質構成,內皮細胞連接依靠緊密連接蛋白,當血腦屏障破壞損傷內皮細胞時,緊密連接蛋白大量釋放入血。ZO-1是構成緊密連接蛋白的特異性分泌蛋白,參與維持血腦屏障結構完整性[10]。ZO-1上調介導了腦水腫及血腦屏障通透性,推測與腦水腫導致血腦屏障破壞,血管內皮細胞損傷而致ZO-1大量釋放有關[11]。本研究中,高血壓腦出血患者血清ZO-1水平升高,可能是血壓驟然升高引起腦動脈破裂,血腫出現并形成占位效應,直接和繼發性的損傷腦組織,血腦屏障破壞,血管內皮細胞損傷,ZO-1進入血液循環。
本研究還發現,血清Adropin、ZO-1與NIHSS評分及GOS評分密切相關,提示兩指標可輔助臨床評估高血壓腦出血患者神經功能缺損程度及預后,可能是Adropin水平越低的患者血管內皮損傷越嚴重,炎癥反應越強,而ZO-1水平越低則表明血腦屏障破壞越嚴重。ROC曲線結果顯示,血清Adropin、ZO-1對高血壓腦出血患者預后不良均有預測價值,且聯合檢測預測價值更高,表明血清Adropin、ZO-1可作為預測預后的敏感標志物。
綜上所述,血清Adropin水平降低、ZO-1水平升高與高血壓腦出血患者神經功能缺損程度及預后密切相關,早期聯合檢測可判斷疾病嚴重程度及預測預后。

