17β-雌二醇不同給藥方式對枸櫞酸氯米芬促排卵所致薄型子宮內膜PCOS患者妊娠結局的影響
王焱皙,柯妍,鄧高丕,趙志梅
(1.深圳市中西醫結合醫院,深圳 518104;2.廣州中醫藥大學第一附屬醫院婦科,廣州 510000;3.天津中醫藥大學第一附屬醫院生殖中心,天津 300193)
多囊卵巢綜合征(PCOS)是育齡期女性常見的一種以排卵障礙、多毛、痤瘡、不孕等為主要臨床表現的生殖內分泌疾病,其發病率為6%~9%[1],占無排卵性不孕癥患者的30%~60%[2]。現代醫學在PCOS的治療上主要以調整月經周期,控制胰島素抵抗、緩解高雄激素血癥、促排卵為主。枸櫞酸氯米芬(CC)是治療PCOS的一線促排卵藥,在臨床中應用廣泛。然而,其特異性的抗雌激素效應易造成子宮內膜菲薄、宮頸粘液粘稠,對妊娠產生一定的負面影響[3-4]。大量文獻數據顯示,植入前內膜厚度及分型是影響周期妊娠率的重要因素之一,過薄的子宮內膜易造成胚胎種植率、臨床妊娠率降低,早期妊娠丟失率增高[5-6]。因此,在應用CC促排卵的同時,如何改善子宮內膜的厚度,成為了亟待解決的問題。
17β-雌二醇(17β-E2,芬嗎通)是國內唯一一個可獲得微粒化17β-E2制劑,在圍絕經期綜合癥中應用廣泛。17β-E2可以經皮吸收,口服和外用均可發揮生物學效應[7-8]。然而,17β-E2不同給藥方式對妊娠結局的影響尚未見報道。為此本研究通過對比17β-E2口服和陰道給藥兩種不同途徑在CC促排卵周期中的應用,以期為臨床用藥起到指導作用,提升PCOS患者促排周期妊娠率。
一、資料與方法
1.研究對象:收集2018年1月至2019年2月于天津中醫藥大學第一附屬醫院生殖中心就診的符合納入、排除標準的CC促排卵所致薄型子宮內膜PCOS患者60例進行臨床試驗。
本研究通過天津中醫藥大學第一附屬醫院倫理委員會批準(NO.TYLL2016[K]字017),納入患者均簽署知情同意書,并自愿參加本試驗。
PCOS診斷標準(鹿特丹標準[9]):(1)稀發排卵或無排卵;(2)高雄激素血癥的臨床表現和(或)高雄激素血癥;(3)一側或雙側卵巢中直徑2~9 mm的卵泡≥12個,和(或)卵巢體積≥10 ml。上述3條中符合2條,并排除其他致雄激素水平升高的病因包括先天性腎上腺皮質增生、Cushing綜合征、分泌雄激素的腫瘤等。
薄型子宮內膜的診斷標準[5-6]:子宮內膜厚度在HCG日≤7 mm或自然周期尿黃體生成激素(LH)峰日內膜厚度≤7 mm。
納入標準:年齡22~38歲;符合PCOS診斷標準;在當月CC誘發排卵周期中,卵泡平均直徑≥14 mm時,內膜厚度<7 mm;輸卵管造影(HSG)顯示至少有一側輸卵管通暢;根據世界衛生組織人類精液檢查與處理實驗室手冊(第五版)標準,丈夫的精液分析正常:精子濃度≥15×106/ml;前向運動精子率≥32%;正常形態精子率≥4%。
排除標準:引起排卵障礙的其他疾病如卵巢早衰、垂體或下丘腦性閉經、高泌乳素血癥(HPRL),以及甲狀腺功能異常等;不能應用雌激素的疾病如乳腺癌等;合并嚴重內科、外科及精神類疾病;不同意簽署知情同意書。
共納入患者60例,按照隨機數字表法分為17β-E2陰道給藥(陰塞組,n=30)和17β-E2口服(口服組,n=30)兩組。
2.處理方案:兩組患者均進行生活方式調整,保持規律的作息時間,飲食清淡,控制食量,增加運動量。(1)17β-E2陰塞組:30名PCOS患者予CC誘發排卵(CC,50 mg,qd),月經周期第5天開始給藥,連續5 d。于月經周期第10天開始經陰道超聲下監測卵泡。當卵泡直徑達到14 mm、內膜厚度<7 mm時給予芬嗎通(拜耳,德國)白片(1 mg,qd,陰塞);卵泡直徑≥18 mm、尿LH呈陽性或弱陽性時,予HCG 10 000 U,排卵后第7天停用芬嗎通。排卵后第3天給予地屈孕酮(拜耳,德國)10 mg,Bid×10 d。(2)17β-E2口服組:30名PCOS患者予CC誘發排卵(CC,50 mg,qd×5 d,月經周期第5天開始服用)。于月經周期第10天開始經陰道超聲下監測卵泡。當卵泡直徑達到14 mm、內膜厚度<7 mm時給予芬嗎通白片(2 mg,qd,口服);當卵泡直徑≥18 mm、尿LH呈陽性或弱陽性時,予HCG 10 000 U,排卵后第7天停用芬嗎通。排卵后第3天給予地屈孕酮(10 mg,bid×10 d)。
3.觀察指標:觀察并記錄兩組患者HCG日子宮內膜厚度、子宮內膜分型、宮頸粘液評分情況及本周期妊娠情況等。同時記錄試驗周期內兩組患者發熱、腹瀉等不良事件發生情況。
宮頸粘液評分的方法及標準:參照“改良的Insler標準評分法”[10-12],在HCG日對受試者進行宮頸粘液評分。具體操作如下:取膀胱截石位,常規暴露陰道、宮頸。觀察并記錄宮頸粘液量及性狀,宮頸粘液拉絲度,宮頸口開閉情況,在顯微鏡下觀察白細胞量及羊齒狀結晶,對其進行評分。單項滿分為3分,總評分10~15分提示功能良好,8~10分提示功能尚可,4~7分提示功能不良,0~3分表示功能不全。

二、結果
1.兩組患者一般資料:本研究共納入患者60例,陰塞組和口服組各30例。本研究無脫落、失訪。經比較,兩組患者的年齡、體質量指數(BMI)、月經周期差異均無統計學意義(P>0.05)(表1)。
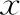
表1 兩組患者一般資料(-±s)
2.兩組患者用藥前后內膜厚度、內膜類型和宮頸粘液評分比較:陰塞組用藥后前子宮內膜厚度分別為(4.6±0.8)mm和(8.0±1.5)mm;口服組用藥前后子宮內膜厚度分別為(5.1±1.5)mm和(6.5±1.0)mm。與同組治療前相比較,治療后內膜厚度均顯著增加(P<0.05);陰塞組治療后內膜厚度顯著高于口服組治療后(P<0.05)(表2)。
陰塞組治療后子宮內膜A型20例、B型6例、C型4例,口服組治療后子宮內膜A型20例、B型2例、C型8例。經χ2檢驗兩組數據差異無統計學意義(P>0.05)(表2)。
口服組治療后宮頸粘液評分[(7.47±3.24)分],顯著低于陰塞組治療后[(9.87±2.8)分](P<0.05)(表2)。
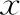
表2 兩組患者子宮內膜厚度、類型及宮頸粘液評分[(-±s),n]
3.兩組患者妊娠率比較:陰塞組妊娠8例,未妊娠22例,妊娠率為26.7%;口服組妊娠4例,未妊娠26例,妊娠率為13.3%。兩組患者間妊娠率比較差異無統計學意義(P>0.05),但是陰塞組妊娠率較高。
4.不良反應:兩組患者均未觀察到明顯的不良反應。
三、討論
PCOS是臨床常見病、多發病,占育齡期女性排卵障礙性不孕癥的30%~60%[2]。現代醫學對本病的發生機制尚無統一定論,可能與遺傳、環境、社會心理等多種因素相關[13]。PCOS在治療上需要長期管理,若任其發展,遠期可能罹患心血管疾病、子宮內膜癌、乳腺癌等[14]。育齡期PCOS合并不孕癥患者,主要以調整月經周期、控制胰島素抵抗、緩解高雄激素血癥、和超促排卵為主,輔以手術治療或輔助生殖技術等。CC是通過競爭性與下丘腦雌激素受體結合,促使GnRH脈沖式分泌增加,從而促進卵泡的發育。但是,由于此藥的抗雌激素效應,使其在臨床上應用受限[3-4]。
現代醫學主要通過胞飲突、超聲、宮腔鏡及基因學標志物等方式實現對子宮內膜容受性的量化評價[15-17],子宮內膜厚度是其重要監測指標之一,HCG日子宮內膜厚度與周期妊娠率密切相關。數據顯示,在IVF周期中,若HCG日子宮內膜厚度<6 mm,則極少能夠獲得妊娠[6]。因此,提升PCOS患者子宮內膜的容受性在促排卵周期中顯得尤為重要。
雌激素制劑的使用,可以特異性激活子宮內膜上皮細胞內中雌激素受體(ER)、血管內皮生長因子受體(VEGF-R)等,促進血管新生,改善促排卵周期中子宮內膜的血流供應,并通過誘導子宮內膜的間質增生,有效提升子宮內膜厚度[18]。17β-E2陰道給藥,可以不經過體內分解而直接發揮生物學效應,能夠有效地刺激內膜生長,獲得較好的臨床妊娠率[8]。而口服給藥則需要經過體內的代謝,往往需要較大的劑量方可達到效果。文獻數據顯示,在Turner綜合征女性患者中,2 mg的17β-E2口服與100 μg的17β-E2陰道給藥在干預12周后,可獲得相似的內膜厚度[19]。傳統的戊酸雌二醇口服制劑需要經過肝臟的首過效應,生物利用度不足10%,此外戊酸雌二醇在代謝過程中形成雌酮[20],雌酮可以激活婦女乳腺和子宮內膜中的致癌基因,增加罹患子宮內膜癌及乳腺癌的風險[21]。研究證實,1 mg 17β-E2陰塞可以達到4 mg戊酸雌二醇口服的生物學效應,這樣大大地降低了臨床用藥劑量,減少了不良反應的發生情況。
本實驗研究數據顯示17β-E2陰道給藥組較口服給藥相比,在HCG日獲得了較好的內膜厚度和宮頸粘液評分,臨床妊娠率也較高。由此可見,17β-E2陰道給藥具有藥用劑量小,臨床效果好等優勢,值得臨床推廣。
綜上所述,17-E2陰道用藥可顯著提升CC促排周期中PCOS患者的子宮內膜厚度,提升臨床妊娠率。但是本研究樣本量較小,觀察周期短,因此在臨床妊娠率指標上沒有統計學意義,后續研究仍需要擴大樣本量,進一步驗證17β-E2的臨床療效。

