早產兒支氣管肺發育不良的影響因素
李瑞改
(鄧州市人民醫院 新生兒監護室,河南 南陽 474150)
支氣管肺發育不良(bronchopulmonary dysplasia,BPD)是新生兒重癥監護病房(Neonatal Intensive Care Unit,NICU)中早產兒較為常見的并發癥之一,患兒長期依賴氧生存,生長發育過程中易因反復肺炎而多次住院,且BPD與神經系統并發癥密切相關,可引起患兒體能、智力發育障礙等,導致早產兒預后不良[1]。盡管國內外對BPD已經進行了較為深入的研究,普遍認為BPD是在遺傳易感性的基礎上,由氧中毒、低出生體質量等多種因素所致,但其確切病因仍不明確,防治效果并不理想[2-3]。因而,探討更多引起BPD發生、發展的危險因素具有必要性。鑒于此,本研究旨在分析NICU中早產兒發生BPD的可能影響因素。
1 資料與方法
1.1 一般資料回顧性收集2019年5月至2021年5月鄧州市人民醫院NICU收治的50例發生BPD的早產兒的臨床資料,設為發生組。按1∶1納入同期收治的50例未發生BPD的早產兒的臨床資料,設為未發生組。100例NICU早產兒:男55例,女45例;出生方式為剖宮產84例,陰道分娩16例;出生時胎齡26~32周,平均(29.29±0.48)周;出生時體質量992~1 503 g,平均(1 329.96±26.85)g;出生時身長28~49 cm,平均(38.68±2.76)cm;多胎9例;存在宮內窘迫31例;出生1分鐘Apgar評分≤7分31例;存在敗血癥19例;存在宮內感染51例。
1.2 入選標準(1)納入標準:①于本院出生,出生時胎齡≤32周;②出生后24 h內轉入本院NICU;③住院時間>28 d;④臨床資料完整。(2)排除標準:①存在呼吸系統畸形;②染色體異常、遺傳代謝類疾病;③先天性心臟病、氣胸、胸腔積液及膈疝等疾病;④合并肝腎疾病;⑤先天性肺部發育不全;⑥存在外科疾病或轉至外科手術;⑦住院期間轉院或發生院內病死。
1.3 BPD評估方法根據美國國立兒童保健與人類發展研究院(National Institute of Child Health and Human Development,NICHD)制定的相關標準[4]評估BPD發生情況:(1)任何氧依賴(吸入氧濃度>21.00%)>28 d;(2)有慢性或進行性呼吸功能不全,表現為低氧血癥或高碳酸血癥;(3)存在肺部影像學表現(胸部X線或CT下可見兩肺紋理增強、通透性降低、磨玻璃樣等表現)。符合以上指征則可評估為BPD。
1.4 臨床資料收集方法查閱早產兒出生后相關資料,包括性別(男、女)、出生方式(剖宮產、陰道分娩)、出生時胎齡、出生時體質量、出生時身長、多胎(是、否)、存在宮內窘迫(是、否)、出生1分鐘Apgar評分≤7分(是、否)( Apgar評分標準[5]:總分為0~10分,正常新生兒8~10分,輕度窒息5~7分,重度窒息≤4分)、存在敗血癥(是、否)、存在宮內感染(是、否)、機械通氣(mechanical ventilation,MV)治療時間及血清25-羥維生素D[25-hydroxy-vitamin D,25-(OH)D]水平等。25-(OH)D檢測方法:采集早產兒出生時足底靜脈血2 mL,于常溫下靜置10~20 min,于4 ℃環境中保存,以3 000 r·min-1速率離心處理15 min,離心半徑為13.5 cm,取血清,采用邁瑞CL-1000i化學發光免疫分析儀檢測血清25-(OH)D水平。試劑盒選自廣州萬孚生物技術股份有限公司,相關操作需嚴格遵照試劑盒說明書進行。

2 結果
2.1 臨床資料與未發生組比較,發生組存在宮內感染占比較高,MV治療時間較長,出生時血清25-(OH)D水平較低(P<0.05);兩組性別、出生方式、出生時胎齡、出生時體質量、出生時身長、多胎、存在宮內窘迫、出生1分鐘Apgar評分≤7分占比、存在敗血癥比較,差異無統計學意義(P>0.05)。見表1。

表1 兩組NICU早產兒臨床資料比較
2.2 NICU早產兒發生BPD的影響因素將NICU早產兒BPD發生情況作為因變量(發生=1,未發生=0,將2.1中比較結果P放寬至<0.15,納入符合條件的變量(自變量賦值見表2),建立logistic回歸分析模型,結果顯示,存在宮內感染、MV治療時間較長、出生時血清25-(OH)D低表達均為NICU早產兒發生BPD的影響因素(P<0.05)。見表3。

表2 賦值說明
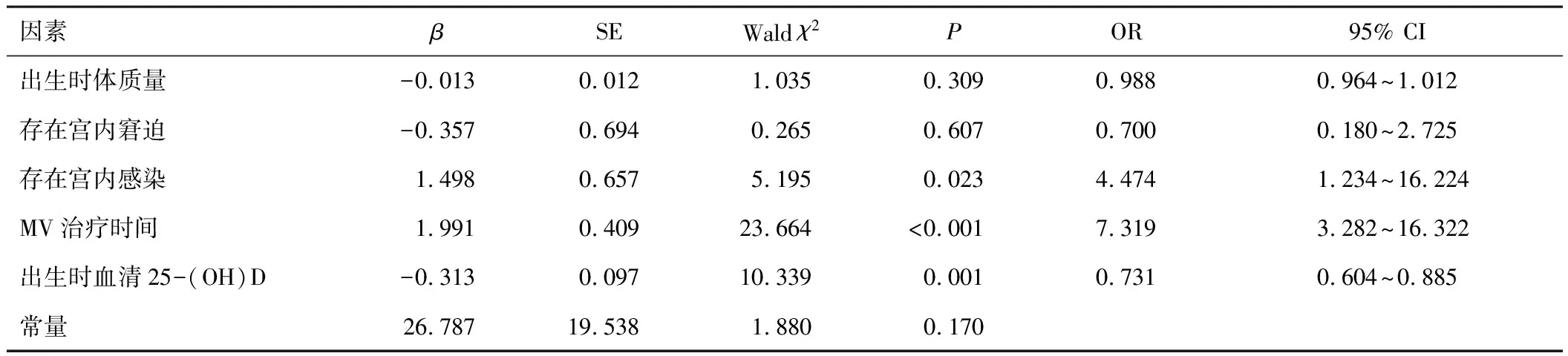
表3 NICU早產兒發生BPD的影響因素
3 討論
BPD是一種早產兒慢性肺部疾病,是目前早產兒致殘、致死的主要原因之一。目前BPD發病機制尚不明確,但為多種因素綜合作用的結果。因此,尋找可能影響NICU早產兒發生BPD的影響因素,對臨床干預措施的制定具有重要的參考價值。
本研究經logistic回歸分析結果顯示,存在宮內感染、MV治療時間較長、出生時血清25-(OH)D低表達均可能是NICU早產兒發生BPD的影響因素。產前母體患有細菌性陰道炎、巨細胞病毒感染等可使各種炎癥因子水平升高,導致胎肺發育受阻并觸發早產[6]。各種炎癥因子可損傷呼吸道上皮與肺毛細血管內皮細胞,增加血管通透性,導致肺間質、肺泡和氣道水腫;炎癥因子可抑制肺泡成纖維細胞和彈性蛋白纖維束生成,促使正常肺泡、肺血管的發育停滯,進而增加BPD風險[7]。早產兒體液免疫和細胞免疫均不成熟,感染可造成早產兒脫機困難、延長MV治療時間等,加重肺組織充血、水腫及炎癥等反應,促使BPD發生發展。對此建議,積極防治母體感染,避免胎兒出現感染,以降低BPD發生率。MV治療時間較長引起的呼吸機相關性肺炎(ventilator associated pneumonia,VAP)的風險越高,而VAP可致肺部繼發感染,影響早產兒肺部發育;VAP病原菌多具有多重耐藥性,可加重早產兒病情,進一步延長MV治療時間,加重肺損傷,增加BPD發生的風險[8]。MV時高氣道壓或高潮氣量可引起肺泡過度擴張,導致毛細血管內皮、肺泡上皮細胞等出現機械性損傷,液體滲漏至肺泡腔,大量促炎因子、炎癥因子被釋放,引起肺水腫、纖維蛋白沉積、肺表面活性物質降低,導致肺部損傷,進而誘發BPD[9]。對NICU早產兒進行MV治療時需根據早產兒的病情、血氣結果來調整呼吸機參數,給予適宜的氧濃度,盡快撤機,以降低BPD風險。多項研究顯示,維生素D與肺部疾病的發生、發展密切相關[10-11]。維生素D的生物學功能復雜多樣,可能通過參與多個環節對BPD的發生和發展過程產生影響。維生素D在肺發育的腺體期和囊泡期分別在近端氣道和遠端氣道形成時上調維生素D通路基因,促進肺發育;維生素D可刺激肺泡表面活性物質,促進Ⅱ型肺泡上皮細胞的分化和增殖,同時可抑制肺泡纖維細胞的凋亡[12]。因而,維生素D水平的改變可影響胎兒的肺部發育。血清25-(OH)D低表達抑制基質金屬蛋白酶和腫瘤壞死因子-α合成能力減弱,導致纖維母細胞增殖和膠原合成增加,破壞肺間質,影響胎兒早期肺發育和晚期肺重建,加重氣道重塑,誘發BPD。對此建議,母親孕期需適當補充維生素D,促進胎兒肺發育,以此降低出生后BPD發生率。
綜上所述,臨床應針對上述因素,實施相應干預措施,如盡快撤機、補充維生素D等來降低BPD發生的風險。

