α粒子與酒精聯(lián)合作用致肝細胞惡性轉(zhuǎn)化的影響
劉紅艷,王婧潔,張慧芳,黨旭紅,王 超,張忠新,張睿鳳,原雅藝,任 越,董娟聰,柴棟良,李幼忱
中國輻射防護研究院,山西 太原 030006
隨著我國核技術應用產(chǎn)業(yè)的發(fā)展,電離輻射對人類健康的影響越來越受到重視。α粒子由于具有較高的傳能線密度(LET),會導致較強的相對生物效應能(RBE),它對人體健康的影響一直是職業(yè)健康中關注的重點[1-4]。超鈾核素在核材料生產(chǎn)、MOX燃料制造、乏燃料后處理以及高放廢物處理與處置中對人體健康存在潛在風險[5-6]。超鈾核素半衰期長,比活度高,人體內(nèi)負荷小,主要考慮通過吸入或從皮膚進入體內(nèi)后產(chǎn)生的α粒子輻射能量沉積對組織器官的影響,肝臟是其重要的靶器官[7-8]。眾所周知,肝臟是人體代謝的主要場所,且?guī)缀跏蔷凭x的唯一場所,涉核工作人員的飲酒習慣是否會增加α粒子內(nèi)照射對人體的健康風險,目前沒有足夠的人群流行病學調(diào)查和實驗動物、細胞水平的數(shù)據(jù)支持[9-12]。在α粒子內(nèi)照射氡的健康評估中,已有流行病學研究表明氡與吸煙的聯(lián)合致肺癌作用存在協(xié)同效應,與部分細胞學和動物學實驗研究結果一致[13-16]。
因此本工作擬通過α粒子輻射體,建立體外細胞實驗,開展α粒子輻射、酒精單獨作用和兩者聯(lián)合作用肝細胞的實驗研究,從細胞生物學、分子生物學水平探討單因素、聯(lián)合因素對人肝細胞生物學效應的影響,為系統(tǒng)評價α粒子內(nèi)照射風險提供基礎數(shù)據(jù)。
1 實驗部分
1.1 實驗細胞
LO2細胞是人正常肝上皮細胞構建成的永生化細胞系,購于中國科學院上海細胞庫。
1.2 輻射源
蘇州大學241Am α粒子輻射源裝置,如圖1所示,α粒子源幾何尺寸為36 mm×4 mm,是有效直徑為20 mm的面源,其活度為5.7×106Bq,文獻[17]計算給出表面劑量率為0.138 Gy/min。面源與蓋玻片盤平行放置,兩者間距離為10 mm。
1.3 儀器和試劑
CO2細胞培養(yǎng)箱、酶標儀,Thermo 公司;超潔凈工作臺,蘇州安泰空氣技術有限公司;實時熒光定量 PCR 擴增儀,Bio-Rad 公司;倒置相差顯微鏡,OLYMPUS公司;流式細胞儀,Beckman公司;高速冷凍離心機,Sigma公司。
RPMI-1640 培養(yǎng)基、胰蛋白酶、胎牛血清、青霉素和鏈霉素,上海生工;Trizol(主要成分為苯酚,含有8-羥基喹啉、異硫氰酸胍、β-巰基乙醇等抑制內(nèi)源和外源RNA酶)、RNA 反轉(zhuǎn)錄、熒光定量PCR試劑盒,天根公司;細胞周期試劑盒、CCK-8試劑盒,凱基生物;酒精,分析純,南京碧云天生物工程有限公司;Transwell板、Matrigel基質(zhì)膠,美國康寧公司。
1.4 實驗方法
1.4.1細胞培養(yǎng) LO2人肝細胞在37 ℃恒溫5%(體積分數(shù))CO2環(huán)境下的細胞培養(yǎng)箱中,用含10%(體積分數(shù))胎牛血清的RPMI-1640培養(yǎng)基進行培養(yǎng),貼壁細胞生長至培養(yǎng)瓶底面積的80%~90%,經(jīng)0.25%(質(zhì)量分數(shù))胰蛋白酶消化,進行1∶3傳代,傳代一次計1代(P1),培養(yǎng)細胞瓶于倒置相差顯微鏡下觀察細胞狀態(tài)。
1.4.2細胞生長增殖檢測 細胞生長增殖采用CCK-8試劑盒進行檢測,已廣泛應用于細胞毒理試驗。首先制作人肝細胞生長標準曲線,取對數(shù)生長期細胞,用血球計數(shù)板計數(shù)細胞濃度,并將肝細胞密度分別調(diào)整為每毫升1萬個、2萬個、4萬個、8萬個、16萬個,每孔分別接種100 μL于96孔板進行培養(yǎng),每組設置5個復孔。待接種細胞貼壁后,加入CCK-8試劑,37 ℃孵育3 h后,采用酶標儀于490 nm 波長處測量吸光度(OD)值。
1.4.3α粒子輻照劑量篩選 在文獻[18-19]調(diào)研的基礎上,初步確定了5個劑量點對肝細胞進行α輻照,劑量分別為0.05、0.10、0.25、1.00、2.00 Gy,根據(jù)輻照劑量=劑量率×輻照時間,α源的劑量率為0.138 Gy/min,計算出各實驗點所需輻照時間分別為21.7、43.5、108.7、434.8、869.6 s,輻照前細胞接種于已消毒的玻片上,濾紙吸控細胞表面培養(yǎng)基,將貼有細胞的玻片面朝α源,置于α粒子輻射源裝置輻照區(qū)卡槽內(nèi)。輻照完成后,玻片直接放入培養(yǎng)基,待細胞繼續(xù)生長數(shù)小時后進行消化轉(zhuǎn)移至細胞培養(yǎng)瓶培養(yǎng)。對照組細胞同時置于玻片接受假輻照(0 Gy),輻照后48 h進行細胞增殖活力檢測,顯微鏡動態(tài)觀察細胞形態(tài)和生長狀況,篩選合適的輻照劑量進行后續(xù)α粒子輻照實驗。
1.4.4酒精作用濃度篩選 在文獻[20-22]調(diào)研的基礎上,根據(jù)中國人群飲酒習慣,計算血液和肝臟代謝酒精濃度,初步采用酒精濃度(體積百分比)0.5%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0% 和7.0%的細胞培養(yǎng)基進行肝細胞酒精作用24 h,結束后換成正常培養(yǎng)基,進行細胞增殖活力檢測,顯微鏡動態(tài)觀察細胞形態(tài)和生長狀況,篩選合適的酒精濃度和作用時間進行后續(xù)酒精作用肝細胞實驗。
1.4.5聯(lián)合作用方式及實驗分組 根據(jù)α粒子輻射和酒精單因素作用模型,建立復合作用方式。實驗分為4組:對照組(不進行任何處理);輻射組(單純α粒子輻照);酒精組(單純酒精處理);復合組(輻射組+酒精組,即細胞先經(jīng)α粒子輻照后再經(jīng)酒精作用處理)。實驗用細胞經(jīng)消化后進行傳代,采用相同代數(shù)的各組細胞,且均處于40代以內(nèi),進行細胞生物學指標檢測。
1.4.6細胞生物學效應
(1) 流式細胞術檢測細胞周期
細胞周期是反映細胞生長增殖狀態(tài)的重要指標之一。采用PI染料進行DNA染色,利用流式細胞術檢測肝細胞周期。用Multicycle for windows 32-bit軟件統(tǒng)計分析人肝細胞在G0/G1、S、G2/M這3個不同時期的細胞占比。每個實驗樣品設3個平行樣,收集人肝細胞約1 × 106個,加入無水乙醇過夜固定肝細胞,用預冷的磷酸鹽緩沖溶液(phosphate buffered saline, PBS)清洗細胞去掉乙醇;加PI染料,室溫避光孵育30 min后,用流式細胞儀進行定量檢測。
(2) 細胞遷移和侵襲能力檢測
細胞遷移和侵襲實驗是反映細胞發(fā)生惡性轉(zhuǎn)變的重要指標。采用Transwell實驗測定細胞遷移和侵襲能力。細胞遷移檢測:細胞接種于24孔板8 μm孔徑濾膜的chamber上室,下室加入500 μL含胎牛血清培養(yǎng)基,避免起泡產(chǎn)生。每個實驗組接種3個平行樣,于37 ℃培養(yǎng)箱培養(yǎng)24 h后終止,用0.1%(質(zhì)量分數(shù))結晶紫染色,棉簽擦去上室內(nèi)膜上的細胞,將Transwell小室反過來底朝上,顯微鏡下觀察小室底膜上附著細胞,隨機選取5~10個視野,顯微鏡拍照,記錄圖像中細胞數(shù)量。檢測細胞侵襲能力時,Transwell小室底部膜需要包埋 Matrigel基質(zhì)膠,將冰上緩慢溶解的Matrigel基質(zhì)膠與無血清培養(yǎng)基按體積比1∶8稀釋后,加入小室底部,室溫待其凝固,再接種細胞懸液,其余步驟與細胞遷移檢測一致。采用Image J圖像處理軟件進行肝細胞數(shù)量自動計數(shù)。
(3) mRNA分子水平表達
采用實時熒光定量聚合酶鏈鎖反應(Real-time qPCR)測定肝細胞惡性轉(zhuǎn)化相關mRNA表達水平。在文獻[23-25]調(diào)研的基礎上,根據(jù)美國國家生物技術信息中心(NCBI)DNA序列數(shù)據(jù)庫GeneBank公布的序列,設計Real-time qPCR引物,結果列入表1。實驗細胞待生長至80%~90%,用PBS沖洗3遍后,直接加入Trizol試劑,提取細胞總RNA,并逆轉(zhuǎn)錄成 cDNA,并以此為模板進行 Real-time qPCR 檢測,每個樣本設置3個重復樣,結果采用ΔΔCT法進行分析。
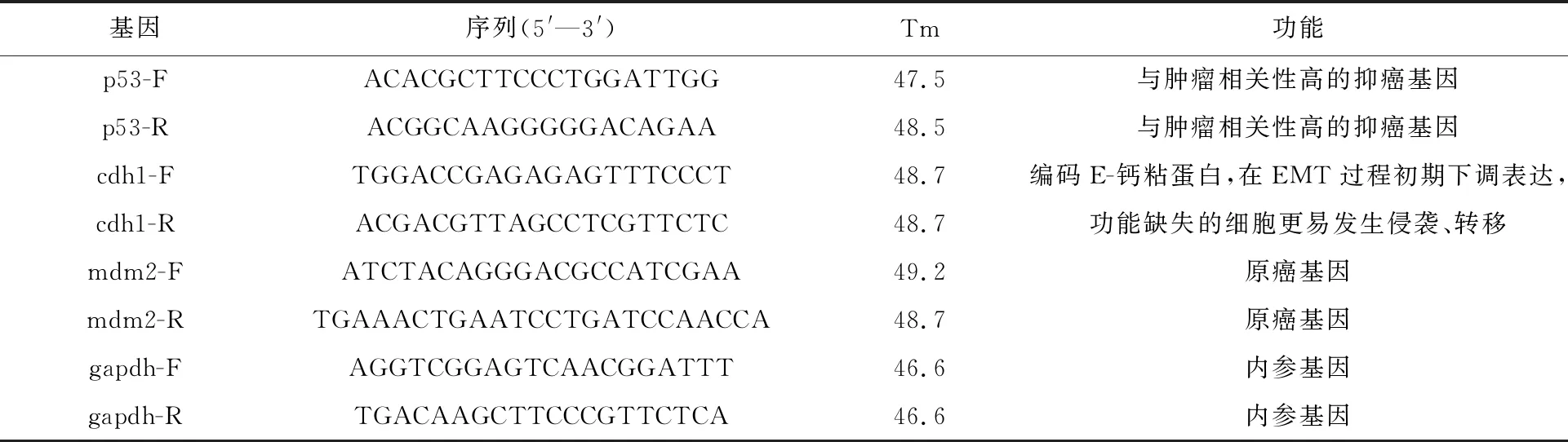
表1 引物序列
1.5 統(tǒng)計學分析
2 結果和討論
2.1 α粒子輻照劑量
LO2人正常肝細胞在含10%新生胎牛血清RPMI-1640培養(yǎng)基中正常生長,于倒置顯微鏡下觀察細胞形態(tài),呈上皮樣、多角型,貼壁生長狀態(tài)。采用241Am放射源對肝細胞進行不同劑量(0.05、0.10、0.25、1.00、2.00 Gy)α粒子輻照,輻照后48 h檢測肝細胞存活分數(shù),結果示于圖2。由圖2可知:與對照組(NC)比較,0.05 Gy組細胞活力差異不顯著(P>0.05);0.10、0.25、1.00 Gy組肝細胞的存活分數(shù)低于對照組,差異不顯著(P>0.05);2.00 Gy組肝細胞存活分數(shù)明顯低于對照組,差異有統(tǒng)計學意義(P<0.05),肝細胞接受2.00 Gy輻照后,連續(xù)培養(yǎng)72 h,50%的細胞呈懸浮狀態(tài),出現(xiàn)明顯死亡。因此,選擇肝細胞存活分數(shù)幾乎不受影響的1.00 Gy輻射劑量進行單因素α粒子輻照細胞,記為輻射組。
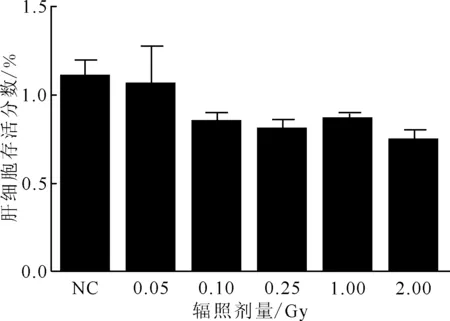
圖2 不同劑量輻照48 h后對肝細胞存活分數(shù)的影響
2.2 酒精作用濃度
采用含酒精濃度(體積百分比)分別為0.5%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0%和7.0%的細胞培養(yǎng)基作用于肝細胞,與對照組比較,結果示于圖3。由圖3可知:酒精作用24 h后,0.5%和1.0%酒精作用組肝細胞存活分數(shù)低于對照組,但差異不顯著(P>0.05);2.0%和3.0%酒精作用組肝細胞存活分數(shù)低于對照組,差異有統(tǒng)計學意義(P<0.05),在作用5 min后,長梭型貼壁細胞變圓,4 h 后形態(tài)恢復正常;4.0%~7.0%酒精作用組肝細胞存活分數(shù)顯著低于對照組。因此,選擇肝細胞存活分數(shù)幾乎不受影響的1.0%酒精進行作用,記作酒精組。
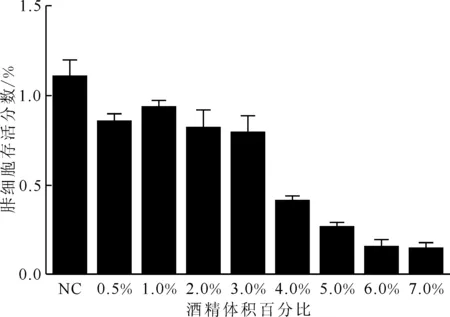
圖3 不同濃度酒精處理24 h后對肝細胞存活分數(shù)的影響
2.3 α粒子與酒精聯(lián)合作用人肝細胞
在以上篩選的單因素輻射和酒精作用肝細胞模型的基礎上,進行α粒子輻照和酒精聯(lián)合作用,組成了復合作用方式:細胞先接受α粒子輻照后再經(jīng)酒精作用。輻照劑量為1.00 Gy/次,累計輻照兩次后經(jīng)酒精作用,采用含1.0%酒精濃度的培養(yǎng)基培養(yǎng),每代進行一次酒精處理,隔三天傳代一次。
2.4 細胞生物學效應
2.4.1細胞周期 流式細胞術檢測各實驗組肝細胞周期示于圖4。由圖4可知:與對照組比較,輻射組S期細胞比例增加(P<0.05)、G2/M期細胞比例減少(P<0.05),差異具有統(tǒng)計學意義;酒精組與復合組肝細胞處于G0/G1期的細胞比例均減少、S期細胞比例均增加,差異均具有統(tǒng)計學意義(P<0.05)。輻射組與酒精組比較,G0/G1期細胞比例增加、S期和G2/M期細胞比例減少,差異均具有統(tǒng)計學意義(P<0.05)。復合組與輻射組比較,G0/G1期細胞比例減少、S期細胞比例增加,且有顯著性差異(P<0.05),各組的肝細胞周期百分比結果示于圖5。由圖5可知:輻射組細胞出現(xiàn)G0/G1期阻滯,DNA復制前的檢查修復需要更長時間,與輻射致DNA損傷有關。與單因素組相比,復合組肝細胞G1期逃逸至S期,細胞周期失衡。
(a)——對照組,(b)——酒精組,(c)——輻射組,(d)——復合組
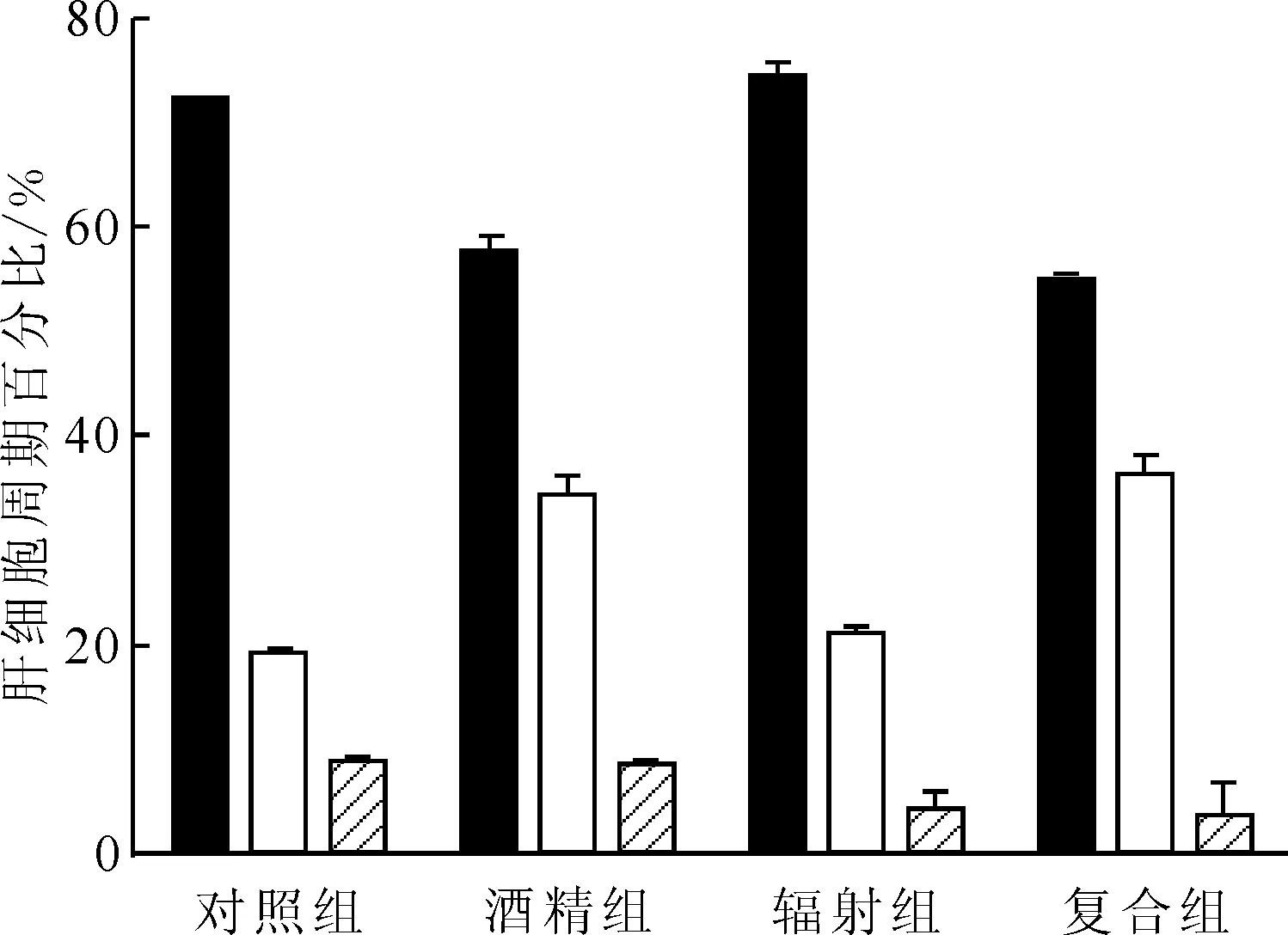
■——G0/G1,□——S,——G2/M
2.4.2細胞遷移和細胞侵襲 Transwell實驗測定各實驗組肝細胞發(fā)生遷移和侵襲的細胞數(shù)量示于圖6。由圖6可知:與對照組比較,輻射組、復合組肝細胞均發(fā)生了細胞遷移,差異有統(tǒng)計學意義(P<0.05);與酒精組比較,輻射組發(fā)生遷移的細胞數(shù)量增加,差異有統(tǒng)計學意義(P<0.05),復合組發(fā)生遷移和侵襲的細胞數(shù)量也均增加,差異有統(tǒng)計學意義(P<0.05、P<0.001);與輻射組比較,復合組發(fā)生侵襲的細胞數(shù)量增加,差異有統(tǒng)計學意義(P<0.05),復合組發(fā)生侵襲的細胞數(shù)量最大,有著明顯的惡性轉(zhuǎn)化趨勢,提示α粒子輻照后再進行酒精處理,酒精增加了肝細胞的侵襲能力,誘導細胞發(fā)生惡性轉(zhuǎn)化。
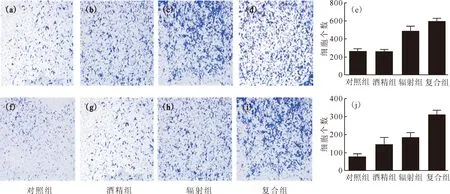
(a)—(d)、(f)—(i)為顯微鏡成像圖片
2.4.3分子生物學效應 用實時熒光定量聚合酶鏈鎖反應(Real-time qPCR)的方法,檢測與細胞惡性轉(zhuǎn)化相關的抑癌基因p53和原癌基因mdm2、細胞粘附蛋白相關基因cdh1在mRNA水平的表達,結果示于圖7。由圖7可知:與對照組比較,單因素和復合組細胞p53基因和cdh1基因在mRNA水平表達降低,mdm2基因表達升高,差異有統(tǒng)計學意義(P<0.05);與酒精組比較,復合組肝細胞p53、cdh1和mdm2基因表達有顯著差異(P<0.001);與輻射組細胞比較,復合組細胞p53基因和mdm2基因表達有顯著差異(P<0.05),提示α粒子和酒精均誘導肝細胞發(fā)生惡性轉(zhuǎn)化趨勢,復合作用明顯高于單因素作用,即輻照后酒精的作用促進了肝細胞原癌基因mdm2的高表達和抑制了抑癌基因P53的表達,從分子水平介導肝細胞發(fā)生惡性轉(zhuǎn)化。

■——NC,——酒精組,□——輻射組,——復合組
3 結 論
研究發(fā)現(xiàn)α粒子輻射和酒精均能誘導肝細胞發(fā)生惡性轉(zhuǎn)化趨勢,復合因素作用下肝細胞原癌基因mdm2高表達,抑癌基因p53和細胞粘附相關基因cdh1低表達,發(fā)生明顯的惡性轉(zhuǎn)化趨勢。提示α粒子輻照后再進行酒精作用的肝細胞發(fā)生惡性轉(zhuǎn)化的風險增高,可能是酒精影響了肝細胞表面E型粘連蛋白的表達,導致細胞之間粘連性降低,促進細胞發(fā)生遷移和侵襲。因此,在評價α粒子內(nèi)照射對健康的影響時需要考慮職業(yè)人員的飲酒習慣。

