林下藥用植物風(fēng)柜斗草莖段組培快繁
游啟孫
(福建三明林業(yè)學(xué)校,福建 三明 365001)
1 引言
風(fēng)柜斗草又名楮頭紅、東方肉穗草,屬于野牡丹科肉穗草屬草本植物。多生長于密林下蔭濕的地方或溪邊,是閩南地區(qū)常用的民間草藥,1989年被廈門市列入瀕危植物[1]。全草可入藥,具清肝明目的作用,治耳鳴及目霧等癥或祛肝火,尤其對急性肝炎療效最佳,對慢性肝炎及乙肝病毒攜帶者有效[2], 并用于治療肝硬化頑固性腹水及原發(fā)性肝癌[3],其功能和作用加速了風(fēng)柜斗草的藥理、藥效和繁殖等方面的深入研究。但是由于野生資源過度采挖,生態(tài)環(huán)境的破壞,野生資源日益枯竭,而當(dāng)前風(fēng)柜斗草人工繁育主要以采集野生苗分株和扦插,成活率低且繁殖速度慢[4],并不能滿足日益增長的市場需求,因此風(fēng)柜斗草的組培快繁研究極具意義,既豐富了繁殖方式,又滿足了種苗供應(yīng)。風(fēng)柜斗草及相近植物相關(guān)研究有些許報(bào)道,但組培研究報(bào)道較少:李金雨等[1]對風(fēng)柜草栽培技術(shù)及開發(fā)利用進(jìn)行相關(guān)研究;陳向東[5]介紹林下人工種植風(fēng)柜斗草的相關(guān)技術(shù),詳細(xì)分析林下種植所帶來的市場、經(jīng)濟(jì)、生態(tài)等效益;蔡坤秀等[6]應(yīng)用正交試驗(yàn)方法研究野牡丹科葉底紅組織培養(yǎng)和快速繁殖條件的優(yōu)化。目前風(fēng)柜斗草研究多為栽植技術(shù)和藥理方向,其組培快繁技術(shù)研究鮮有報(bào)道,本研究以風(fēng)柜斗草當(dāng)年生莖段為材料,建立風(fēng)柜斗草組培快繁體系,為工廠化育苗提高技術(shù)支撐。
2 材料與方法
2.1 試驗(yàn)材料
采集野外風(fēng)柜斗草并移栽于福建三明林業(yè)學(xué)校溫室大棚,取當(dāng)年生莖段作為外植體材料。
2.2 試驗(yàn)方法
2.2.1 外植體預(yù)處理與消毒
莖桿浸泡于含吐溫20的溶液中并清洗,流水沖洗0.5 h。75%酒精處理8~15 s,0.1%HgCl2溶液浸泡6、8、10、12、14 min,無菌水沖洗5次,切為單節(jié)莖段,接種于MS培養(yǎng)基中。每處理30瓶,重復(fù)3次,每瓶1根,每7 d觀察1次,30 d后統(tǒng)計(jì)污染率、褐化率與成活率。
2.2.2 芽誘導(dǎo)培養(yǎng)
消毒處理的單節(jié)莖段在附加6-BA(1.0、2.0與3.0)mg/L和NAA(0.1與0.5) mg/L激素配比的MS培養(yǎng)基中誘導(dǎo),以空白MS培養(yǎng)基作為對照,每處理15瓶,重復(fù)3次,每瓶接種3根外植體。30 d后統(tǒng)計(jì)誘導(dǎo)率和生長情況。
2.2.3 增殖培養(yǎng)
將誘導(dǎo)不定芽轉(zhuǎn)入附加6-BA(1.0、1.5、2.0 mg/L)和 NAA(0、0.1、0.3 mg/L)的MS培養(yǎng)基作雙因素完全試驗(yàn),以MS基本培養(yǎng)基作為對照,每處理15瓶,重復(fù)3次,每瓶接種3叢(3株/叢)。30 d后統(tǒng)計(jì)增殖系數(shù)和生長狀況。
2.2.4 生根培養(yǎng)
以MS、1/2MS、1/3MS培養(yǎng)基 ,IBA(0.1、0.2、0.3 mg/L)及 NAA (0、0.1、0.2 mg/L)作3因素L9(33)正交試驗(yàn),每處理20瓶,每瓶接種4株,重復(fù)3次,30d后統(tǒng)計(jì)生根率及根系生長。
2.2.5 煉苗及移栽
在帶遮陽網(wǎng)的溫室大棚中煉苗7 d,取苗洗凈培養(yǎng)基,在0.2%多菌靈溶液中浸根3~5 min,溫室大棚進(jìn)行移栽。移栽基質(zhì)為消毒過的不同配比營養(yǎng)土、珍珠巖和黃泥土。溫度25 ℃左右,噴霧保濕,60 d后統(tǒng)計(jì)成活率及生長狀況。
以上培養(yǎng)過程中培養(yǎng)基含白砂糖30 g/L,卡拉膠7 g/L,pH值6.0,生根培養(yǎng)添加活性炭0.1%。培養(yǎng)溫度(25±1) ℃,光照時(shí)間11 h/d,光照強(qiáng)度2000 lx。
2.3 統(tǒng)計(jì)分析
應(yīng)用 Excel軟件和DPS v7.05進(jìn)行統(tǒng)計(jì)分析。
3 實(shí)驗(yàn)結(jié)果
3.1 消毒時(shí)間對外植體的影響
不同0.1%HgCl2消毒時(shí)間對風(fēng)柜斗草莖段的影響結(jié)果見表1。每處理30瓶,重復(fù)3次,共90個(gè)外植體,試驗(yàn)結(jié)果顯示:消毒時(shí)間6~14 min,外植體污染率從58.89%下降到2.22%,污染率逐漸降低;褐化率由13.33%增加到74.44%,褐化率不斷升高;消毒時(shí)間短,褐化率低但是污染率高,外植體消毒時(shí)間長,污染率低但是褐化率高,外植體成活率均較低(27.78%和23.33%);外植體成活率隨消毒時(shí)間先提升后下降,在10min時(shí)成活率最高為65.56%。因此風(fēng)柜斗草莖段俑0.1%HgCl2消毒最佳時(shí)間為10 min。

表1 消毒時(shí)間對外植體的影響
3.2 不定芽誘導(dǎo)
6-BA和NAA配比的雙因素完全試驗(yàn)對風(fēng)柜斗草莖段誘導(dǎo)及生長情況影響見表2。對照組誘導(dǎo)率為52.75%,顯著低于添加激素的組合,且全部為單芽,表明激素的添加對腋芽的誘導(dǎo)有顯著影響;6-BA濃度1~3 mg/L范圍內(nèi),腋芽誘導(dǎo)率隨濃度升高而提升,且多芽率也逐漸提高,當(dāng)6-BA濃度為3 mg/L時(shí)均為多芽,但存在32%玻璃化苗,說明6-BA濃度過高;添加NAA對腋芽誘導(dǎo)有促進(jìn)作用,濃度為0.1 mg/L相較于0.5 mg/L,誘導(dǎo)率和多芽率都更高,且濃度為0.5 mg/L時(shí)會出現(xiàn)無效愈傷,不利于誘導(dǎo)。試驗(yàn)結(jié)果顯示處理3:MS+2.0 mg/L 6-BA+0.1 mg/L NAA為最佳誘導(dǎo)配方,誘導(dǎo)率為86.46%,且87%為多芽(圖1a)。

表2 6-BA和NAA對外植體誘導(dǎo)的影響
3.3 不同激素配比對對風(fēng)柜斗草增殖的影響
將誘導(dǎo)的不定芽接種到增殖培養(yǎng)基中做雙因素(6-BA,NAA)3水平完全試驗(yàn),9種組合處理的duncan多重比較結(jié)果表明(表3):在對照未加激素的培養(yǎng)基,芽苗正常生長,但增殖系數(shù)為1.37;6-BA各濃度間增殖系數(shù)差異性顯著,濃度1.5 mg/L對叢生芽增殖影響最大,濃度2.0 mg/L和濃度1.0 mg/L次之,濃度為2.0 mg/L時(shí)出現(xiàn)畸形芽;NAA各濃度間差異性同樣顯著,濃度越高對增殖影響越小且芽苗質(zhì)量較差,濃度為0.3 mg/L有愈傷出現(xiàn);處理4的增殖系數(shù)最大為6.32,極顯著高于其他處理,且芽苗生長好、葉色正常(圖1b)。因此最佳增殖培養(yǎng)基為4號處理:MS+1.5 mg/L 6-BA+0.1 mg/L NAA。

表3 不同激素配比對風(fēng)柜斗草增殖的影響
3.4 生根誘導(dǎo)培養(yǎng)
取2 cm以上、生長正常的不定芽,采用3因素3水平L9正交試驗(yàn)設(shè)計(jì)進(jìn)行生根培養(yǎng)(第四列為空列)。9種組合的根數(shù)量與根長度方差分析表明,6-BA和NAA對風(fēng)柜斗草生根數(shù)量和根長度影響極顯著,基本培養(yǎng)基對生根影響不顯著。duncan多重比較結(jié)果顯示(表4):各處理的生根率都在100%,風(fēng)柜斗草生根較容易;基本培養(yǎng)基(MS、1/2 MS、1/3 MS)對根數(shù)量及根長度影響不顯著,說明基本培養(yǎng)基對風(fēng)柜斗草根的生長影響不大;濃度0.2 mg/L的IBA對根數(shù)量和根長度影響最大,與其他濃度差異性顯著,在根數(shù)量上,濃度0.3 mg/L影響次之、濃度0.1 mg/L影響最低,濃度0.3 mg/L和濃度0.1 mg/L對根長度影響不顯著;NAA各濃度對根數(shù)量和影響差異性顯著,影響程度0.1 mg/L>0.2 mg/L>0.0 mg/L,NAA各濃度在根長度影響上,濃度0.1 mg/L與其他濃度差異顯著,另外兩個(gè)濃度差異不顯著;IBA少量和NAA不添加時(shí)根生長纖細(xì),NAA和IBA濃度高時(shí)易產(chǎn)生愈傷。處理2對根數(shù)量和長度影響顯著的高于其他處理,且根生長較好(粗且無愈傷,圖1c)。因此最佳生根培養(yǎng)基為2號處理:MS+0.2 mg/L IBA+0.1 mg/L NAA。
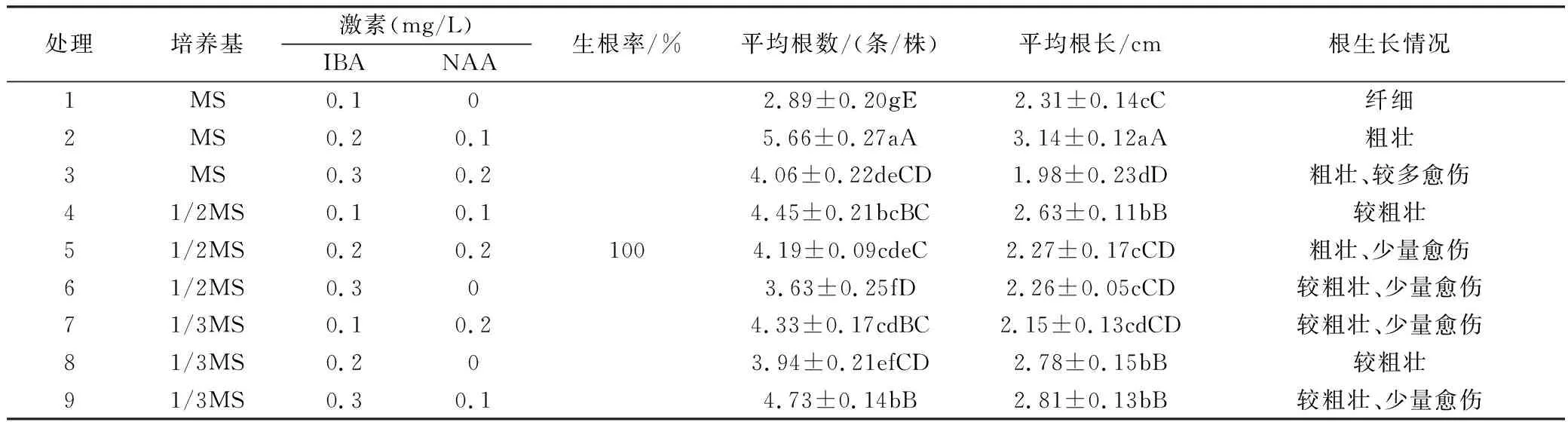
表4 基本培養(yǎng)基、6-BA和NAA對風(fēng)柜斗草試管苗生根的影響
3.5 試管苗煉苗與移栽
生根培養(yǎng)30 d后,將試管苗在溫室大棚進(jìn)行煉苗7 d,前4 d緊閉瓶蓋,后3 d逐漸松蓋,洗凈培養(yǎng)基,0.1%多菌靈浸泡3~5 min,移栽到準(zhǔn)備好的基質(zhì)中,進(jìn)行移栽試驗(yàn)和duncan多重比較。從表5中看出,基質(zhì)對移栽成活率有顯著差異,4號基質(zhì)組合移栽成活率最高,極顯著高于其他基質(zhì)組合,黃泥土越高的基質(zhì)移栽成活率最低且葉色偏黃,營養(yǎng)土中添加少量黃泥土有助于提高移栽成活率,因此風(fēng)柜斗草最佳移栽基質(zhì)為營養(yǎng)土∶黃泥土∶珍珠巖(3∶1∶1),移栽成活率為90.89%,植株長勢好、葉色正常(圖1f)。
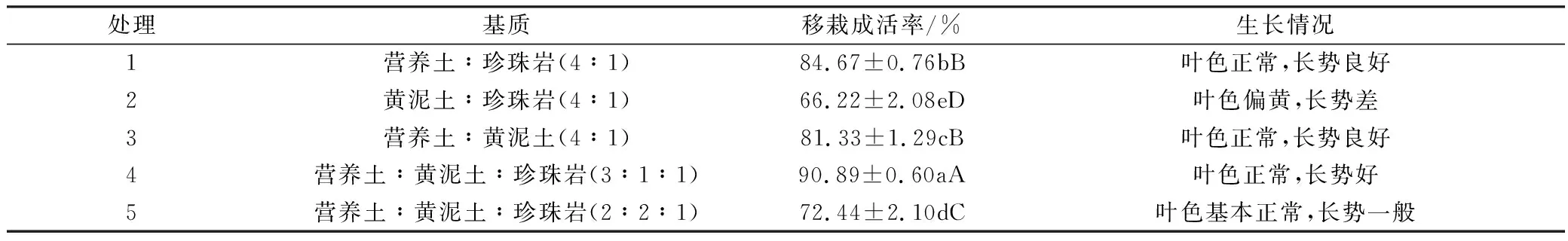
表5 不同基質(zhì)對風(fēng)柜斗草試管苗移栽的影響

圖1 風(fēng)柜斗草莖段組培各階段
4 討論
植物組培技術(shù)能有效的解決藥用植物資源短缺的問題[7]。風(fēng)柜斗草作為福建閩南地區(qū)常用藥用植物,利用組培手段進(jìn)行繁殖可以極大的緩和市場的需求。本研究以MS為基本培養(yǎng)基適合各階段試驗(yàn),MS、1/2 MS、1/3 MS用于生根試驗(yàn)差異性不顯著,與前人研究表明野牡丹科植物適用于MS培養(yǎng)基一致[6]。
6-BA在不定芽誘導(dǎo)和增殖中起重要作用不同培養(yǎng)階段濃度不同,本研究誘導(dǎo)階段最適合濃度為2 mg/L,高于這個(gè)濃度時(shí)產(chǎn)生玻璃化,與高濃度細(xì)胞分裂素會增加黃花倒水蓮玻璃化苗一致[8],同時(shí)附加少量NAA能有效提高誘導(dǎo)率。在增殖階段6-BA最適濃度為1.5 mg/L,濃度越高增殖系數(shù)反而降低,且易產(chǎn)生畸形芽,與樟樹莖段叢生芽增殖試驗(yàn)結(jié)論一致[9].分裂素與生長素配比協(xié)調(diào)能提高叢生芽增殖系數(shù),并提高芽苗質(zhì)量[10],本研究中1.5 mg/L 6-BA與0.1 mg/L NAA配比處理的叢生芽增殖系數(shù)極顯著的高于未添加NAA處理,且芽苗生長良好;NAA濃度提高時(shí),增殖系數(shù)和不定芽質(zhì)量均下降。
風(fēng)柜斗草與同科其他植物一樣易生根,但在添加生長素處理中,根的數(shù)量、長度和質(zhì)量有明顯的提高,本研究各處理生根率都在100%,添加0.2 mg/L IBA與0.1 mg/L NAA激素培養(yǎng)基中根的數(shù)量、長度和根質(zhì)量都顯著高于其他處理,但濃度過高將影響根的生長、產(chǎn)生愈傷和降低根的質(zhì)量,這與大麗花組培苗快繁生根試驗(yàn)結(jié)論一致[11]。不同移栽基質(zhì)對風(fēng)柜斗草移栽成活率和植株生長有顯著影響。研究表明營養(yǎng)土中添加適當(dāng)比例的黃泥土有助于植株生長,本研究得出最適宜基質(zhì)為營養(yǎng)土∶黃泥土∶珍珠巖(3∶1∶1),移栽成活率最高,植株長勢好。但過高比例影響植株生長,這與黃泥土的透氣性差、易板結(jié)等性質(zhì)有關(guān),與黃花倒水蓮移栽試驗(yàn)結(jié)論一致[8]。
因此以莖段為外植體,通過誘導(dǎo)獲得無菌苗、不定芽增殖、生根和煉苗移栽等階段建立風(fēng)柜斗草組培快繁體系,為實(shí)現(xiàn)工廠化育苗提供技術(shù)保障。

