銀耳多糖抗B16 黑色素瘤肺轉移的作用及機理研究*
蘇巧玲,李秀敏
閩南師范大學 菌物產業工程技術中心,福建漳州363000
黑色素瘤是一種惡性程度很高的腫瘤[1],由異常黑色素細胞過度增生引發的皮膚腫瘤,具有惡性程度高、死亡率高的特點,且發病率逐年上升,主要表現為皮膚色素痣的形態和顏色改變,容易發生侵襲轉移,可發生骨轉移、肺轉移等[2]。相關研究顯示,黑色素瘤目前的發病機制尚不明確,如果患者長時間在日光紫外線中暴露,會增加患黑色素瘤的風險[3]。黑色素瘤發病較為隱匿,并且轉移時間早,容易復發,部分患者存在放、化療抵抗,因此死亡率較高[4]。尋找高效低毒的天然產物對改善黑色素瘤的治療是十分有意義的。
腫瘤轉移是一個多環節、多因子參與的連續的、復雜的過程,經過不斷增殖最終形成轉移灶。與自發轉移模型相比,將B16 黑色素瘤細胞注射到鼠尾靜脈減少腫瘤發展的中間狀態,因其可重復性和評估抗轉移效果的時間經濟性而被廣泛應用于實驗研究[3]。
銀耳別名雪耳、白木耳等,從古至今素有“菌中之冠”的美譽,是我國廣泛種植的一種可食用菌,營養價值高,具有較高的藥用價值[5]。銀耳多糖是銀耳真菌子實體中最主要的生物活性成分,占銀耳干重的70%~75%。研究證實,銀耳多糖為雜多糖,其主鏈是由α-(1-3)-糖苷鍵組成的甘露聚糖,主鏈的2、4、6 位上連接有葡萄糖、木糖、巖藻糖及糖醛酸等殘基組成的側鏈,其活性中心為α-(1-3)-甘露聚糖[6]。其常見的功效有免疫調節、降糖降脂、抗氧化、抗衰老等[7-9]作用。本文旨在研究銀耳多糖對黑色素瘤肺轉移的影響,為進一步闡明銀耳多糖抗黑色素瘤的機制提供一定實驗依據。
1 材料和方法
1.1 實驗材料
銀耳多糖由本中心實驗室依據銀耳多糖的制備、鑒定與含量測定方法[10]提取獲得;小鼠黑色素瘤細胞B16 購自于上海細胞庫;ICR 小鼠,雄性,購自吳氏實驗動物中心(生產質量合格證號:20180004027908)。
1.2 實驗試劑及儀器
碳酸氫鈉(A.R,廣東西隴化工廠);Dulbecco's Phosphate Buffered Saline(博士德);DMEM 培養基(Gibco);TRYPSIN 0.25%(1×)solution(HyClone);胎牛血清(PAN BIOTECH);TRIS(Amresco);甘氨酸(BioFrox);SDS-PAGE 蛋白上樣緩沖液(5×)(博士德);NC 膜(Whatman,protran);寬范圍彩色預染蛋白質Marker(天根);CD206 抗體(abcam);PPARγ抗體(CST);β-Tubulin 抗體(Affinity);PD-1 抗體(Abcam);CD86 抗 體(Abcam);Anti -rabbit IgG(RD);30%Acr-Bis(29∶1)(博士德);WesternBright ECL 化學發光底物(advansta),Annexin V-FITC/PI(meilunbio)。
電子分析天平(島津,日本);立式自動壓力蒸汽滅菌器(ZEALWAY,美國);超低溫冰箱(Thermo Fisher,美國);全波長酶標儀(TECAN,瑞士);常溫高速離心機5810 R(eppendorf,德國);HF safe 生物安全柜(Heal Force);低溫高速離心機(BECKMAN,COULTER);CO2培養箱(ESCO);IX51 倒置顯微鏡(OLYMPUS);MicroPublisherTM5.0 RTV 彩 色CCD攝像頭(OLYMPUS);多維全景流式細胞儀(Merck Millipore(amnis),德國);激光共聚焦顯微鏡(Leica,TCS-SP8,德國)。
1.3 實驗方法
1.3.1 B16 黑色素瘤細胞培養常規培養B16 黑色素瘤細胞,加入DMEM 完全培養基(10%胎牛血清+1%鏈霉素-青霉素),用移液槍輕輕吹打重懸細胞團,調整細胞密度,以8 mL/皿的量接種于Φ100 mm細胞培養皿中,置于37 ℃、5%培養液的培養箱中,待其處于對數生長期將細胞傳代,使細胞生長至70%~80%,分別設置空白對照組、1.25 mg·mL-1TFP 組、2.5 mg·mL-1TFP 組。動物實驗前,棄去培養液,PBS洗凈。加入0.25%胰酶消化液,輕吹培養皿使細胞脫落。用移液管吹打細胞,獲得單細胞懸液。1000 r·min-1離心細胞5 min,用PBS 洗2 遍,計數調整細胞數至5×106個/mL。
1.3.2 流式細胞儀分析①細胞收集:用不含EDTA 的胰酶消化細胞并收集到離心管中,每樣本細胞數為(1~5)×106/mL,2000 r·min-1離心3 min,棄去培養液;②用孵育緩沖液洗滌1 次,2000 r·min-1離心3 min;③用100 μL 的標記溶液重懸細胞,室溫下避光孵育10~15 min;④2000 r·min-1離心3 min 沉淀細胞孵育,緩沖液洗1 次;⑤加入熒光溶液,4 ℃下孵育20 min,避光并不時振動;⑥流式細胞儀分析:流式細胞儀激發光波長用488 nm,CH02 檢測FITC 熒光,CH05 檢測PI;⑦結果判斷:在雙變量流式細胞儀的散點圖上,左下象限顯示活細胞,為(AnnexinV-FITC-/PI-);左上象限是壞死細胞,為(AnnexinV-FITC-/PI+);右下象限為早期凋亡細胞,顯現(AnnexinV-FITC+/PI-),右上象限為晚期凋亡細胞,顯示為(AnnexinV-FITC+/PI+)。
1.3.3 實驗性肺轉移小鼠模型的建立4 周齡ICR小鼠(SPF 級),雄性,于(20±2)℃飼養,相對濕度50%~60%,黑暗光周期12 h,小鼠可隨意餐食以及飲水。
將小鼠隨機分成3 組,每組8 只,具體實驗方案如表1 所示。

表1 動物實驗方案
接種后,每天觀察腫瘤生長情況,連續觀察20天后,斷食、不斷水過夜,第二天解剖完整分離成形腫瘤,觀察腫瘤大體病理特征后,通過后續的蛋白質印記分析、HE 染色以及免疫熒光等觀察腫瘤病理學特點,其中4 只小鼠用來進行WB 檢測,4 只用來進行HE 染色和免疫熒光。
1.3.4 Western Blot 檢測巨噬細胞分型及PPARγ表達將上述收集的肺組織加入RIPA 裂解液,用組織勻漿器勻漿1 min,冰浴振蕩30 min 左右,于4 ℃、12000 r·min-1離心10 min,收集上清液。
蛋白樣品經濃度測定調成一致和變性后,根據所測目的蛋白的分子量大小選擇凝膠濃度為10%分離膠;電泳后轉膜,濕轉法將蛋白轉至NC 膜,5%脫脂奶粉封閉1 h。按1∶1000 稀釋一抗,于4 ℃搖床孵育過夜。
經TBST 清洗后,以1∶5000 稀釋二抗,室溫孵育1 h,利用化學發光成像系統,對蛋白條帶信號強度進行觀察分析。
1.3.5 HE 染色①腫瘤組織脫水包埋后,切成4微米薄片,貼附于載玻片上,42 ℃烘箱過夜;②將切片置于烘箱中,60 ℃烘烤1 h;③脫蠟,梯度酒精復水;④脫蠟結束后,將切片浸泡在蒸餾水中,搖床上緩慢搖洗4 min,以洗凈酒精;⑤蘇木素染細胞核:蘇木素染液染2 min,流水沖洗6 min;⑥1%的鹽酸酒精分化后進行伊紅染色:伊紅染色3 min,流水沖洗6 min;⑦脫水封片:將切片依次放入70%、80%、95%乙醇溶液;無水乙醇溶液;乙醇∶二甲苯=1∶1 的混合液;二甲苯溶液后,晾干中性樹膠封片;⑧使用顯微鏡觀察,并在目鏡10×,物鏡20×下拍照。
1.3.6 免疫熒光染色檢測巨噬細胞分型及PPARγ表達①~④石蠟切片脫蠟的過程同HE 染色;⑤抗原修復:將切片置于檸檬酸修復液中,微波爐中高火加熱5 min;⑥將修復過的組織切片迅速放入預熱的蒸餾水中,涼至室溫,搖洗4 min,再換成PBS緩沖液搖洗2 次;⑦3% H2O2滴到切片上,濕盒中避光反應,以除去內源性過氧化氫酶;⑧加入0.1%tritonX-100 穿膜,室溫穿膜10 min,PBS 搖洗3 次;⑨山羊血清封閉:山羊血清,室溫封閉1 h,PBS 緩沖液搖洗5 次;⑩一抗孵育:切片滴加一抗(1∶100),置于濕盒內,4 ℃孵育過夜;11○二抗孵育:切片滴加熒光二抗(1∶200),室溫避光孵育60 min;12○DAPI 染核:切片滴加DAPI 染液(1∶5000),避光室溫孵育5 min;13○封片:切片滴加適量防熒光淬滅劑(40~50 μL/玻片),室溫過夜封片;14○使用激光共聚焦顯微鏡觀察,并在目鏡10×,油鏡63×下拍照;15○用Image J 統計分析CD86 熒光強度。
1.4 統計學方法
2 結果與討論
2.1 TFP 對B16 凋亡的影響
首先對各組細胞的凋亡情況進行檢測,由圖1可知,1.25 mg·mL-1的TFP 可上調B16 細胞的晚期凋亡細胞數,對早期凋亡和死亡細胞比例無明顯影響;2.5 mg·mL-1的TFP 可上調B16 細胞晚期凋亡和死亡細胞數,對早期凋亡細胞比例無明顯影響。

圖1 流式細胞儀檢測TFP 對B16 細胞凋亡的影響
2.2 TFP 抑制B16 肺轉移結節的產生
圖2A 為本實驗的流程圖。實驗發現模型組與TFP 處理組相比體重變化趨勢相似(圖2B),無顯著性差異。靜脈注射20 天后,收集樣本,肉眼觀察發現,模型小鼠肺內布滿黑色素腫瘤結節,且體積較大;而1.25 和2.5 mg·mL-1TFP 組小鼠肺內腫瘤結節轉移明顯少于模型組,有些甚至沒有可見的腫瘤結節(圖2C),表明TFP 可顯著抑制B16 細胞轉移作用。臟器濕重可以體現臟器損傷程度,臟器越重表明黑色素腫瘤轉移越多。單因素方差分析各臟器重量顯示,肺濕重3 組間有顯著性差異(F(2,10)=4.309,P=0.049,P<0.05),兩組間的多重比較采用LSD 事后分析。結果表明,與模型組比較,TFP 1.25 mg·mL-1和TFP 2.5 mg·mL-1組肺濕重顯著降低(P=0.046,P<0.05;P=0.024,P<0.05)。而其它臟器濕重間無顯著性差異。這些結果表明,不同劑量TFP 給藥后的B16 黑色素瘤細胞轉移能力下降,在一定程度上降低肺損傷。
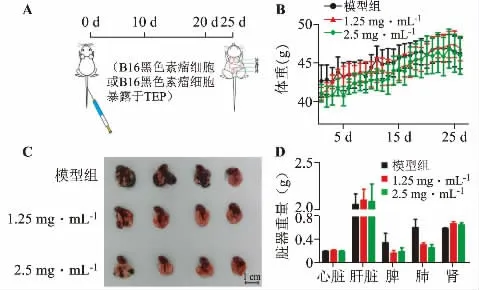
圖2 TFP 抑制小鼠黑色素瘤的肺轉移結節的發生發展(n=8)
2.3 HE 染色檢測肺組織病理情況
如圖3 所示,肺組織HE 染色結果顯示,模型組肺組織切片中有較大范圍的黑色素瘤細胞沉積(紅色箭頭所示),肺泡結構被破壞,正常肺泡數目顯著減少;TFP 1.25 mg·mL-1和TFP 2.5 mg·mL-1組肺組織切片基本呈現正常的肺泡結構,并且沒有明顯的黑色素瘤細胞沉積。
2.4 TFP 對巨噬細胞分型的影響
如圖4A 所示,TFP 1.25mg·mL-1和TFP 2.5mg·mL-1組與模型組相比,CD206(巨噬細胞Ⅱ型標志)表達有顯著上調趨勢;免疫熒光圖4B 的結果顯示,TFP 1.25 mg·mL-1組和TFP 2.5 mg·mL-1組與模型組相比,CD86(巨噬細胞Ⅰ型標志)表達有明顯上調趨勢。這些結果表明,經TFP 作用后的B16 細胞轉移至肺后,可刺激小鼠肺泡巨噬細胞向轉移瘤處募集,CD86 和CD206 的表達均顯著上調;而對CD86的上調顯著強于對CD206 的上調(圖4A、4C),表明對M1 型和M2 型巨噬細胞的招募差異,并且以M1型巨噬細胞為主,M1 型巨噬細胞通過分泌促炎細胞因子和趨化因子,并專職提呈抗原,參與正向免疫應答,發揮免疫監視的功能。
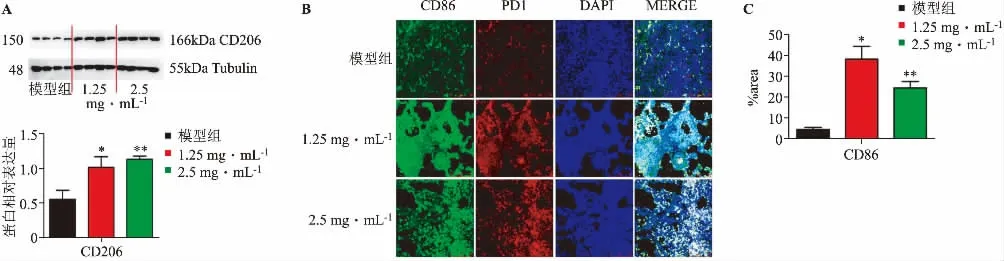
圖4 TFP 促進M1 型巨噬細胞浸潤(n=4)
PD1 是免疫球蛋白B7 家族的成員之一,常表達于T 細胞、B 細胞、自然殺傷(NK)細胞等免疫細胞的細胞膜,也表達于腫瘤細胞。模型組中PD1 的表達不完全與CD86 共定位,不共定位的PD1 上調表明模型組的B16 黑色素瘤細胞表達PD1。TFP 1.25 mg·mL-1組和TF P2.5 mg·mL-1組與模型組相比,PD1 表達與CD86 有較好的共定位且呈上調趨勢,表明TFP 作用后的B16 細胞有招募I 型巨噬細胞的作用;但基本不存在不與CD86 共定位的PD1,表明TFP 抑制PD1 在腫瘤細胞上的表達。以上結果說明TFP 通過下調腫瘤細胞的PD1,抑制與PDL1 的結合,從而抑制腫瘤細胞的免疫逃逸。以上結果說明,TFP 可促進巨噬細胞浸潤,且以I 型巨噬細胞為主。
2.5 TFP 對PPARγ 蛋白的調節作用
PPAR 是一種配體依賴的轉錄子,其功能廣泛,可分為PPARα、PPARδ、PPARγ 3個亞群,其中PPARα、PPARγ 與炎癥反應關系十分密切,在人和小鼠單核巨噬細胞中廣泛表達,并抑制巨噬細胞內促炎基因的表達。PPAR 被認為具有阻止巨噬細胞向M1 型極化的作用;PPARγ 的表達能被IL-4 及IL-13 誘導,這提示PPAR 參與M2 的極化過程,PPAR 可以與PPARγ 輔助活化因子1β 共同作用直接調節M2 型標志物Arg1 的表達水平,使用巨噬細胞敲除PPARγ 的小鼠,發現PPARγ 對于M2 型巨噬細胞的成熟是不可或缺的。
如圖5A 所示,WB 檢測結果顯示TFP 1.25 mg·mL-1組和TFP 2.5 mg·mL-1組PPARγ 蛋白有下調趨勢,并且與模型組相比,有顯著性差異。
如圖5B 所示,模型組肺切片中PPARγ 蛋白的表達呈上調趨勢,且部分PPARγ 蛋白染色與核染色重疊,表明部分PPARγ 蛋白有入核,處于激活狀態;而TFP 1.25 mg·mL-1組和TFP 2.5 mg·mL-1組PPARγ 蛋白有明顯下調趨勢,且PPARγ 蛋白入核比較少,說明PPARγ 蛋白處于失活狀態。
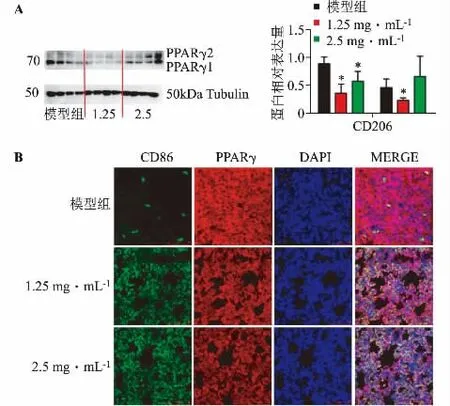
圖5 TFP 下調PPARγ 的表達(n=4)
經TFP 作用后的B16 細胞,下調PPARγ 的表達,并使之處于失活狀態,招募巨噬細胞到達腫瘤細胞聚集的部位;而模型組上調并激活PPARγ,發揮抗炎作用,表現為巨噬細胞較少被招募在腫瘤細胞聚集的部位,腫瘤細胞不斷增殖分裂,從而影響正常肺功能。
3 結論
免疫和炎癥構成腫瘤微環境的基本特征。腫瘤微環境中數量最多的免疫細胞是巨噬細胞,在體內不同微環境的影響下,可極化為M1 型、M2 型巨噬細胞。M1 型巨噬細胞吞噬和抗原提呈能力較強,也可直接吞噬和殺傷病原微生物和腫瘤細胞,并分泌促炎細胞因子和趨化因子,參與免疫應答,發揮免疫監視的功能;M2 型巨噬細胞抗原提呈能力較低,并通過分泌抑制性細胞因子,下調免疫應答,介導腫瘤的免疫逃逸,在腫瘤的發展、浸潤和轉移過程中發揮重要作用。
本研究的模型設計是介于預防治療和接種后治療的一種方法,用于檢測腫瘤細胞在動物體內分化以及對腫瘤微環境中免疫細胞的影響。這種方法是細胞實驗的延續,把細胞實驗和體內腫瘤微環境變化聯系在一起,可觀察腫瘤細胞在體內的進一步發展,以及該變化對免疫細胞的影響。這種方法可用于藥物前期篩選,具有一定的創新性和可行性。
綜上所述,銀耳多糖能顯著下調B16 小鼠黑色素瘤細胞中PPARγ 的表達并抑制其活性,招募巨噬細胞到小鼠肺組織,并以M1 型的巨噬細胞浸潤為主,M1 型巨噬細胞可分泌大量促炎物質,從而發揮炎癥反應和免疫防御作用。

