多模態超聲組學在乳腺癌術前診斷中的研究進展
周 瑾,常 才,周世崇
復旦大學附屬腫瘤醫院超聲科,復旦大學上海醫學院腫瘤學系,上海 200032
乳腺癌為全球第一大癌癥,也是女性最常見的惡性腫瘤[1]。乳腺癌早期診斷為其治療及預后的重要影響因素。由于中國人群致密型乳腺比例高,乳腺癌發病人群較年輕,超聲成為中國乳腺檢查的首選方式。隨著超聲技術的發展,乳腺檢查有二維成像、彩色多普勒成像、彈性成像等多種手段。但超聲檢查具有很強的主觀性和操作者依賴性。近年來,隨著人工智能(artificial intelligence,AI)的發展,人們將AI應用到醫學圖像的處理當中,并稱其為影像組學。影像組學能夠挖掘并客觀、定量地分析圖像微觀特征,彌補超聲檢查的缺點,將影像組學方法應用于超聲圖像中則為超聲組學。目前超聲組學的研究相對較少,本文對多種模態的超聲組學在乳腺癌診斷中的研究進展進行了綜述。
1 影像組學
影像組學是將數字醫學圖像轉換為高維度、可挖掘數據的過程,它包含一階、二階和高階統計,涉及高通量提取大量的定量成像特征,在腫瘤診斷、預后和治療領域中日益發展壯大[2-3]。影像組學分為傳統影像組學(伴或不伴機器學習)和深度學習(deep learning,DL)影像組學[4],目前所說的影像組學一般指傳統影像組學。
傳統影像組學的流程為圖像獲取—圖像分割—特征提取—特征篩選—統計分類及模型建立(圖1a)。圖像分割分為手動、半自動和自動分割,該方法主要適用于分辨率高、輪廓清晰的計算機體層成像(computed tomography,CT)和磁共振成像(magnetic resonance imaging,MRI)圖像。圖像特征提取一般依賴于醫師的經驗、影像學知識來人為定義特征并按照特定的算法進行提取。模型建立采用統計學模型(如單因素、多因素分析)或機器學習方法(如隨機森林、支持向量機等)。傳統影像組學的特點是需要圖像分割和人為定義特征。
DL影像組學的流程為將重建圖像直接輸入后,由多個神經網絡層自動進行特征的提取、篩選和分類,然后將圖像特征發送到標準監督機器學習獲得所需預測模型(圖1b)。卷積神經網絡(convolutional neural network,CNN)為最常用的方法。DL的特點是不需要人為預先定義和提取特征,該方法所提取的定量特征數要比人工定義特征的算法多幾個數量級。雖然CNN具有顯著的自動化程度和應用于多模態成像的靈活性,但整個過程處于“黑匣子”中,其透明度和可解釋性仍有待研究。
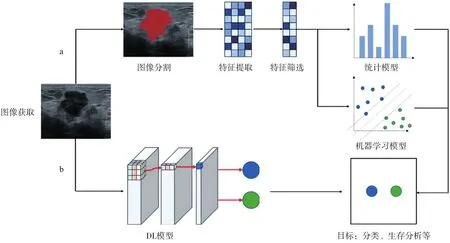
圖1 影像組學工作流程圖
2 乳腺癌診斷
目前超聲組學關于乳腺腫瘤良惡性辨別的研究多集中在二維超聲上,也有基于彈性超聲等單一模型或基于多模態超聲的模型,但較少與臨床特征融合。
2.1 二維超聲
既往研究[5-10]顯示,二維超聲組學模型對乳腺腫瘤的鑒別能力良好,多認為其能力與專家組相當,其中DL模型表現更佳,曲線下面積(area under curve,AUC)一般大于0.9。一項前瞻性研究[11]顯示,將基于DL框架的計算機輔助診斷系統的結果添加到超聲圖像后再由醫師閱片,顯著改善了醫師診斷乳腺腫瘤的特異度、準確度和陽性預測值。肖榕等[5]采用傳統影像組學方法選出15個組學特征,其對乳腺腫瘤的良惡性鑒別能力與年資10~12年的醫師相當(AUC為0.840vs0.825)。Moon等[7]的一項大數據回顧性研究利用CNN建立診斷乳腺腫瘤的計算機輔助系統,其AUC為0.971,并提示更多的圖像信息可提高系統預測性能,且腫瘤形狀特征可以提高診斷效果。Zhu等[9]的研究中有一個DL模型的AUC略低(0.875),但該模型基于甲狀腺癌和乳腺癌超聲表現相似的特點,采用轉移學習和相同的架構參數設置成功地建立了可以鑒別兩種癌癥的模型,且其乳腺癌診斷效能也優于超聲科醫師。
臨床上乳腺影像報告和數據系統(Breast Imaging Reporting and Data System,BI-RADS)評分4、5類結節為可疑惡性,需要通過穿刺活檢或手術才能明確,所以此類結節的超聲組學研究更具臨床意義。既往研究[12]采用傳統影像組學方法篩選出9個相關特征建立組學評分,對BIRADS 4類乳腺腫瘤具有良好的鑒別能力(AUC為0.810)。還有研究[13-14]將超聲組學特征和BIRADS評分相結合,預測能力有所提高(AUC為0.87~0.928),Kim等[14]的研究顯示,基于DL的諾莫圖可降低BI-RADS評分的假陽性率(97%vs45%),卻不影響靈敏度。
影像組學能挖掘人眼不能識別的特征,使二維超聲不易識別的乳腺腫瘤的良惡性鑒別成為可能。張宇等[15]的研究顯示,伴髓樣特征的乳腺癌與纖維腺瘤相比有更大的縱橫比和凹性率,更小的灰度均值、相關性和同質性。Lee等[16]開發的影像組學評分對三陰性乳腺癌(triple negative breast cancer,TNBC)和乳腺纖維腺瘤具有良好的鑒別能力,甚至對BI-RADS 3和4A類的結節也具有較好的鑒別能力。有研究[17]顯示,超聲組學方法鑒別良惡性腫瘤的能力略高于BI-RADS評分(AUC為0.91vs0.84),還有研究[18]顯示,其對4A類乳腺腫瘤的鑒別能力略優于放射科醫師(陽性預測值9.3%vs5.7%),但差異均無統計學意義。
2.2 彈性超聲
既往多項研究[19-20]顯示,基于DL的剪切波彈性超聲(shear wave elastography,SWE)組學特征在乳腺腫瘤的診斷上優于SWE定量參數、超聲科醫師讀片(采用5分視覺顏色評估和平均彈性值共識)和BI-RADS評分,且對比了多個CNN架構后,認為最好的為100個輪次的DenseNet169[20]。有研究[21]利用層次聚類和三特征選擇指標篩選應變式彈性超聲的高通量特征,篩選的7個組學特征鑒別乳腺腫瘤的AUC為0.917。Zhou等[22]也采用CNN自動提取超聲彈性影像組學特征,CNN相對于手動勾畫的方法保留了腫瘤周邊的特征,所建立的模型鑒別乳腺腫瘤良惡性的準確度達到95.8%;Zhang等[23]認為用DL架構學習彈性圖像的特征相對量化圖像強度和紋理的統計特征具有更好的分類性能,均佐證了DL處理彈性圖像的優越性。
2.3 自動乳腺超聲(automated breast ultrasonography,ABUS)
ABUS的圖像采集獨立于操作者,可以提供整個乳房的三維視圖,但ABUS圖像閱片非常耗時,可能由于疏忽會出現錯誤。Wang等[24]證明了DL網絡可以用于ABUS閱片,在大大縮短閱片時間的同時還能達到95%的靈敏度,具有良好的乳腺腫瘤鑒別能力(AUC為0.947),且所有超聲科醫師的診斷效能在參考CNN的診斷結果后得到了提升[25]。
2.4 多模態超聲
部分研究[19,26-27]直接顯示,基于二維超聲和彈性超聲的DL特征建立的組合特征模型,其診斷效果優于兩種圖像的單一組學模型(AUC為0.961~1.000)。Youk等[28]經過特征篩選及統計分析發現,3個二維超聲和2個SWE的組學特征與乳腺癌獨立相關,AUC為0.929和0.992。Li等[29]的研究顯示,多模態超聲圖像(二維、SWE和超聲造影)基于帶屬性包的特征篩選方法建立的乳腺腫瘤鑒別模型,其AUC達0.902。一項多中心大數據的研究[30]顯示,基于DL建立的二維-彩色多普勒模型對良性腫瘤、惡性腫瘤、炎性反應性腫塊和腺病的分類AUC分別為0.90、0.91、0.90和0.89,表現明顯優于超聲科醫師。
3 總結與展望
目前研究顯示超聲組學對乳腺腫瘤的診斷效能可媲美超聲專家,多模態超聲組學診斷效能優于單一模態,未來有望作為第二閱片人應用于臨床,提高低年資超聲科醫師的診斷水平。然而目前超聲組學仍具有限制性:① 目前多數為小樣本量、回顧性研究,外部驗證較少,而組學算法的可重復性需要大規模、高質量的前瞻性研究來驗證。② 研究圖像未標準化,如圖像切面、數量及采集設備參數等。③ 各個機構甚至單個機構之間的算法未標準化。

