血清25-羥維生素D3對維持性血液透析患者肌少癥預測價值
封建華,葉建明,郁麗霞,劉其鋒
近年,慢性腎臟病(chronic kidney disease, CKD)發病率呈升高趨勢。流行病學調查顯示,CKD全球患病率為9.1%,我國患病率為10.8%[1-2]。終末期腎臟病為CKD進展過程中不可逆階段,維持性血液透析(MHD)是此階段腎臟替代治療主要方式。有研究發現,MHD患者易發生肌少癥,導致生活質量變差,骨折發生率、住院率和病死率等升高[3]。因此,對MHD患者肌少癥進行預測并早期診斷極為重要。血清25-羥維生素D3[25-(OH)D3]在鈣磷代謝中發揮著重要作用。肌肉細胞表面存在維生素D受體,25-(OH)D3可與該受體結合促進肌肉細胞增殖、分化,并調節肌肉收縮[4]。有研究顯示,25-(OH)D3是老年患者發生肌少癥的影響因素[5]。然而,25-(OH)D3對MHD患者肌少癥是否有預測價值尚需研究。本研究觀察合并肌少癥MHD患者血清25-(OH)D3水平,探討血清25-(OH)D3對MHD患者肌少癥預測價值,現報告如下。
1 對象與方法
1.1研究對象 選取2019年1—6月昆山市第一人民醫院腎內科收治的符合納入及排除標準行MHD 186例,男104例,女82例;年齡(50.83±11.65)歲;原發疾病:慢性腎小球腎炎78例,糖尿病腎病48例,高血壓腎病37例,間質性腎病8例,多囊腎5例,其他10例。按照是否診斷肌少癥將MHD 186例分為肌少癥組(64例)和非肌少癥組(122例)兩組。按照血清25-(OH)D3水平將MHD 186例分為維生素D3(VD3)缺乏組(126例)、VD3不足組(48例)和VD3充足組(12例)3組。本研究經醫院醫學倫理委員會批準同意執行。
1.2納入及排除標準 納入標準:①接受MHD,且透析時間>6個月,透析頻率每周3次,每次4 h;②精神正常,能夠配合MHD;③年齡≥18歲;④患者和(或)其家屬簽署相關知情同意書。排除標準:①近3個月內發生重度感染患者;②近3個月內使用過抗生素、糖皮質激素或免疫抑制劑等患者;③有嚴重心腦血管疾病、其他器官出現過重大疾病或惡性腫瘤患者;④無法進行生物電阻抗試驗或有骨骼肌肉疾病患者;⑤妊娠期婦女。
1.3診斷及分級標準 根據亞洲肌少癥工作組制定的診斷標準[6]對肌少癥進行診斷:①骨骼肌質量指數(SMI):男性<7.0 kg/m2,女性<5.7 kg/m2;②握力:男性<26 kg,女性<18 kg;③4 m步速<0.8 m/s。在滿足上述診斷標準①的基礎上,滿足②和(或)③即可診斷肌少癥。根據以往文獻中相關標準[7]對血清25-(OH)D3水平進行分級:25-(OH)D3<20 ng/ml為VD3缺乏,25-(OH)D320~30 ng/ml為VD3不足,25-(OH)D3≥30 ng/ml為VD3充足。
1.4觀察指標及方法 比較肌少癥組和非肌少癥組一般資料、肌少癥評價指標、實驗室資料及不同血清25-(OH)D3水平MHD 3組肌少癥發病情況、評價指標,分析MHD患者血清25-(OH)D3與其他指標相關性,探討血清25-(OH)D3對MHD患者肌少癥預測價值。①一般資料及實驗室資料:收集MHD患者一般資料,包括性別、年齡、透析齡和體質量等,并計算體質量指數。上機前抽取靜脈血,采用全自動生化分析儀檢測血紅蛋白、白蛋白及血清尿素、肌酐、甲狀旁腺激素、鈣、磷;采用酶聯免疫吸附試驗檢測血清25-(OH)D3。②肌少癥評價指標:使用Tanila MC180人體成分分析儀(日本百利達)采用生物電阻抗試驗測量SMI,以評價肌肉質量。肌肉力量用握力代表,使用CAMRY EH101電子握力器(廣東香山集團)測量慣用手握力。身體活動能力以4 m步速評價,測量2次取平均值。肱三頭肌皮褶厚度:取患者上臂背側肩峰到尺骨鷹嘴連線中點處,用左手拇指和食指將被測部位皮膚和皮下脂肪夾提起來用JK6113皮褶計(北京精凱達儀器有限公司)測量其厚度,測量3次取平均值。上臂圍:取患者上臂尺骨鷹嘴到肩峰連線中點處,繞上臂1周測量周長,測量3次取平均值。
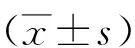
2 結果
2.1肌少癥組和非肌少癥組一般資料、肌少癥評價指標及實驗室資料比較 肌少癥組年齡大于非肌少癥組,SMI、握力、4 m步速、肱三頭肌皮褶厚度、上臂圍、血紅蛋白、白蛋白及血清尿素、肌酐、25-(OH)D3低于非肌少癥組(P<0.05或P<0.01),見表1。

表1 是否診斷肌少癥MHD兩組一般資料、肌少癥評價指標及實驗室資料比較
2.2不同血清25-(OH)D3水平MHD 3組肌少癥發病情況及評價指標比較 3組肌少癥發病率和評價指標總體比較差異均有統計學意義(P<0.05或P<0.01)。與VD3充足組比較,VD3缺乏組肌少癥發病率升高,肌少癥評價指標降低,VD3不足組握力和4 m步速降低;與VD3不足組比較,VD3缺乏組肌少癥評價指標降低(P<0.05)。見表2。

表2 不同血清25-(OH)D3水平MHD 3組肌少癥發病情況及評價指標比較
2.3MHD患者血清25-(OH)D3與其他指標相關性分析 分析MHD患者血清25-(OH)D3與表1中肌少癥組和非肌少癥組比較差異有統計學意義指標的相關性,結果顯示MHD患者血清25-(OH)D3與SMI、4 m步速和肱三頭肌皮褶厚度呈正相關(r=0.454,P<0.001;r=0.473,P<0.001;r=0.381,P=0.001),與握力呈負相關(r=-0.509,P<0.001)。
2.4血清25-(OH)D3對MHD患者肌少癥預測價值 ROC曲線分析結果顯示,血清25-(OH)D3預測MHD患者肌少癥的曲線下面積為0.827(95%CI:0.791,0.865),最佳截斷值為23.15 ng/ml,最佳截斷值下敏感度為83.2%,特異度為77.6%,見圖1。

圖1 血清25-(OH)D3診斷MHD患者肌少癥ROC曲線25-(OH)D3為25-羥維生素D3,MHD為維持性血液透析,ROC為受試者工作特征
3 討論
終末期腎臟病患者行MHD期間會發生貧血、感染、腕管綜合征、心律失常、透析相關骨病和肌少癥等并發癥。MHD患者發生肌少癥時肌肉質量和力量下降,造成跌倒和骨折等風險增加,導致住院率和病死率升高[8]。然而,肌少癥的診斷需要精密儀器及專業人員進行,不宜在臨床特別是基層醫院臨床開展,故尋找MHD患者肌少癥的簡便篩查手段極為重要。
本研究MHD 186例中發生肌少癥64例,這與以往文獻報道[9]基本一致。MHD患者發生肌少癥與多種因素有關:①飲食結構不均衡,蛋白攝入較少,加之長期行MHD機體消耗,易發生肌肉萎縮等;②隨病情發展,尿毒素排泄障礙,導致骨骼肌細胞發生結構性改變,從而易患肌少癥;③體內微炎癥狀態促使肌少癥發生[10];④骨骼肌代謝異常導致肌少癥發生[11]。本研究結果顯示,肌少癥組血紅蛋白、白蛋白及血清尿素、肌酐、25-(OH)D3低于非肌少癥組,可印證以上研究結果。本研究結果還顯示,肌少癥組年齡大于非肌少癥組,分析原因為隨年齡增長,患者骨骼肌流失速度加快,且運動能力下降。
維生素D在鈣磷調節中發揮重要作用,使血清鈣離子濃度增加,提高神經肌肉活性,還可通過與維生素D受體結合,使骨鈣蛋白和骨橋蛋白等生成增加[12]。有研究發現,維生素D水平降低會影響老年人胰島素抵抗穩態,進而促進肌少癥發生[13]。許婷媛等[14]研究發現,老年患者血清維生素D水平降低是肌少癥發生的獨立危險因素。謝易等[15]研究發現血清1,25-二羥維生素D3水平對老年骨質疏松癥患者肌少癥具有預測價值。然而,目前臨床上維生素D對MHD患者肌少癥的預測價值尚不清楚。本研究結果顯示,肌少癥組血清25-(OH)D3低于非肌少癥組;與VD3充足組比較,VD3缺乏組肌少癥發病率升高,肌少癥評價指標降低,VD3不足組握力和4 m步速降低;與VD3不足組比較,VD3缺乏組肌少癥評價指標降低。OKUBO等[16]對肝硬化患者按血清維生素D水平進行分級,發現隨著血清維生素D降低,肌少癥發生率提高,肌少癥相關指標變差,本研究結果與其基本一致。本研究結果還顯示,MHD患者血清25-(OH)D3與SMI、4 m步速和肱三頭肌皮褶厚度呈正相關,與握力呈負相關。提示MHD患者血清25-(OH)D3水平較低時易患肌少癥,且血清25-(OH)D3與肌少癥評價指標相關。
肌少癥診斷難度較大,若血清25-(OH)D3可以預測MHD患者肌少癥發生,則可大大提高MHD患者肌少癥診斷率。檢索以往文獻未發現25-(OH)D3對MHD患者肌少癥預測價值的相關報道。為探討血清25-(OH)D3對MHD患者肌少癥的預測價值,本研究進一步行ROC曲線分析,結果顯示血清25-(OH)D3預測MHD患者肌少癥的曲線下面積為0.827,最佳截斷值為23.15 ng/ml,最佳截斷值下敏感度為83.2%,特異度為77.6%。提示血清25-(OH)D3對MHD患者肌少癥有較好預測價值,當MHD患者血清25-(OH)D3低于23.15 ng/ml時,應警惕肌少癥發生,要及時補充VD3。
總之,血清25-(OH)D3在是否診斷肌少癥MHD患者中存在差異,并與肌少癥評價指標有相關性,對MHD患者肌少癥有較好預測價值。

