miR-625靶向HMGA1對食管癌細胞生物學行為的影響及機制
李大偉,劉 磊
食管癌是消化系統常見惡性腫瘤之一,根據病理類型可分為食管鱗狀細胞癌和食管腺狀細胞癌,約90%的食管癌患者為食管鱗狀細胞癌[1]。隨著醫療技術的不斷發展,臨床在食管癌的診斷和治療方面取得了顯著進步,但食管癌患者預后仍不令人滿意,食管癌發病機制尚有待進一步闡明[2]。微小RNA(miRNA)是一類小核苷酸非編碼RNA短鏈,介導細胞增殖、凋亡和遷移等生命活動,參與腫瘤發生和發展[3]。劉莎莎等[4]研究發現,miR-625在食管鱗狀細胞癌中發揮抑癌基因作用,可能為食管鱗狀細胞癌潛在的治療靶點和預后判斷標志物。高遷移率族蛋白A1(HMGA1)是miR-625的靶基因,ZHOU等[5]研究表明,miR-625可靶向HMGA1抑制乳腺癌細胞的增殖和遷移。然而,miR-625靶向HMGA1對食管癌細胞生物學行為的影響及機制現尚不清楚。因此,本研究探討miR-625靶向HMGA1對食管癌細胞生物學行為的影響及機制,以期為食管癌早期臨床診斷及靶向治療提供理論依據。
1 材料與方法
1.1材料
1.1.1組織和細胞來源:收集2018年3月—2019年3月經手術切除的食管癌組織及癌旁組織(距癌組織≥5 cm)標本各35例,其中男21例,女14例;年齡(63.75±12.36)歲;TNM分期:Ⅰ期4例,Ⅱ期21例,Ⅲ期10例。患者術前均未接受放化療和其他治療,無其他重大疾病史。本研究經醫院醫學倫理委員會審批同意執行。食管癌細胞系KYSE150、KYSE30、ECA109、EC9706和正常食管上皮細胞HET-1A購自中國科學院上海細胞庫。
1.1.2主要試劑:RPMI-1640培養基、胎牛血清(美國Gibco),CCK-8試劑(上海碧云天生物),脂質體2000試劑盒、Trizol試劑、pcDNA3.1載體(美國Invitrogen),SYBR Premix Ex Taq kit(北京寶日醫生物),ECL試劑盒(武漢博士德生物),Cyclin D1(ab16663)、p21(ab188224)、E-cadherin(ab40772)、N-cadherin(ab98952)和Vimentin(ab137321)抗體(美國Abcam),雙熒光素酶報告基因檢測系統(美國Promega)。
1.2實驗方法
1.2.1細胞培養和轉染:以含有10%胎牛血清、100 U/ml青霉素、100 μg/ml鏈霉素的RPMI-1640培養基培養細胞,培養條件為37 ℃、5%CO2。待細胞密度達80%時,添加胰蛋白酶消化細胞,進行傳代培養,取對數生長期細胞進行實驗。采用脂質體2000試劑盒,待細胞密度達60%時,將細胞分為mimic NC組、miR-625 mimic組、inhibitor NC組、miR-625 inhibitor組及pcDNA3.1-HMGA1組、miR-625+HMGA1組,分別進行脂質體轉染,其中mimic NC組加入miR-625 mimic NC質粒,miR-625 mimic組加入miR-625 mimic質粒,inhibitor NC組加入miR-625 mimic NC質粒,miR-625 inhibitor組加入miR-625 inhibitor質粒,pcDNA3.1-HMGA1組加入pcDNA3.1-HMGA1質粒,miR-625+HMGA1組共轉染miR-625 mimic質粒與pcDNA3.1-HMGA1質粒,轉染6 h后更換新鮮培養基繼續培養,轉染過程均嚴格按照脂質體2000試劑盒說明書進行。
1.2.2RT-qPCR檢測miR-625和HMGA1 mRNA表達:取適量組織和細胞,添加Trizol試劑提取總RNA,分析其純度、濃度和完整性,逆轉錄合成cDNA模板鏈,再添加SYBR Premix Ex Taq kit進行RT-qPCR擴增。擴增條件:95 ℃10 min,94 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,共40個循環,最后以72 ℃延伸10 min。miR-625、U6、HMGA1和GADPH引物序列由南京金斯瑞公司提供,以2-ΔΔCt法檢測目的基因表達水平。引物序列miR-625上游:5'-GGCTAGTTCACTCCTCTCCTCC-3',下游:5'-GTGCAGGGTCCAGGT-3';U6上游:5'-CTCGCTTCGGCAGCACA-3',下游:5'-AACGCTTCACGAATTTGCGT-3';HMGA1上游:5'-TCCATTCTTCGACATCCGTCA-3',下游:5'-GATCGTGGGCAGAACAGGAG-3';GADPH上游:5'-CATCAAGAAGGTGGTGAAGCAG-3',下游:5'-GTGTCGCTGTTGAAGTCAGAG-3'。
1.2.3CCK-8實驗檢測細胞增殖:以每孔5000個將細胞接種于96孔板,培養24 h后,添加含有10%CCK-8試劑的培養基,繼續培養1 h,于490 nm處檢測各孔細胞的OD值。
1.2.4流式細胞儀檢測細胞周期:收集培養好的細胞重懸于PBS緩沖液中,加入RNA酶,室溫下孵育15 min,加入PI染液,室溫下避光孵育30 min,過濾后上流式細胞儀檢測細胞周期。
1.2.5Transwell小室實驗檢測細胞侵襲:預先將基質膠鋪于Transwell小室上室,將5×104個細胞接種于上室,下室中添加含20%胎牛血清培養基,正常培養24 h后,用棉簽拭去上膜表面細胞,置于甲醇中固定,結晶紫染色后,光鏡下觀察并計數。
1.2.6劃痕實驗檢測細胞遷移:將1×105個細胞接種于6孔板,待細胞密度達100%時,用1 ml槍頭垂直孔底于培養孔中軸劃線,沖洗脫落細胞,于0和24 h時,光鏡下觀察并拍攝細胞劃痕愈合情況。
1.2.7Western blot檢測相關蛋白表達:將培養好的細胞加入RIPA裂解液,冰上裂解30 min,4 ℃下12 000 r/min離心10 min,取上層蛋白液檢測濃度,配制10% SDS-PAGE凝膠,每孔加等量蛋白樣完全分離后,取出蛋白膠濕轉至PVDF膜,分別孵育封閉液(含5%脫脂奶粉)、一抗(1∶1000)和二抗(1∶5000),采用ECL試劑盒行化學發光顯影。
1.2.8雙熒光素酶報告基因檢測驗證靶向關系:經生物信息學軟件Target Scan在線預測miR-625靶基因,構建含有HMGA1基因野生型(WT)3' 端非編碼區(3' UTR)和突變型(MUT)3' UTR片段,并插入質粒載體。分別將miR-625 mimic、mimic-NC、HMGA1 3' UTR WT和HMGA1 3' UTR MUT質粒共轉染細胞,6 h后更換為含10%胎牛血清培養基,繼續培養36 h,檢測各孔熒光素酶活性(相對熒光素酶活性=螢火蟲熒光素酶活性值/海腎熒光素酶活性值)。
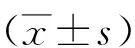
2 結果
2.1不同組織及細胞中miR-625表達 miR-625相對表達量,食管癌組織低于癌旁組織,食管癌細胞系KYSE150、KYSE30、ECA109、EC9706低于正常食管上皮細胞HET-1A;miR-625 mimic組較mimic NC組升高,miR-625 inhibitor組較inhibitor NC組降低(P<0.05)。見圖1。
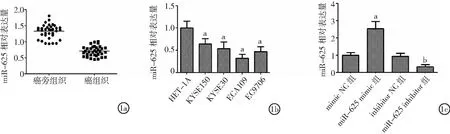
圖1 食管癌組織及細胞中miR-625表達1a.不同食管組織中miR-625的表達,1b.不同食管細胞中miR-625的表達,1c.轉染miR-625 mimic和miR-625 inhibitor對ECA109細胞中miR-625表達的影響;與HET-1A和mimic NC組比較,aP<0.05;與inhibitor NC組比較,bP<0.05
2.2miR-625表達對ECA109細胞增殖和周期影響 與mimic NC組比較,miR-625 mimic組細胞增殖能力、處于S期細胞比例和Cyclin D1表達降低,處于G1期細胞比例和p21表達升高(P<0.05)。與inhibitor NC組比較,miR-625 inhibitor組細胞增殖能力、處于G2期細胞比例和Cyclin D1表達升高,處于G1期細胞比例和p21表達降低(P<0.05)。見圖2。
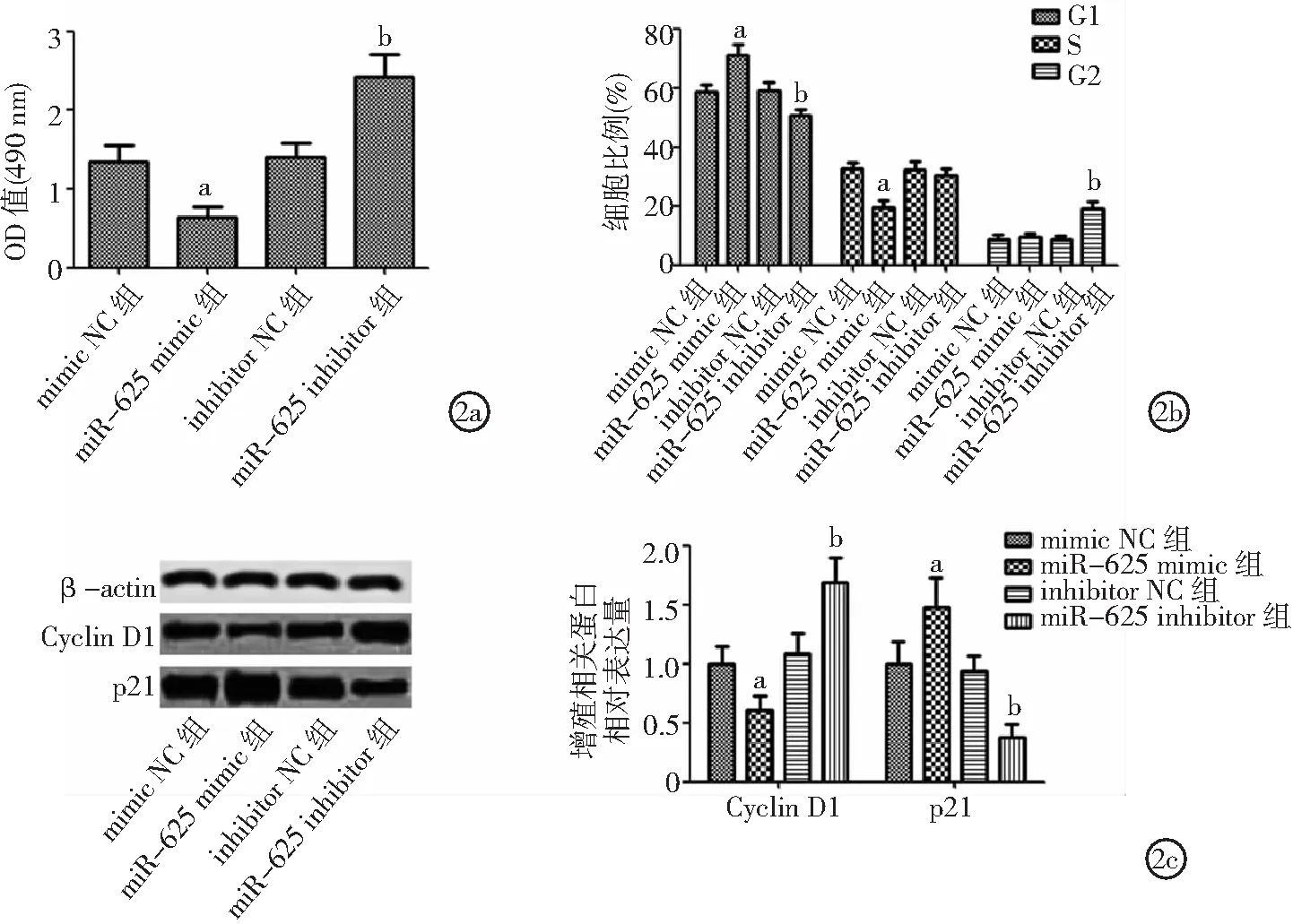
圖2 miR-625表達對ECA109細胞增殖和周期影響2a.miR-625表達對ECA109細胞增殖的影響,2b.miR-625表達對ECA109細胞周期的影響,2c.miR-625表達對ECA109細胞增殖相關蛋白表達的影響;與mimic NC組比較,aP<0.05;與inhibitor NC組比較,bP<0.05
2.3miR-625表達對ECA109細胞侵襲和遷移影響 與mimic NC組比較,miR-625 mimic組細胞侵襲、遷移能力和N-cadherin、Vimentin表達降低,E-cadherin表達升高(P<0.05)。與inhibitor NC組比較,miR-625 inhibitor組細胞侵襲、遷移能力和N-cadherin、Vimentin表達升高,E-cadherin表達降低(P<0.05)。見圖3。
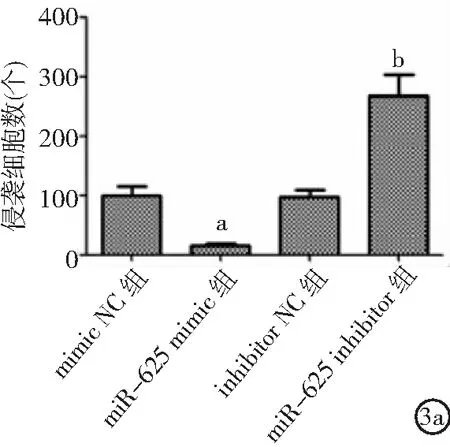
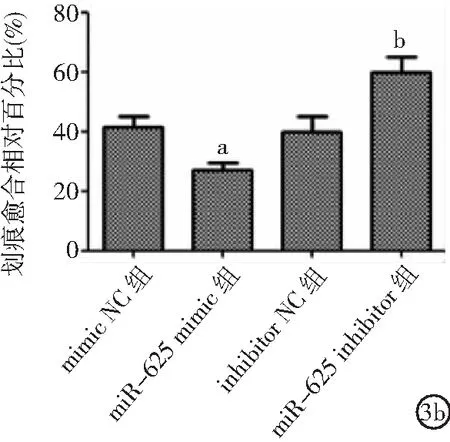
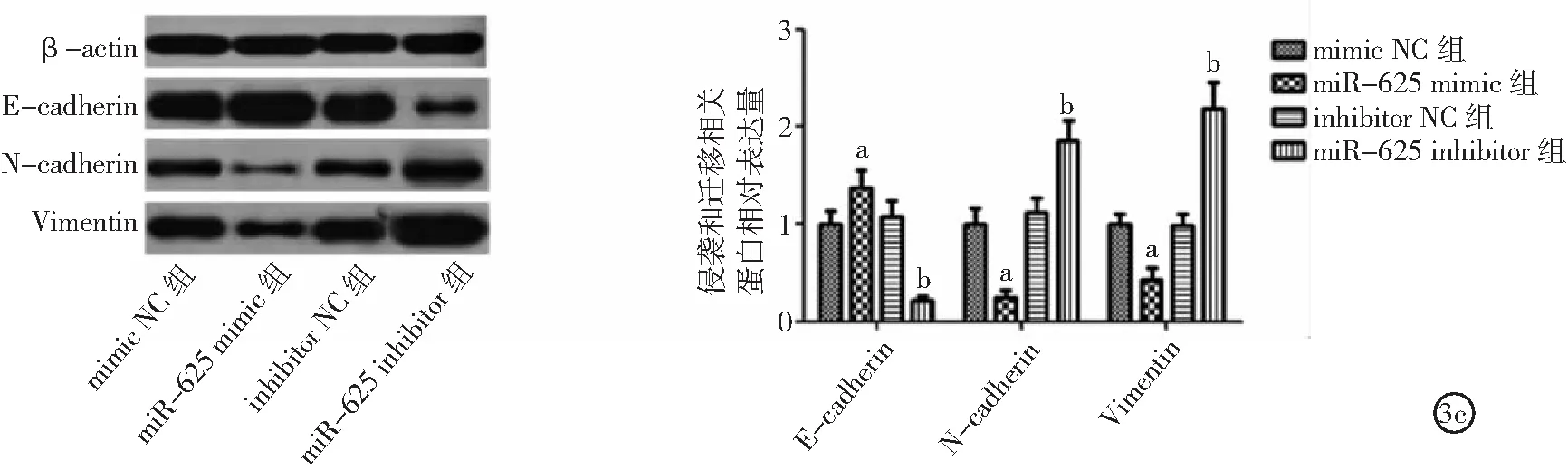
圖3 miR-625表達對ECA109細胞侵襲和遷移影響3a.miR-625表達對ECA109細胞侵襲的影響,3b.miR-625表達對ECA109細胞遷移的影響,3c.miR-625表達對ECA109細胞侵襲和遷移相關蛋白表達的影響;與mimic NC組比較,aP<0.05;與inhibitor NC組比較,bP<0.05
2.4miR-625與HMGA1靶向關系 miR-625與HMGA1 3' UTR存在結合位點,見圖4。與mimic NC組比較,miR-625 mimic組細胞中相對熒光素酶活性降低(P<0.05),見圖5。與mimic NC組比較,miR-625 mimic組HMGA1表達降低,pcDNA3.1-HMGA1組HMGA1表達升高;與pcDNA3.1-HMGA1組比較,miR-625+HMGA1組HMGA1表達降低(P<0.05),見圖6。
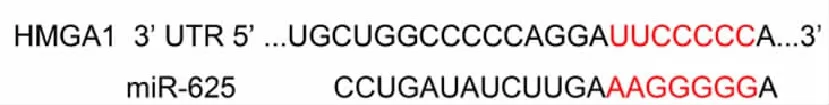
圖4 miR-625與HMGA1 3' UTR結合位點HMGA1為高遷移率族蛋白A1,3' UTR為3' 端非編碼區
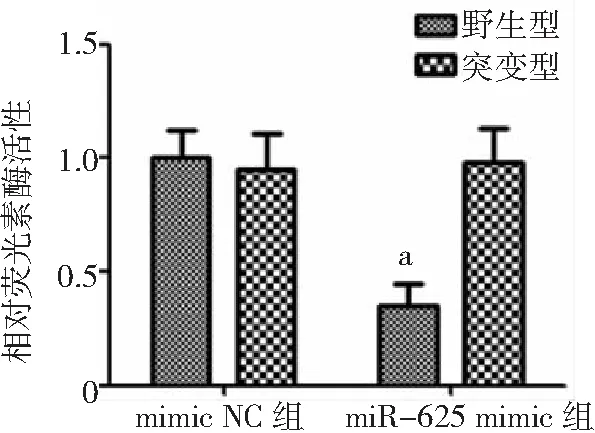
圖5 雙熒光素酶報告基因檢測結果與mimic NC組比較,aP<0.05
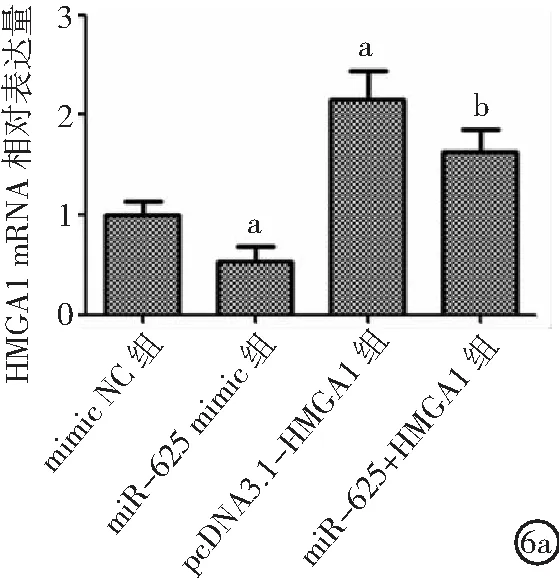
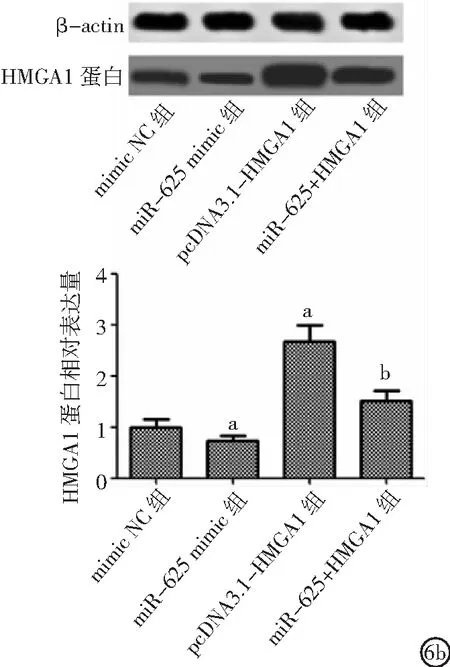
圖6 miR-625對細胞中HMGA1表達影響HMGA1為高遷移率族蛋白A1;6a.miR-625對細胞中HMGA1 mRNA表達的影響,6b.miR-625對細胞中HMGA1 蛋白表達的影響;與mimic NC組比較,aP<0.05;與pcDNA3.1-HMGA1組比較,bP<0.05
2.5miR-625靶向HMGA1對ECA109細胞影響 與mimic NC組比較,miR-625 mimic組細胞增殖、侵襲、遷移能力及處于S期細胞比例降低,處于G1期細胞比例增加;pcDNA3.1-HMGA1組細胞增殖、侵襲、遷移能力及處于G2期細胞比例升高,處于G1期細胞比例降低(P<0.05)。與pcDNA3.1-HMGA1組比較,miR-625+HMGA1組細胞增殖、侵襲及遷移能力降低,處于G1期細胞比例升高(P<0.05)。見圖7。
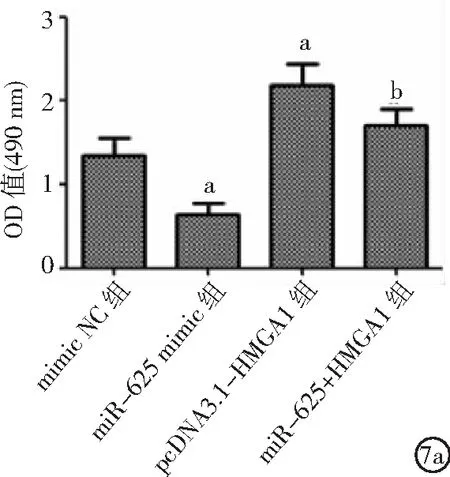
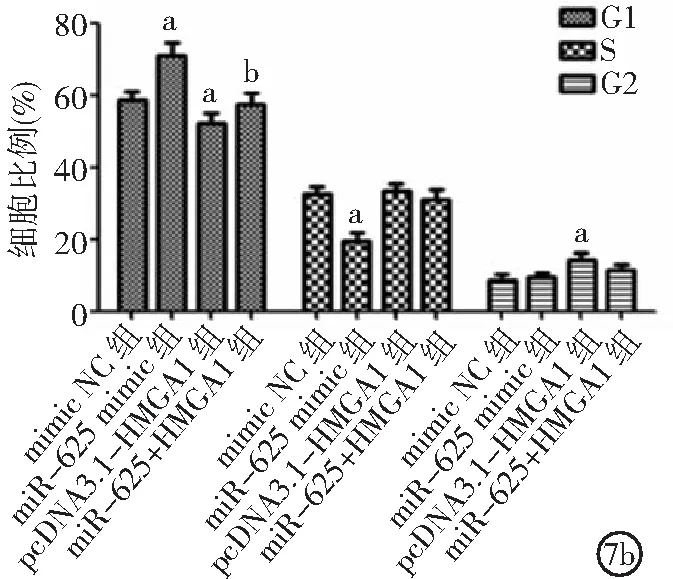
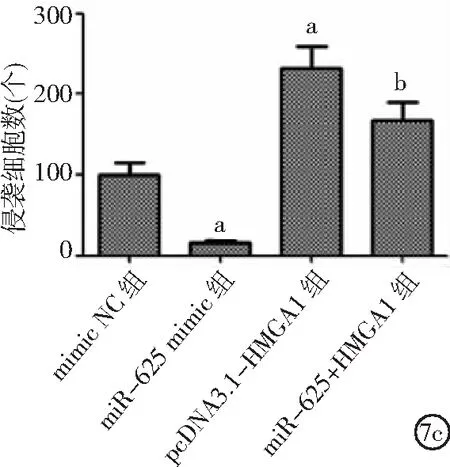
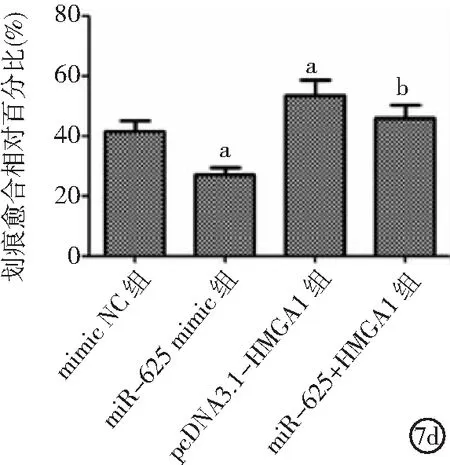
圖7 miR-625靶向HMGA1對ECA109細胞影響HMGA1為高遷移率族蛋白A1;7a.miR-625靶向HMGA1對ECA109細胞增殖的影響,7b.miR-625靶向HMGA1對ECA109細胞周期的影響,7c.miR-625靶向HMGA1對ECA109細胞侵襲的影響,7d.miR-625靶向HMGA1對ECA109細胞遷移的影響;與mimic NC組比較,aP<0.05;與pcDNA3.1-HMGA1組比較,bP<0.05
3 討論
大量研究報道,多種miRNA在食管癌中呈異常表達,這種異常表達可能調控細胞多種病理生理學行為,參與食管癌的發生和發展[6]。ZHANG等[7]分析食管癌臨床樣本,發現miR-145在食管癌中表達上調,體外實驗發現miR-145促進食管癌細胞的增殖和遷移,可能與靶向調控SMAD5表達有關。LANG等[8]研究發現,miR-486作為腫瘤抑制因子,可靶向調控CDK4/BCAS2抑制食管癌細胞的生長和轉移。miR-625在食管癌中也發揮抑癌基因作用。本研究結果顯示,miR-625相對表達量,食管癌組織低于癌旁組織,食管癌細胞系KYSE150、KYSE30、ECA109、EC9706低于正常食管上皮細胞HET-1A。WANG等[9]收集158例食管癌組織樣本,檢測顯示miR-625在食管癌組織中表達低于正常組織,分析原因可能為靶向抑制Sox2表達,減弱食管癌細胞的增殖和侵襲。然而,miR-625是否可靶向其他基因作用于食管癌,仍有待深入分析。
惡性增殖、侵襲及轉移是惡性腫瘤的重要生物學特征,本研究通過CCK-8實驗、流式細胞儀、Transwell小室實驗及劃痕實驗檢測細胞增殖、周期、侵襲和遷移,結果顯示過表達miR-625可誘導食管癌細胞周期阻滯,抑制其增殖、侵襲與遷移,而抑制miR-625表達可逆轉上述作用。Cyclin D1是重要的細胞周期調控蛋白,可促進細胞由G1期向S期轉化,從而加速細胞增殖[10]。p21則是細胞周期負性調控因子,可抑制多種細胞周期蛋白和激酶的活性,限制細胞從G1期向S期轉化[11]。本研究轉染miR-625 mimic后,細胞中Cyclin D1表達下調,p21表達上調,提示miR-625通過調節Cyclin D1和p21表達,阻滯細胞周期進程,從而抑制食管癌細胞增殖。腫瘤細胞的侵襲和遷移機制十分復雜,涉及多個過程的相互作用,如上皮間質轉化和新生血管形成等[12]。E-cadherin、N-cadherin和Vimentin分別是上皮間質轉化過程中上皮和間質表型的標志蛋白,腫瘤細胞通過上皮間質轉化獲得較高的運動能力,增強侵襲與遷移[13]。本研究發現上調miR-625表達可促進細胞中E-cadherin表達,抑制細胞中N-cadherin和Vimentin表達,提示miR-625可能減少食管癌細胞上皮間質轉化,從而抑制其侵襲與遷移。
HMGA1是一種非組蛋白的DNA結合蛋白,在多種惡性腫瘤中發揮致癌基因作用,可通過多種途徑影響腫瘤細胞的侵襲和遷移[14]。TOYOZUMI等[15]研究發現,HMGA1在食管鱗狀細胞癌中表達上調,且其高表達與患者預后不良密切相關。本研究經生物信息學軟件預測顯示,miR-625與HMGA1 3' UTR存在結合位點,且雙熒光素酶報告基因檢測、RT-qPCR和Western blot檢測結果均證實,miR-625與HMGA1存在靶向關系。進一步共轉染miR-625 mimic和pcDNA3.1-HMGA1觀察miR-625是否可靶向HMGA1作用于食管癌細胞,結果顯示pcDNA3.1-HMGA1組細胞增殖、侵襲、遷移能力及處于G2期細胞比例高于mimic NC組,處于G1期細胞比例低于mimic NC組;而miR-625+HMGA1組細胞增殖、侵襲及遷移能力較pcDNA3.1-HMGA1組降低,處于G1期細胞比例較pcDNA3.1-HMGA1組升高。提示miR-625可靶向HMGA1調控食管癌細胞的生物學行為。
綜上所述,miR-625在食管癌組織和細胞中呈低表達,且可負向調控HMGA1抑制食管癌細胞的增殖、侵襲與遷移,這為食管癌的發病機制研究提供了新思路,可能有助于食管癌的早期診斷和治療。

