青霉菌P1處理染料廢水*
劉江紅,蘇會敏,薛 健,魏曉航
(1.東北石油大學 化學化工學院,黑龍江 大慶 163318;2.西安凱立新材料股份有限公司,陜西 西安 710201)
隨著染料生產和印染工業的發展,染料廢水的排放量急劇增加,全球印染染料產量超過100萬t/a,約有5%~10%的染料隨廢水排放出去[1-2]。染料廢水是一種難處理的工業廢水,對環境造成嚴重污染,破壞生態平衡,威脅人體健康。傳統的物理法和化學法具有成本高、效率低、易產生二次污染的缺點,而生物法具有成本低、安全、無污染、環境友好等優點。到目前為止,已經發現了多種可以脫色染料的微生物,主要包括真菌、細菌和藻類等[3],生物法具有廣闊的應用前景[4]。作者從染料廢水中篩選出一株青霉菌,用以脫色亞甲基藍染料廢水,探究不同因素對青霉菌脫色亞甲基藍的影響。
1 實驗部分
1.1 原料、試劑與儀器
菌種:實驗所用染料降解菌來自于染料廢水樣品,篩選出的菌株于實驗室冰箱中冷藏保存。
亞甲基藍:天津博迪化工股份有限公司;蔗糖:生物試劑,氯化鈣:分析純,天津市耀華化工廠;磷酸氫二鉀、硫酸鎂、硫酸銨、磷酸二氫鉀:分析純,天津市塘沽鵬達化工廠。
電熱恒溫培養箱:SYQ-DSX-280B,南京曉曉儀器設備有限公司;臺式恒溫振蕩培養箱:HZQ-X100,常州恒隆儀器有限公司;pH計:pHS-3C,濟南光耀醫療設備有限公司;可見分光光度計:722E,北京瑞青橙儀器儀表有限公司;紫外-可見分光光度計:T6,華威科創(武漢)科技有限公司;傅里葉紅外光譜儀:Nicolet 6700,美國熱電公司。
1.2 實驗方法
1.2.1 培養基的處理
(1)真菌馴化培養基:NaNO32.0 g,MgSO4·7H2O 0.5 g,K2HPO41 g,FeSO4·7H2O 0.01 g,蒸餾水1 000 mL,KCl 0.5 g,蔗糖30 g,pH=7,121 ℃滅菌20 min。
(2)染料降解培養基(MSM):(NH4)2SO42.0 g,MgSO4·7H2O 0.2 g,CaCl2·2 H2O 0.01 g,KH2PO41.5 g,K2HPO41.0 g,FeSO4·7H2O 0.01 g,蔗糖10 g,蒸餾水1 000 mL,pH=7.0,121 ℃高壓蒸汽滅菌 25 min。
1.2.2 微生物的馴化
馴化實驗在250 mL錐形瓶中進行(培養液體積50 mL),搖床轉速120 r/min,t=35 ℃。采用逐步提升染料濃度的馴化方法,馴化期約30 d,具體馴化流程見圖1。

圖1 高效染料降解菌篩選、分離、純化流程
1.2.3 血球計數法配制孢子懸液
在超凈工作臺上,將少量w(NaCl)=0.9%的生理鹽水倒入覆蓋著青霉菌孢子的固體培養基中,緩慢搖晃,然后倒入250 mL錐形瓶中。重復幾次可獲得高濃度的青霉菌孢子懸液,在搖瓶中加適量w(NaCl)=0.9%的生理鹽水至100 mL,振蕩一段時間使孢子呈均勻分散狀態。將蓋玻片置于鏡檢后的血球計數板上,搖勻孢子懸液,用滅菌后的膠頭滴管吸取1滴,沿蓋玻片邊緣滴入計數室,對計數室內的孢子個數進行3次計數,取平均值[5-7]。孢子懸液濃度計算見公式(1)。
(1)
式中:孢子懸液濃度,個/mL;N為平均10個格內孢子數,個。
取250 mL錐形瓶,加入100 mL染料降解培養基,用滅菌后的移液管移取孢子懸液,將φ(青霉菌孢子)=1%的接種懸液(濃度為107個/mL)置于生長培養基中,即接種后培養基中孢子濃度為105個/mL,留置備用。
1.2.4 脫色效率的測定
取上清液3 mL,n=9 000 r/min離心10 min,于亞甲基藍最大吸收波長(660 nm)下測定吸光度(At),以未被處理的青霉菌處理亞甲基藍溶液的吸光度(A0)為對照,空白染料降解培養基為參比,亞甲基藍的脫色效率見公式(2)[8-10]。

(2)
1.2.5 不同因素對亞甲基藍脫色效率的影響
考察青霉菌P1脫色亞甲基藍的過程中,各因素對亞甲基藍脫色效率的影響。亞甲基藍的脫色實驗在初始亞甲基藍濃度、青霉菌孢子懸液接種量、pH值(通過滴加0.1 mol/L HCl或0.1 mol/L NaOH溶液進行調節)、時間和鹽度等不同條件下進行。
1.2.6 青霉菌脫色亞甲基藍的機理探究
1.2.6.1 青霉菌脫色亞甲基藍前、后機理的實驗探究
取4個250 mL錐形瓶,分別標記1#、2#、3#和4#。用移液管移取ρ(亞甲基藍)=1 g/L的母液2 mL,使最終溶液ρ(亞甲基藍)=20 mg/L,將φ(真菌孢子)=3%的懸液接種染料降解培養基中,n=120 r/min恒溫35 ℃培養,分別進行以下實驗操作。(1)1#瓶經n=7 000 r/min離心5 min,每隔24 h測定吸光度值,計算脫色效率。(2)2#瓶培養超過48 h,直至溶液顏色由藍色變為白色,并不再發生變化后取出。n=8 000 r/min高速離心脫色菌體,上清液即為粗酶液。取整瓶粗酶液,加入亞甲基藍原溶液,使最終溶液ρ(亞甲基藍)=20 mg/L,n=150 r/min恒溫培養超過48 h,每隔24 h測定一組吸光度值,直至吸光度值不再發生變化為止。(3)3#瓶和4#瓶分別培養24和48 h之后取出,經121 ℃高壓滅菌20 min,致菌體死亡,測定吸光度值并計算脫色效率。
1.2.6.2 青霉菌脫色亞甲基藍前、后的紫外分析
在染料降解培養基中以ρ(亞甲基藍)=20 mg/L、懸液接種量φ(青霉菌孢子)=3%為條件,在培養前(0 h)和亞甲基藍完全脫色后(72 h)分別取10 mL混合液通過離心(9 000 r/min,5 min)的方式去除菌體,并利用紫外-可見分光光度計的掃描功能分析混合液上清液的紫外譜圖變化。
1.2.6.3 亞甲基藍脫色前、后紅外光譜分析
將φ(青霉菌孢子)=3%的懸液接種至染料降解培養基中,n=120 r/min恒溫培養72 h,通過離心制備青霉菌粗酶液100 mL,通過移液管向青霉菌粗酶液中加入ρ(亞甲基藍)=1 g/L的溶液2 mL,使最終溶液中的ρ(亞甲基藍)=20 mg/L,恒溫振蕩48 h,溶液中亞甲基藍無殘留,由于青霉菌產生的還原物質和酶的共同作用使亞甲基藍全部斷鏈,進而被脫色。在用壓片機給KBr壓片后,分別滴加脫色前ρ(亞甲基藍)=20 mg/L溶液和脫色后ρ(亞甲基藍)=20 mg/L溶液進行紅外光譜分析(FTIR)。
2 結果與討論
2.1 真菌篩選結果與鑒定
2.1.1 不同菌株對亞甲基藍脫色效率的對比
不同菌株對ρ(亞甲基藍)=20 mg/L溶液的脫色效率見圖2。

t/h圖2 不同菌株對亞甲基藍的脫色效率
由圖2可知,t=72 h,菌株1的亞甲基藍脫色效率為85.21%,t=96、120 h的脫色效率變化不大。t=72 h,菌株2的亞甲基藍脫色效率為55.41%,t=96、120 h的脫色效率為67.23%、72.13%,仍有繼續增長的趨勢,考慮亞甲基藍的脫色時間和脫色效率2個因素,所以選用菌株1作為后續研究菌株。
2.1.2 菌株1的16S rDNA的分子鑒定
菌株1的形態和生理模式顯示了與青霉菌的高度相似性。菌株的16S rDNA序列與NCBI GenBank和RDP數據庫對比,可鑒定該序列為青霉菌(PencillumexpansumKU162972,簡稱P1),基因同源性相似度達99%。菌株的系統發育樹見圖3。

圖3 P1的系統發育樹
2.2 不同因素對亞甲基藍脫色效率的影響
2.2.1 初始ρ(亞甲基藍)對亞甲基藍脫色效率的影響
青霉菌P1在初始ρ(亞甲基藍)=0、20、40、60、80和100 mg/L的培養基中培養5 d后,對不同ρ(亞甲基藍)溶液的脫色效率見圖4。
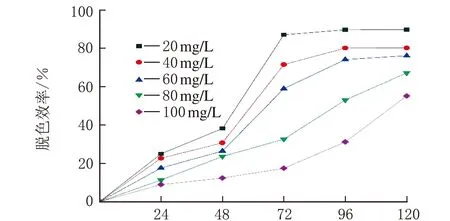
t/h圖4 初始ρ(亞甲基藍)對亞甲基藍脫色效率的影響
由圖4可知,隨著ρ(亞甲基藍)逐漸升高,脫色效率逐漸降低。ρ(亞甲基藍)=40~100 mg/L,脫色效率明顯下降。分析原因可能是ρ(亞甲基藍)過高對青霉菌P1產生了一定的毒性,抑制青霉菌P1的正常生長,從而導致亞甲基藍脫色效率的下降。
2.2.2φ(青霉菌P1孢子)對亞甲基藍脫色效率的影響
φ(青霉菌P1孢子)對亞甲基藍脫色效率的影響見圖5。
由圖5可知,φ(青霉菌P1孢子)=1%~3%,脫色效率隨著φ(青霉菌P1孢子)的增加而增加,而φ(青霉菌P1孢子)=4%~5%,脫色效率變化很小,分析原因可能是在特定的反應體系中,營養物質有限度,微生物不能無限繁殖,隨著微生物代謝產物的增加和營養物的消耗,導致脫色效率不再升高。因此,在后續的實驗中,最佳接種量選擇φ(青霉菌P1孢子)=4%。
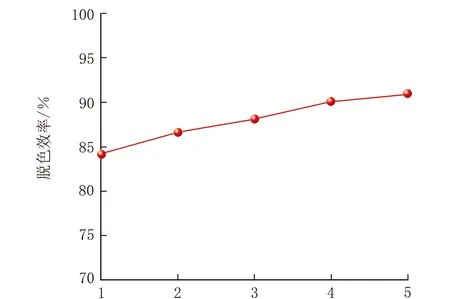
φ(青霉菌P1孢子)/%圖5 φ(青霉菌P1孢子)對亞甲基藍脫色效率的影響
2.2.3 pH值對亞甲基藍脫色效率的影響
pH值對亞甲基藍脫色效率的影響見圖6。

pH圖6 pH值對亞甲基藍脫色效率的影響
由圖6可知,pH=1~3,亞甲基藍的脫色效率逐漸上升;pH=4,脫色效率達到最大值94.95%;pH=5~7,脫色效率逐漸下降;pH=8~9,亞甲基藍的脫色效率僅為26.52%和13.26%,呈下降趨勢。酸性條件下對亞甲基藍的脫色效率明顯高于堿性,青霉菌P1很有可能是一種嗜酸菌,在酸性條件下更有利于生長。pH=8~9,溶液呈堿性,影響了青霉菌P1的生長,導致亞甲基藍的脫色效率明顯下降。因此,青霉菌最適宜的降解亞甲基藍染料選擇pH=4。
2.2.4 時間對亞甲基藍脫色效率的影響
脫色時間是影響微生物脫色能力的重要因素,適宜的反應時間不僅能使微生物充分發揮作用,還能節約反應時間及成本,對實際工程應用有很大的影響,時間對亞甲基藍脫色效率的影響見圖7。
由圖7可知,青霉菌P1在培養t=4~20 h,亞甲基藍脫色效率呈快速上升趨勢;在培養t=24、28 h,脫色效率分別為93.09%、95.37%,呈緩慢上升趨勢。因此在后續實驗過程中,考慮實驗時間和實驗成本,青霉菌P1脫色亞甲基藍的最適宜脫色時間選擇24 h。

t/h圖7 時間對亞甲基藍脫色效率的影響
2.2.5 鹽度對亞甲基藍脫色效率的影響
染料廢水通常具有較高的含鹽量。在實際染料廢水處理過程中,研究鹽度對青霉菌P1生長和染料脫色的影響具有重要意義。鹽度對亞甲基藍脫色效率的影響見圖8。
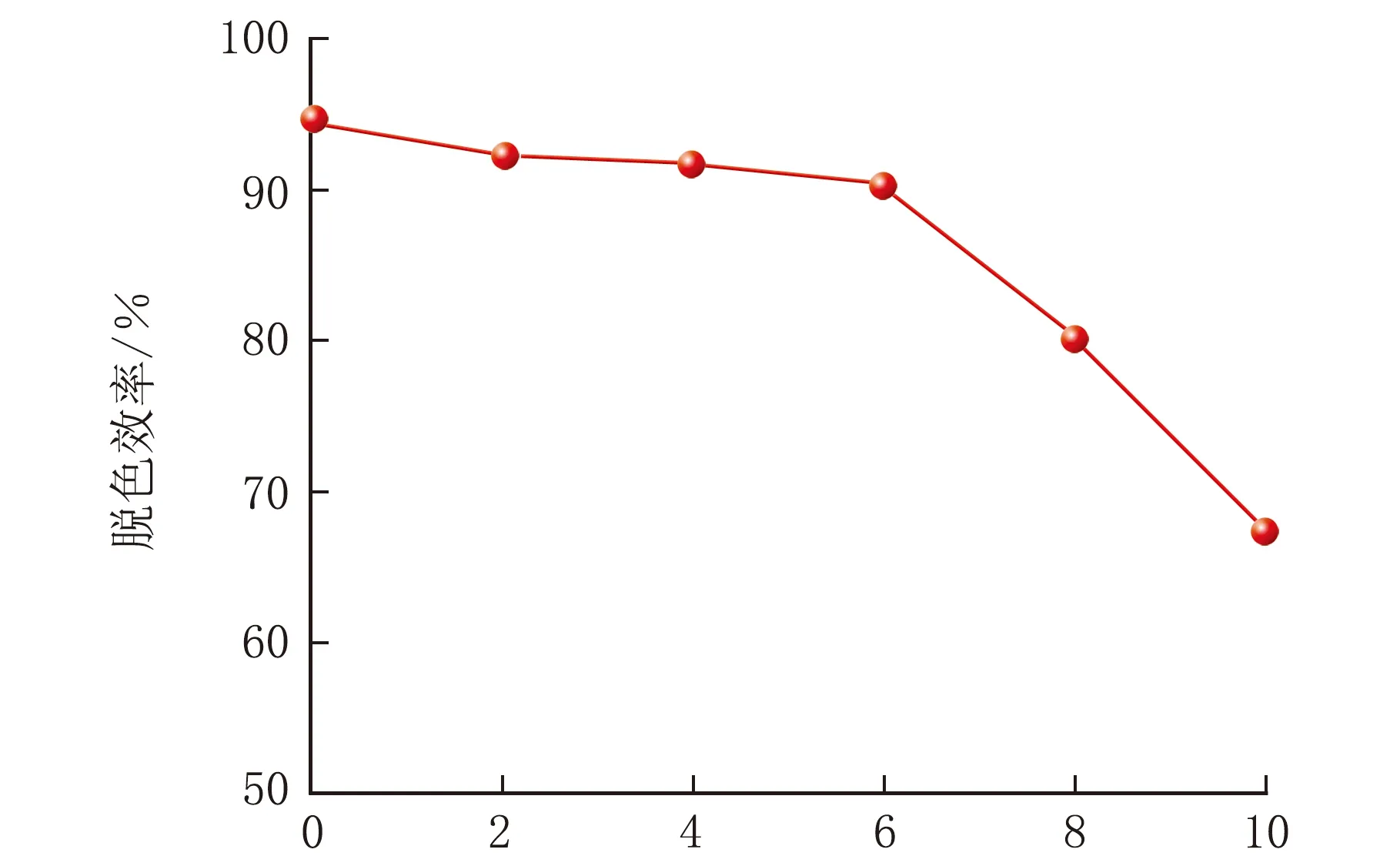
w(鹽度)/%圖8 鹽度對亞甲基藍脫色效率的影響
由圖8可知,隨著鹽度的逐漸升高,青霉菌對亞甲基藍的脫色效率逐漸降低,下降趨勢明顯,說明鹽度可能抑制青霉菌P1對亞甲基藍的脫色作用。鹽度w(NaCl)=6%,脫色效率為90.3%,說明青霉菌P1具有耐受高鹽度的能力,在實際處理染料廢水的過程中具有應用價值[11-12]。
2.3 青霉菌P1脫色亞甲基藍的機理探究
2.3.1 青霉菌P1脫色亞甲基藍的實驗機理探究
青霉菌P1脫色亞甲基藍的實驗機理探究結果見表1。

表1 青霉菌P1脫色亞甲基藍前、后機理的實驗探究
由表1可知,1#瓶隨著時間的增加,青霉菌P1孢子不斷增長,對亞甲基藍的脫色效率也逐漸增加;2#瓶表明這些酶類確實能使亞甲基藍脫色。結合1#瓶、3#瓶和4#瓶,48 h兩者的差值為青霉菌P1吸附亞甲基藍的效率20.27%。說明在該脫色過程中,亞甲基藍的脫色是生物降解和生物吸附共同作用的結果。
2.3.2 青霉菌脫色亞甲基藍前、后的紫外圖譜分析
青霉菌P1脫色亞甲基藍前、后的紫外譜圖見圖9。

λ/nm圖9 青霉菌P1脫色亞甲基藍前、后的紫外譜圖
由圖9可知,未處理的亞甲基藍染料分別在波長為291和660 nm有特征吸收峰(其中660 nm為最大吸收波長),經過5 d脫色處理后,660 nm的吸收峰明顯下降。由文獻可知[13],微生物脫色亞甲基藍的方式有生物吸附和生物降解2種,生物吸附過程中紫外譜圖的吸收峰具有同步降低的現象,生物降解過程中紫外譜圖會具有主吸收峰的消失并出現新吸收峰的現象。青霉菌P1脫色亞甲基藍的紫外譜圖有明顯波形變化,并且有新的吸收峰出現,可以判斷脫色過程是由降解作用引起的。由青霉菌P1脫色亞甲基藍前、后的紫外譜圖對比,可以看出亞甲基藍的分子峰發生藍移,具有減色效應,660和291 nm的2個明顯的吸收峰分別對應發色基團(—S—)吸收峰和苯環(吩噻嗪結構)吸收峰。由此猜測,在降解過程中,發色基團斷鏈,降解后中間產物的苯環數相對于亞甲基藍的苯環數有所增加,或中間產物具有吩噻嗪結構[14-15]。
2.3.3 青霉菌脫色亞甲基藍前、后的紅外譜圖分析
青霉菌脫色亞甲基藍前、后的紅外譜圖分析見圖10。

σ/cm-1圖10 青霉菌P1脫色前、后代謝物的紅外譜圖

3 結 論
實驗從染料廢水中篩選出青霉菌P1(PencillumexpansumKU162972),探究不同因素對青霉菌脫色亞甲基藍脫色效率的影響,并且利用紫外分光光度計和傅里葉紅外光譜探究青霉菌P1對亞甲基藍的脫色機理。
(1)考察不同因素對青霉菌P1脫色亞甲基藍脫色效率的影響,在ρ(亞甲基藍)=20 mg/L、接種量φ(青霉菌孢子)=4%、pH=4和鹽度w(NaCl)=2%條件下,亞甲基藍的脫色效率可達92.33%;
(2)由紫外光譜分析可知,青霉菌脫色亞甲基藍的紫外譜圖有明顯波形變化并且有新的吸收峰出現,可判斷脫色過程具有生物降解作用;
(3)由紅外光譜分析可知,亞甲基藍和代謝物紅外光譜的差異表明亞甲基藍的結構部分發生了轉化,與之前實驗探究機理和紫外光譜分析相同,說明亞甲基藍脫色過程是生物降解和生物吸附共同作用的結果。

