抑制素B及性激素指標檢測在男性生精功能中的應用*
張 琴,蘇占營,吳成亮,辜 敏,江旺航
江西省九江市婦幼保健院:1.檢驗科;2輔助生殖科,江西九江 332000
抑制素B(INH-B)是由睪丸支持細胞分泌的糖蛋白激素,是由1個α亞單位和1個β亞單位組成異二聚體,受下丘腦-垂體-性腺軸激素調控,也受睪丸內環境改變的影響,血清INH-B比精漿INH-B穩定性高,測量其水平可了解精子生發狀況[1-4]。男性INH-B缺乏可降低睪丸曲細精管生精功能甚至導致無精子癥,有研究者將血清INH-B視為男性精子產生的標志物之一,其水平反映男性生精功能[5-6]。研究表明不良生活習慣和工作壓力加大使男性精子質量逐年下降且呈加速下降趨勢,目前由無精子癥導致的不孕不育約占男性不育癥的15%且逐年呈上升趨勢,睪丸活檢依然是診斷無精子癥的金標準,但其具有巨大的創傷性和潛在并發癥的風險[7-9]。本研究旨在通過檢測INH-B和血清性激素水平,探討兩者的關聯性,以期為睪丸活檢取精提供參考依據。
1 資料與方法
1.1一般資料 選擇2018年1月至2020年12月在本院接受輔助生殖技術治療的316例男性不育癥患者作為研究對象,所有患者均通過精液常規檢查并記錄不育年限、睪丸總體積及是否有吸煙、酗酒等不良嗜好史。根據患者精液濃度檢查結果將患者分為4組,劃分標準:濃度正常組,精子濃度≥15×106/mL(A組,80例);輕中度少精子組,精子濃度為5×106~<15×106/mL(B組,104例);嚴重少精子組,精子濃度<5×106/mL(C組,78例);無精子癥組:兩次精液常規檢查(3 000 r/min離心15 min)均未見精子(D組,54例)。將D組患者根據睪丸活檢精子抽吸術(TESA)的取精結果分為梗阻性無精子癥(OA)組(34例)及非梗阻性無精子癥(NOA)組(20例)2個亞組。
1.2方法
1.2.1精液留取與分析 全部患者禁欲3~5 d,上午8:00—10:00手淫取精,精液全部收集于無菌容器中并按WHO《人類精液檢查與處理實驗手冊》第5版標準程序處理,分析精子濃度。
1.2.2INH-B及性激素測定 早上8:00—9:00空腹抽血3 mL于促凝管中,混勻靜置2 h后3 000 r/min離心10 min。取上層血清采用電化學發光法檢測卵泡刺激素(FSH)、黃體生成素(LH)、睪酮(T)水平,采用酶聯免疫吸附試驗(ELISA)檢測血清INH-B水平。
1.2.3精漿INH-B測定 精液在37 ℃環境中液化30 min后3 000 r/min離心10 min,取上層精漿采用ELISA檢測INH-B水平。
1.3TESA 患者取仰臥位,碘伏消毒、鋪巾,1%利多卡因行精索神經局部麻醉。左手固定睪丸,右手握注射器經皮刺入睪丸,將穿刺所取的組織物注入培養皿中磨碎以達到將內部精子游離出來的目的,在倒置顯微鏡下觀察是否有活動精子。當第1次觀察到活動精子即為睪丸活檢成功,如果第1次未觀察到活動精子,休養15 d后進行第2次活檢,依然沒有觀察到活動精子即為活檢失敗,判定為NOA。兩次活檢中任意一次觀察到活動精子即判定為睪丸活檢成功(OA患者)。

2 結 果
2.1各組一般資料及INH-B水平比較 雙側睪丸總體積比較:A組和B組雙側睪丸總體積明顯大于OA組和NOA組(P<0.05)。血清INH-B水平比較:A組和OA組明顯高于C組和NOA組,差異均有統計學意義(P<0.05);A組與OA組之間差異無統計學意義(P>0.05);精漿INH-B水平比較:A組顯著高于其余各組,差異均有統計學意義(P<0.05)。見表1。

表1 各組一般資料及INH-B水平比較
2.2各組血清性激素水平比較 C組和NOA組FSH、LH水平顯著高于其余各組,差異有統計學意義(P<0.05);A組和B組T水平顯著高于其余各組,差異有統計學意義(P<0.05)。見表2。

表2 各組血清性激素水平比較
2.3INH-B水平與性激素的相關性分析 血清INH-B水平與血清FSH及LH水平呈負相關(P<0.05);精漿INH-B水平與血清T水平呈正相關(P<0.05)。見表3。
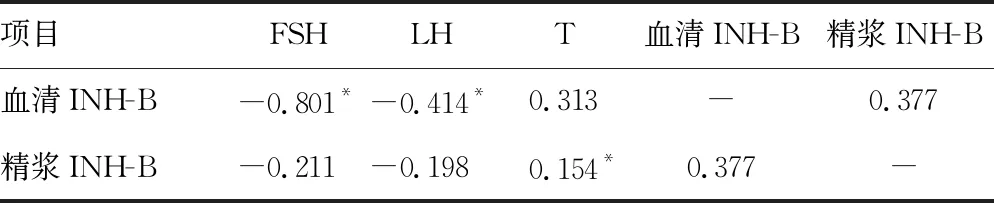
表3 INH-B水平與性激素水平的相關性分析(r)
3 討 論
男性精子生發障礙是指曲細精管內精子生發不良,臨床表現為少精子癥、弱精子癥、NOA,其中弱精子癥和少精子癥是最常見的表現[10]。不良的生活習慣和過大的工作壓力導致男性不育癥患病率逐年升高[11-12],輸精管阻塞導致無精子癥患者的生精功能與健康人相似,而NOA患者和重度少精子癥患者生精功能都很差,其中多數人因生精功能障礙而影響精子生成,睪丸生精功能的差異最終導致精子濃度的差異[12-15]。
INH-B是睪丸支持細胞產生的一種糖蛋白激素,屬于轉化生長因子-β超家族成員[16-17]。它由曲細精管分泌,受FSH調控,具有晝夜分泌節律性[18],與精子的生發狀態存在明顯相關性,其水平高低反映了生精上皮的功能是否良好,被認為是男性生成精子的標志物[19]。男性生殖內分泌調節過程中,INH-B起到了重要作用,其與FSH形成穩定的負反饋調控關系。它在生殖內分泌調節過程中可以特異地作用于腺垂體細胞,對促性腺激素釋放激素(GnRH)誘導的FSH分泌具有選擇性的抑制作用,并呈劑量依賴關系,對FSH具有極強的負反饋作用[20]。INH-B作用于睪丸,能減少FSH的生成,進而增加精子的生成,并且刺激睪丸間質細胞產生睪酮[21]。INH-B的水平會在精子生成障礙時出現變化,通過測定其水平可以對精子生成狀態進行評估。INH-B作為評估精子生成的指標,可為臨床醫師診斷生精障礙和睪丸功能減退提供參考依據。
本研究表明,血清INH-B水平與FSH呈負相關,A組血清和精漿的INH-B水平高于NOA組(P<0.05),提示非無精子癥患者INH-B水平可作為評價生精功能的指標之一。無精子癥的發生機制尚不完全明確,如果能經過睪丸活檢獲得精子,借助第2代試管嬰兒助孕技術可使部分患者生育自己的后代,但在實際工作中往往活檢結局不確定,很多患者在受到身體創傷后無法獲得精子,進一步造成心理創傷。無精子癥的兩個亞組間(OA組與NOA組)精漿INH-B水平接近,提示OA組血清中的INH-B由睪丸支持細胞生成后在進入曲細精管的過程中受阻,受血液累積效應的影響導致血清中的INH-B水平偏高,使OA組精漿中的INH-B水平降低,這與NOA組患者睪丸支持細胞INH-B生成減少導致的精漿內INH-B水平降低的原理不同。這提示臨床醫師可以根據INH-B在血清及精漿中的水平差異初步判斷無精子癥的類型。目前國內外關于血清及精漿中的INH-B水平與睪丸活檢結果的相關性研究還不是很多,既往研究提示INH-B在精子生發的過程中的預測價值高于FSH[22]。睪丸支持細胞在精子的生發過程中起著重要的營養支持和屏障作用,臨床基礎研究表明男性INH-B全部由睪丸支持細胞分泌,具有高度特異性[23]。目前在INH-B的相關研究中,均將其視為無精子癥患者睪丸取精的預期指標,INH-B水平過低往往預示著睪丸活檢成功率低,這種情況下漸進性地讓患者接受供精助孕才是輔助生殖技術的目的,過分強調睪丸活檢是不可取的。本研究結果提示,對于無精子癥患者,如果其血清INH-B水平高以及雙側睪丸體積正常,往往預示該患者為OA患者,睪丸內的精子聚集無法經正常手淫取精排出,此時直接取睪丸組織活檢在倒置顯微鏡下獲得精子的概率遠遠大于NOA患者。臨床上可以將INH-B作為預測不同病因的無精子癥患者睪丸活檢取精結局的指標。

