鹽酸地巴唑片質量分析研究*
陳宇堃,梁蔚陽,陳 旻
(廣東省藥品檢驗所·國家藥品監督管理局血液制品質量控制重點實驗室·廣東省藥品監督管理局血液制品質量控制研究重點實驗室,廣東 廣州 510663)
地巴唑片對血管平滑肌有直接的松弛作用,可降低外周阻力,從而降低血壓,對胃腸平滑肌也有一定解痙作用[1]。國外研究發現,地巴唑的血管舒張作用與阻斷非活化鈣通道而減少Ca2+進入平滑肌細胞有關[2]。查詢國家藥品監督管理局數據,地巴唑片國內有46家生產企業,58個國藥準字批號,規格主要為3,5,10,20 mg,11家生產企業仍在產。經調研國內生產企業,地巴唑片生產歷史較久遠,不能確定其原研廠家。該制劑現行質量標準收載于《中華人民共和國衛生部藥品標準》(1989年版)化學藥品及制劑第一冊。根據結構式[3],地巴唑(片)的通用名應為鹽酸地巴唑(片),故本研究中統一使用其通用名。原國家食品藥品監督管理總局曾將鹽酸地巴唑片列入2014年度全國藥品質量評價抽驗計劃。本次抽樣共完成11家企業、183批次樣品的法定標準檢驗,并抽取其中77批次樣品開展探索性研究。通過對鹽酸地巴唑片進行模擬處方制劑試驗、有關物質、溶出度、含量均勻度及含量測定的研究,全面分析鹽酸地巴唑片的有效性和安全性,全面了解各企業的產品質量狀況。現報道如下。
1 儀器與試藥
1.1 儀器
Waters 2695/2487型和E2695/2998型高效液相色譜儀,Waters Acquity H Class UPLC/G2 QTOF型超高效液相色譜-飛行質譜聯用儀(美國Waters公司);Agilent 1200型高效液相色譜儀(美國Agilent公司);Millipore超純水儀(美國Millipore公司);Sartorius CPA225D型電子天平(德國Sartorius公司);SOTAX AT7型溶出儀(瑞士Sotax公司);Malvern M2000型粒度分布儀(英國Malvern公司);Bruker AVANCEⅢHD 600型超導脈沖傅立葉變換核磁共振波譜儀(瑞士Bruker公司);TA DSC Q2000型差示掃描量熱儀(美國TA公司);PANalytical EmpyreanX型射線衍射儀(荷蘭Panalytical公司);UV-2450型紫外分光光度計(日本Shimadzu公司)。
1.2 試藥
鹽酸地巴唑對照品(中國食品藥品檢定研究院,批號為100420-201002,含量為98.9%);鄰苯二胺對照品(江陰市華亞化工有限公司,批號為10511140401,含量為99.3%);苯乙酸對照品(河北誠信有限責任公司,批號為12011140501,含量為99.5%);鹽酸地巴唑原料(企業I,批號I1~I3;企業L,批號L1~L3);鹽酸地巴唑片(企業A,批號A1~A16;企業B,批號B1~B14;企業C,批號C1;企業D,批號D1;企業E,批號E1~E10;企業F,批號F1~F26;企業G,批號G1;企業H,批號H1~H16;企業I,批號I1~I17;企業J,批號J1~J20;企業K,批號為K1~K61;規格均為10 mg);甲醇、冰醋酸、三乙胺均為色譜純;鹽酸、三氯甲烷、丙酮均為分析純;水為超純水。
2 方法與結果
2.1 法定檢驗
對183批次鹽酸地巴唑片樣品按現行質量標準[4]進行檢驗,檢驗項目包括性狀、重量差異及含量測定。合格98批次,合格率為53.55%。84批次為性狀不合格,1批次為性狀及重量差異均不合格。1)性狀:現行質量標準[4]規定,鹽酸地巴唑片應為白色片,85批次樣品性狀不合格原因均為片劑表面存在不同程度和數量的黑色、灰色或褐色斑點(見圖1)。涉及9個企業,表明樣品表面存在斑點現象較普遍。2)重量差異:1批次樣品(批號H1)不合格,不合格率為0.55%。提示個別企業鹽酸地巴唑片的生產工藝有待改進。3)含量測定:樣品均符合規定,含量均在93.1%~109.5%范圍內,平均100.0%。企業批間變異系數為1.1%~3.4%,批內變異系數為0.1%~4.2%,提示部分企業生產工藝存在一定問題。法定檢驗結果顯示,大部分企業各批次的結果一致,但部分企業不同批號批次與相同批號批次的結果有差異,說明部分企業生產工藝存在一定問題。

圖1 不合格樣品典型圖Fig.1 Typical picture of unqualified samples
2.2 探索性研究
針對在法定檢驗中發現的問題,選取11個企業共77批次樣品作為供試品,參照2020年版《中國藥典(四部)》[5]和其他文獻資料[6-8]開展探索性研究。
1)模擬處方工藝制劑試驗
根據企業K提供的原輔料、處方和工藝,模擬處方制劑過程。結果發現,部分輔料存在色點。而壓片過程中,壓片機若缺乏及時保養維護就會導致片劑表面有色澤深淺不同的斑點。
2)有關物質
現行質量標準[4]中無“有關物質”項,參考相關文獻的液相色譜法[5-6],并對其做進一步優化及專屬性、耐用性試驗等方法學考察,分析鹽酸地巴唑片中的有關物質。色譜條件:采用Waters 2695/2487型高效液相色譜儀,色譜柱為Kromasil C18柱(250 mm×4.6 mm,5μm),流動相為水-甲醇-冰醋酸-三乙胺(45∶55∶0.5∶0.5,V/V/V/V),流速為1.0 mL/min,檢測波長為220 nm,柱溫為30℃,進樣量為10μL(供試品溶液質量濃度為1.0 mg/mL)。以鹽酸地巴唑的合成原料鄰苯二胺和苯乙酸與適量鹽酸地巴唑一起溶解,溶液按擬訂色譜條件進樣測定。有關物質典型色譜圖見圖2。色譜圖中,峰3為最大未知雜質峰,該峰在強制降解試驗時,除光破壞時峰面積減小外,其余破壞試驗無明顯變化;猜測該物質可能為鹽酸地巴唑的工藝雜質。
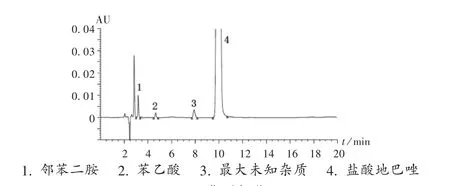
圖2 典型色譜圖1.O-phenylenediamine 2.phenylacetic acid 3.the largest unknown impurity 4.bendazol hydrochlorideFig.2 Typical chromatograms
取最大未知雜質10 mg,用甲醇溶解,制成質量濃度為100μg/mL的供試品溶液。結合超高效液相色譜-飛行質譜聯用(UPLC-QTOF-MS)法和核磁共振波譜(NMR)法,對該雜質進行研究[7],發現其為2-(羥基苯基)苯并咪唑,結構式見圖3。鹽酸地巴唑生產工藝是以鄰苯二胺與苯乙酸為起始原料,在氮氣保護下,采用分段升溫降溫方法,使鄰苯二胺與苯乙酸產生苯并咪唑關環反應,生成2-芐基苯并咪唑。猜測2-芐基苯并咪唑在脫色過程中接觸活性炭時,與殘留的氧氣發生反應,生成2-(羥基苯基)苯咪唑。推測的未知雜質產生途徑見圖4。
目前關于網絡安全的法律法規都已出臺,公司信息中心也制定了網絡安全管理制度,但宣傳教育的力度還不夠。網上活躍的大量黑客交流信息,也為一些別有用心人的對網絡破壞活動奠定了技術基礎。

圖3 最大未知雜質的結構Fig.3 Structure of the largest unknown impurity

圖4 最大未知雜質產生途徑Fig.4 The producing pathway of the largest unknown impurity
對77批次鹽酸地巴唑片雜質含量進行箱式分析,可發現企業J和K的樣品雜質含量批間變異系數較大,企業C和D的樣品雜質含量批間差異較小,詳見圖5。
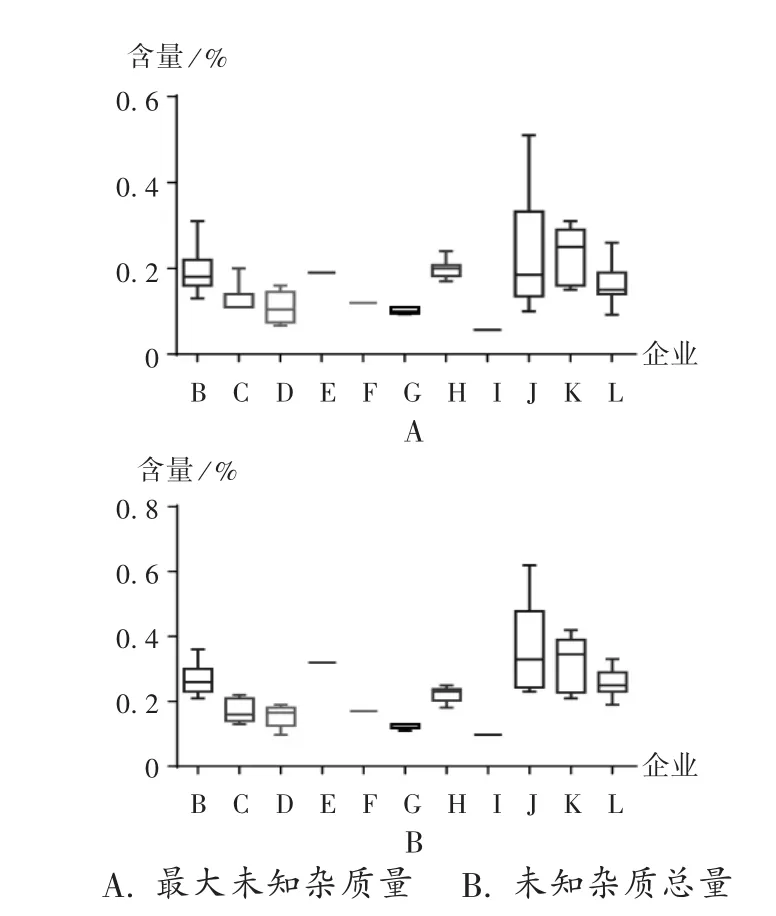
圖5 不同企業樣品雜質量比對箱式圖A.The content of the largest unknown impurity B.The content of other impuritiesFig.5 Comparison box plot of the content of impurity in the samples from different manufactures
3)溶出度
現行質量標準[4]中無此項,崩解時限項下采用水作為溶劑,規定在15 min內應完全溶解。鹽酸地巴唑為難溶性藥物,根據生物藥劑學(BSC)分類系統定義,為低溶解度高滲透性物質。崩解時限不能完全體現其在人體內的溶出情況。對鹽酸地巴唑片進行pH 1.0,2.0鹽酸溶液,pH 3.8醋酸鹽緩沖液,pH 4.5,5.8,6.8磷酸鹽緩沖液,水7種溶出介質的溶出曲線試驗,并同時考察11個企業的樣品在pH 1.0鹽酸溶液中溶出行為的差異。
采用2020年版《中國藥典(四部)》通則0931溶出度與釋放度測定法第二法(槳法),轉速為50 r/min,溶出體積為900 mL。采用紫外-可見分光光度法在270 nm波長處測定。
取樣品(批號J16)適量,分別在前述7種溶出介質中繪制溶出曲線。在5,10,15,30,45,60,90,120 min取樣,濾過,取續濾液,作為供試品溶液,并同時補充相同體積的溶出介質(溶出曲線見圖6 A)。
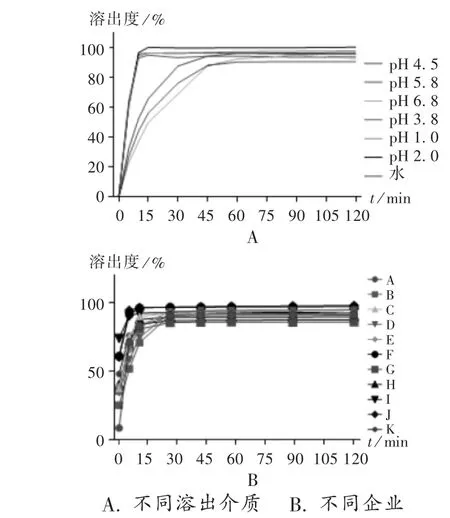
圖6 平均溶出曲線圖A.Different dissolution media B.Different manufacturesFig.6 The average dissolution profile
取11家企業的樣品(批號A3,B2,C1,D1,E2,F3,G1,H10,I1,J16,K1)各適量,分別在pH 1.0鹽酸溶液中繪制溶出曲線。在5,10,15,30,45,60,90,120 min時取樣,濾過,取續濾液,作為供試品溶液,并同時補充相同體積的溶出介質(溶出曲線見圖6 B)。
由圖6 A可知,當溶出介質為水,pH 1.0,2.0鹽酸溶液,以及pH 3.8醋酸鹽緩沖液時,鹽酸地巴唑片在10 min內的溶出率可超過95%。當溶出介質為pH 4.5磷酸鹽緩沖液時,45 min溶出率可達95%。溶出介質為pH 5.8,6.8磷酸鹽緩沖液時,曲線拐點出現在45 min,而在60 min的溶出率達85%。對比企業J的制劑工藝,可發現主要輔料為淀粉和糊精,未采用其他崩解劑。而鹽酸地巴唑在pH 5.8,6.8磷酸鹽緩沖液中的溶解度較低,所以片劑在這2個溶出介質中的溶出速率較慢。
4)含量均勻度
現行質量標準[4]無此項。含量均勻度是小劑量固體制劑及較難混勻的非均相制劑的重要質量指標之一。抽驗鹽酸地巴唑片樣品的規格均為10 mg,按2020年版《中國藥典(四部)》通則0941含量均勻度檢查法要求,采用紫外-可見分光光度法在270 nm波長處測定吸光度,并計算含量。結果樣品的含量均勻度均值在89.7%~107.7%之間,有9批次樣品的A+2.2 S值>15.0(企業E,H,K分別有1,3,5批次)。通過與重量差異項數據的比較可見,重量差異與含量均勻度存在相關性(見圖7)。

圖7 重量差異與含量均勻度折線圖Fig.7 Broken line chart of weight difference and content uniformity
5)含量測定
現行質量標準中采用高氯酸滴定法測定鹽酸地巴唑原料及片劑的含量。而測定原料含量時需用到醋酸汞溶液,醋酸汞毒性大,易污染環境;且測定片劑含量時,會以較大量的三氯甲烷和丙酮為溶劑,該2種溶劑均屬易制毒化學品,需進行特殊管理。參考文獻[6],通過高效液相色譜法測定鹽酸地巴唑原料及片劑的含量,并進行方法學驗證。色譜條件,流動相為水-甲醇-冰醋酸-三乙胺(45∶55∶0.5∶0.5,V/V/V/V),檢測波長為220nm,進樣量為10μL(供試品溶液質量濃度為20μg/mL)。
對于鹽酸地巴唑原料,兩組數據的均值無顯著差異(P>0.05)。但由于僅有6批次的檢驗數據,樣品量過少,無法判斷其是否服從正態分布。對于鹽酸地巴唑片,2種方法的數據結果服從近似正態分布,通過Levene檢驗進行方差齊性檢驗,P=0.059,表明兩組數據符合方差齊性,兩者精密度無顯著性差異。行配對t檢驗,結果表明,兩組數據的均值無顯著差異(P=0.136>0.05)。
3 討論
通過探索性研究發現,1)部分鹽酸地巴唑片表面存在不同程度和數量的黑色、灰色或褐色斑點,可能是由輔料引入,且壓片機缺乏及時保養維護也會造成片劑表面存在斑點。2)現行質量標準中缺乏有關物質項。在探索性研究中,對鹽酸地巴唑的起始原料和工藝雜質進行分離,并對工藝雜質進行了結構推斷,確認該雜質為2-(羥基苯基)苯并咪唑。部分企業的最大未知雜質量和未知雜質總量批間差異較大。3)現行質量標準中缺乏溶出度項。探索性研究發現,鹽酸地巴唑片的溶出速率隨著溶出介質pH的升高而減慢,到達平衡時間延長。大部分企業樣品在pH 1.0鹽酸溶液介質中30 min時達到平衡,部分企業在15 min達到平衡;77批樣品在30 min時溶出度大于85%。4)現行質量標準中缺乏含量均勻度項。根據2020年版《中國藥典(四部)》通則0941要求,該片劑應進行含量均勻度檢查。探索性研究發現,77批次樣品中有9批次樣品的A+2.2 S值>15.0。5)現行質量但標準中采用高氯酸滴定法測定鹽酸地巴唑片的含量,且測定過程中使用大量的三氯甲烷和丙酮作為溶劑,毒性較大。探索性研究時,選擇高效液相色譜法測定鹽酸地巴唑片含量,并與高氯酸滴定法的測定結果進行比較,結果兩組數據均值無顯著差異。
本研究中采取法定檢驗結合探索性研究模式對鹽酸地巴唑片進行評價性抽驗,從標準到質量進行了較全面的分析和評價。由法定檢驗可知,目前鹽酸地巴唑片性狀不符合規定情況較嚴重;部分企業產品在重量差異和含量測定項目中,批間與批內存在較大差異。通過探索性研究可知,在有關物質、溶出度、含量均勻度項目中,部分企業存在批間與批內差異較大的問題。同時,鹽酸地巴唑片的現行質量標準制定于1989年,在項目設置等方面存在不足,已不能滿足現階段對產品質量有效控制的基本要求。
綜上所述,鹽酸地巴唑片總體質量水平一般,建議相關企業改進和完善生產工藝,提高產品質量。同時,由于現行質量標準不完善,有效性和安全性指標設立不足,不能完全有效控制藥品質量,需盡快提高質量標準。

