長鏈非編碼RNA LOC653786誘導肺癌細胞抵抗吉西他濱的信號機制研究
徐俊燕,劉 峰,項 艷
0 引言
肺癌是常見的呼吸系統惡性腫瘤,嚴重威脅著患者的身心健康[1]。由于肺癌早期癥狀不明顯,多數患者一經發現已經是中晚期[2]。隨著醫藥衛生事業的發展,當前肺癌的治療方法已經不局限于手術、化學治療和放射治療,還增加了靶向治療、免疫治療、消融治療等[3]。其中化學治療仍然是肺癌治療的主要方法之一,但獲得性耐藥的出現最終往往導致化學藥物治療失敗[4]。因此,如何攻克獲得性耐藥是臨床面臨的嚴峻挑戰。
吉西他濱為嘧啶類抗腫瘤藥物,主要通過抑制DNA合成,抑制細胞從G1期向S期轉化,最終抑制腫瘤細胞生長[5]。目前,吉西他濱在臨床上可應用于治療中晚期非小細胞肺癌、胰腺癌、膀胱癌、乳腺癌等實體腫瘤[6]。由于吉西他濱具有廣譜抗腫瘤活性,在卵巢癌、乳腺癌、膀胱癌、宮頸癌及腎細胞癌的臨床治療中也具有一定療效[7]。但應用一段時間后,腫瘤患者最終會對吉西他濱耐藥。而目前還沒有較好的方案解決吉西他濱耐藥,因此,需要更多的基礎理論依據為其提供支持。
長鏈非編碼RNA(Long non-coding RNA,LncRNA)是一類非編碼RNA,長度一般為200~100 000 nt[8]。近年來研究顯示,lncRNA在多種疾病的發生發展中發揮重要作用,如冠心病、糖尿病及惡性腫瘤等[9]。LncRNA LOC653786是lncRNA大家族的一員,研究顯示,LOC653786能調節腎細胞癌的增殖和周期進展[10]。本研究通過構建吉西他濱耐藥肺癌細胞,觀察LncRNA LOC653786 在其中的作用,并對其信號機制進行研究,為臨床解決肺癌耐藥提供基礎理論支持。
1 材料與方法
1.1 材料 人肺癌A549細胞(南京科佰生物科技有限公司);吉西他濱和二甲基亞砜(Dimethyl sulfoxide,DMSO)(美國Sigma Aldrich公司);總蛋白提取試劑盒和蛋白定量試劑盒(北京索萊寶公司);MTT粉末(上海碧云天公司);磷酸鹽緩沖液(Phosphate Buffer solution,PBS)(美國Hyclone公司);胎牛血清(Fetal bovine serum,FBS)和DMEM高糖培養基(美國Gibco公司);LncRNA LOC653786和FOXM1小干擾RNA(Small interfering RNA,siRNA)轉染試劑盒(上海吉瑪公司);叉頭框轉錄因子M1(Forkhead frame transcription factor M1,FOXM1)抗體、多藥耐藥相關蛋白1(Multidrug resistance associated protein1,MRP1)抗體和P-糖蛋白(P-glycoprotein,P-gp)抗體(美國Santa Cruz公司);GAPDH抗體和抗鼠IgG,HRP二抗(上海愛必信公司)。ABI 7500型實時熒光定量PCR儀(美國ABI公司);Multiskan FC 酶標儀和EVOS M5000倒置顯微鏡(美國ThermoFisher公司);OptimaTMXPN超速離心機(美國貝克曼公司產品);AI600凝膠成像儀(美國GE公司)。
1.2 方法
1.2.1 細胞培養和藥物配制 A549細胞培養體系為10% FBS、1%青霉素-鏈霉素和89% DMEM高糖培養基(即下文全培養基)。細胞培養環境為恒溫37 ℃、5% CO2及95%空氣的培養箱。吉西他濱以DMSO溶解,配制成200 μmol/L母液,分裝凍存于-80 ℃備用。
1.2.2 A549/GR細胞的構建 A549細胞生長至對數期后,以含有10 μmol/L吉西他濱全培養基培養并傳代2次,而后更換為正常全培養基并傳代2次。通過逐步增加吉西他濱濃度(每次增加10~30 μmol/L)重復進行上述操作,最終獲得一株耐藥細胞A549/GR。通過MTT法計算A549/GR細胞耐藥指數。
1.2.3 MTT 檢測細胞增殖能力 將所需細胞培養至對數期,以9×103個/孔傳代至96孔板中。次日,加入含梯度濃度(10、20、40、80、160和320 μmol/L)吉西他濱的全培養基150 μl處理48 h,同時以等量DMSO處理細胞作為對照組。處理結束后,每孔加入15 μl MTT,置于培養箱繼續培養4 h。4 h后棄去培養液,每孔加入150 μl DMSO,敲打培養板側壁30 s。在A490nm處測量各孔的吸光值,計算細胞增殖抑制率。
1.2.4 RT-qPCR法檢測細胞中LOC653786相對表達水平 所需細胞培養至對數期后,以Trizol法提取總RNA。于酶標儀上檢測總RNA濃度,將總RNA稀釋至500 ng/μl。采用反轉錄試劑盒將總RNA反轉錄為cDNA,于酶標儀上檢測cDNA濃度。稀釋LOC653786和內參GAPDH引物,按RT-qPCR試劑盒說明書依次加入引物、cDNA和反應試劑,進行RT-qPCR檢測。反應條件為95 ℃ 10 min 1個循環,95 ℃ 2s、60 ℃ 30s、70 ℃ 5s 40個循環。LOC653786正向引物:GGAAAAGGCAACAGATGTCCA,LOC653786 反向引物:GGAAGCTGCTTGCAGAAGGAT;GAPDH正向引物:TGTGGGCATCAATGGATTTGG,GAPDH反向引物:ACACCATGTATTCCGGGTCAAT。
1.2.5 siRNA轉染沉默LOC653786或FOXM1表達 將A549/GR 細胞分別設為未轉染組(Control)、轉染對照組(NC)和LOC653786沉默組(LOC653786 si)。將對數期A549/GR 細胞以5×105接種于6孔板中。次日按試劑盒說明書制備Lipofectamine 2000和siRNA混合液(LOC653786 siRNA和對照siRNA)靜置10 min。LOC653786 si組以Lipofectamine 2000和LOC653786 siRNA(60 pmol/ml)處理,NC組以Lipofectamine 2000和對照siRNA處理(60 pmol/ml)處理,Control組以等體積培養基處理。轉染24 h后更換全培養基。以熒光顯微鏡觀察siRNA進入細胞情況,RT-qPCR驗證LOC653786沉默效果。
將A549/GR 細胞分別設為未轉染組(Control)、轉染對照組(NC)和FOXM1沉默組(FOXM1 si)。按上文轉染步驟進行轉染操作。以熒光顯微鏡觀察siRNA進入細胞情況,蛋白印記實驗驗證FOXM1沉默效果。
1.2.6 蛋白印跡檢測蛋白表達 細胞按要求處理后,采用RIPA裂解液(含1 mM蛋白酶抑制劑)提取總蛋白。總蛋白通過BCA蛋白定量試劑盒進行定量,并以蛋白上樣緩沖液制備含3 μg/μl總蛋白的蛋白樣品。通過SDS-PAGE電泳將蛋白樣品中不同分子量的蛋白分離,而后將蛋白從凝膠轉印至PVDF膜上。將載有蛋白質的PVDF膜用5%脫脂牛奶封閉4 h。裁剪PVDF膜,將對應膜以FOXM1抗體(1∶500)、MRP1抗體(1∶1 000)或P-gp抗體(1∶1 000)在4 ℃ 孵育過夜。次日TBST洗膜后加入抗鼠IgG,HRP二抗(1∶4 000)孵育1 h,TBST洗膜后,以ECL化學發光試劑盒在AI600凝膠成像儀下成像,對蛋白條帶進行處理和分析。
1.2.7 流式細胞儀檢測細胞凋亡 將處理好的細胞收集于5 ml離心管中,1 000 r/min離心5 min,棄去培養液。3 ml PBS吹打細胞,1 200 r/min離心5 min,棄去培養液,加入500 μl Binding Buffer重懸細胞。各加入5 μl Annexin V-FITC混勻,再加入5 μl PI混勻。室溫避光孵育10 min,于流式細胞儀檢測細胞凋亡水平。
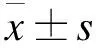
2 結果
2.1 A549/GR細胞對吉西他濱的耐藥檢測 MTT結果顯示,與A549細胞相比,10、20、40、80、160和320 μmol/L吉西他濱對A549/GR細胞的抑制率均顯著下降(P<0.05或P<0.01),見表1。吉西他濱對A549和A549/GR細胞的IC50分別為32.3 μmol/L和192.3 μmol/L,A549/GR的耐藥指數為6.0。

表1 吉西他濱對A549和A549/GR細胞增殖能力的影響
2.2 LncRNA LOC653786在A549/GR細胞中表達上調 RT-qPCR檢測結果顯示,相較于A549細胞,A549/GR細胞LncRNA LOC653786表達水平顯著上調(P<0.01),見圖1。

圖1 A549和A549/GR細胞LncRNA LOC653786表達水平注:**與A549細胞比較,P<0.01
2.3 FOXM1、MRP1和P-gp蛋白在A549/GR細胞中表達上調 蛋白印記結果顯示,與A549細胞相比,A549/GR細胞FOXM1、MRP1和P-gp蛋白表達均明顯上調(P<0.01)。見圖2。

圖2 A549和A549/GR細胞中FOXM1、MRP1和
2.4 沉默LOC653786表達抑制A549/GR細胞FOXM1、MRP1和P-gp蛋白表達上調 NC組和LOC653786 si組A549/GR細胞轉染后均顯示綠色熒光,見圖3A。與NC組相比,LOC653786 si組LOC653786表達顯著降低(P<0.01),見圖3B。蛋白印記結果顯示,相較于NC組,LOC653786 si組FOXM1、MRP1和P-gp蛋白表達均顯著下調(P<0.01),見圖3C-3D。

圖3 沉默LOC653786表達對A549/GR細胞MRP1和P-gp蛋白表達的影響注:**與 NC 組比較,P<0.01
2.5 沉默FOXM1抑制A549/GR細胞MRP1和P-gp蛋白表達上調 轉染法沉默A549/GR細胞FOXM1蛋白表達,如圖4所示,NC組和FOXM1 si組成功進行轉染,均顯示綠色熒光。蛋白印記結果顯示,與NC組相比,FOXM1 si組FOXM1、MRP1和P-gp蛋白表達均明顯下調。RT-qPCR結果顯示,NC組和FOXM1 si組LOC653786表達無明顯差異。

圖4 沉默FOXM1對A549/GR細胞MRP1和P-gp蛋白以及LOC653786表達的影響注:**與NC組比較,P<0.01
2.6 各組A549/GR細胞對吉西他濱的敏感性 流式細胞儀結果顯示,吉西他濱處理能一定程度誘導NC組細胞凋亡,但作用并不明顯。而沉默LOC653786或FOXM1后,吉西他濱均能明顯誘導細胞凋亡增加(P<0.01)見圖5A-C。
3 討論
早期研究認為,LncRNA是基因組轉錄的副產物,不具備生物學作用[11]。但近年來研究發現,LncRNA廣泛參與染色質修飾、轉錄激活、轉錄干擾等多種生物學調控,并且在心血管疾病、糖尿病、神經退行性疾病中發揮一定作用[12-13]。越來越多的研究顯示,LncRNA在包括肺癌在內的多種惡性腫瘤中異常表達,與腫瘤的發生發展密切相關[14]。一些LncRNA還參與惡性腫瘤的耐藥形成[15]。本研究構建了吉西他濱耐藥肺癌細胞A549/GR,耐藥指數為6.0。分子水平上發現,A549/GR細胞MRP1和P-gp蛋白表達顯著上調。研究報道,MRP1和P-gp蛋白能夠介導耐藥,并在多種耐藥腫瘤中表達升高[16]。本研究發現,相較A549細胞,A549/GR細胞LncRNA LOC653786表達明顯上調。提示LOC653786可能與A549/GR細胞吉西他濱耐藥有關。本研究還發現,FOXM1蛋白表達在A549/GR細胞中顯著上調。FOXM1是調控有絲分裂進程的重要的細胞周期轉錄因子,在細胞增殖、分化、凋亡中發揮重要作用[17]。研究顯示,LncRNA LOC653786可通過FOXM1蛋白介導腎細胞癌細胞增殖[10]。提示FOXM1是LncRNA LOC653786的下游信號靶點。還有研究顯示,FOXM1參與膠質瘤、骨肉瘤等惡性腫瘤的化療耐藥[18-19]。這些提示在本研究中,LncRNA LOC653786可能通過FOXM1蛋白介導MRP1和P-gp蛋白表達,從而促進A549/GR細胞吉西他濱耐藥。
為進一步驗證,本研究采用siRNA干擾技術干擾LncRNA LOC653786表達。結果發現,干擾LOC653786表達能明顯下調A549/GR細胞FOXM1蛋白表達,提示LncRNA LOC653786能介導FOXM1蛋白表達。本研究還發現,干擾LncRNA LOC653786或FOXM1表達均可下調A549/GR細胞MRP1和P-gp蛋白表達,提示在A549/GR細胞中,高水平的LncRNA LOC653786可通過上調FOXM1蛋白表達而介導MRP1和P-gp蛋白表達升高。通過流式細胞儀檢測吉西他濱對A549/GR細胞凋亡的誘導發現,干擾LncRNA LOC653786或FOXM1表達均可增強吉西他濱誘導的A549/GR細胞凋亡。
綜上所述,LncRNA LOC653786與肺癌細胞吉西他濱耐藥有關。LncRNA LOC653786能介導FOXM1蛋白表達,從而誘導MRP1和P-gp蛋白表達上調,最終參與吉西他濱耐藥。本研究揭示了LncRNA LOC653786介導肺癌細胞耐藥的潛在機制,可為臨床治療肺癌耐藥提供理論依據。但LOC653786在肺癌細胞中的生物學作用及相關機制尚不明確,有待于進一步研究。

