吡嗪酰胺酶活性與耐多藥肺結核近期臨床療效的相關性研究
吳碧彤 蔡杏珊 鄺浩斌 劉志輝 孟繁榮 王楠 高俊文 譚守勇
吡嗪酰胺(pyrazinamide)是唯一具有殺滅酸性環境中或巨噬細胞內半休眠狀態結核分枝桿菌效果的抗結核藥品,其可顯著縮短初治肺結核的治療療程,提升治愈率。隨著吡嗪酰胺在結核病治療領域的廣泛應用,其耐藥率明顯上升[1]。吡嗪酰胺耐藥率上升給耐多藥肺結核(multidrug-resistant pulmonary tuberculosis,MDR-PTB)的治療帶來不利影響,但現階段吡嗪酰胺的藥物敏感性試驗(簡稱“藥敏試驗”)存在諸多缺陷,如陽性率低、檢測周期長、檢測重復性差等[2]。由于吡嗪酰胺僅在pH值為5.5的酸性條件下才能轉化為具有殺菌活性的吡嗪酸,而結核分枝桿菌在酸性環境下生長不良,使傳統藥物敏感性檢測方法不能可靠地反映菌株對吡嗪酰胺的耐藥情況,進而導致吡嗪酰胺耐藥性檢測成為實驗室檢查的一個難題。吡嗪酰胺的殺菌作用是在吡嗪酰胺酶的作用下轉化為有活性的吡嗪酸,吡嗪酸能夠對結核分枝桿菌產生殺滅作用。有研究發現,吡嗪酰胺耐藥菌株的出現可能與吡嗪酰胺酶的活性喪失有關,吡嗪酰胺酶失活將導致吡嗪酰胺無法轉變為吡嗪酸,進而無法實現殺滅結核分枝桿菌的效果[3-4]。為明確吡嗪酰胺酶活性檢測是否有利于指導MDR-PTB患者使用吡嗪酰胺進行治療,本研究采用前瞻性的研究方法,分析了吡嗪酰胺酶活性、吡嗪酰胺表型耐藥與MDR-PTB近期臨床療效的相關性。
資料和方法
一、研究對象
本研究經廣州市胸科醫院醫學倫理委員會批準(批準編號:胸醫倫理〔2017〕26號),患者知情并同意研究的內容。研究將廣州市胸科醫院2018年7月1日至2019年12月31日收治的85例MDR-PTB患者作為研究對象。其中,男性54例,女性31例;年齡23~57歲,平均年齡(38.6±7.4)歲;73例并發空洞。剔除9例丟失、中斷治療、失訪患者,最終76例納入研究。76例患者中,病灶位于左側9例,右側17例,雙側50例;67例患者并發空洞。
二、納入、排除及退出標準
1. 納入標準:(1)符合《WHO耐藥結核病治療指南(2016更新版)》[5]中關于耐多藥結核病的診斷標準;(2)年齡18~65歲;(3)治療前痰培養為陽性,并獲得一二線抗結核藥物藥敏試驗結果;(4)患者同意抗結核治療并簽署參與項目同意書。
2. 排除標準:(1)存在二線注射類抗結核藥品(卡那霉素、阿米卡星、卷曲霉素)耐藥和(或)氟喹諾酮類藥品(氧氟沙星、左氧氟沙星、莫西沙星)耐藥;(2)合并嚴重肝病[如丙氨酸氨基轉移酶(ALT)或天門冬氨酸氨基轉移酶(AST)≥2.5倍正常值];(3)合并腎病史(如血肌酐>177 μmol/L);(4)合并精神疾病史;(5)孕婦及糖尿病患者;(6)合并塵肺病史;(7)HIV抗體陽性;(8)長期使用免疫抑制劑;(9)嚴重營養不良。
3. 退出標準:(1)因藥物不良反應而更改治療方案;(2)中斷治療≥2個月;(3)失訪。
三、研究方法

2. 治療方法:所有患者均給予WHO推薦的耐多藥結核病治療方案(6Am-Mfx-PZA-Pto-Cs/18Mfx-PZA-Pto-Cs)進行治療。具體用藥方法:阿米卡星0.4 g/次,1次/d,肌內注射或靜脈注射;莫西沙星0.4 g/次,1次/d,口服;吡嗪酰胺1.5 g/次,1次/d,口服;丙硫異煙胺0.2 g/次,3次/d,口服;環絲氨酸0.25 g/次,2次/d,口服。治療期間對患者進行隨訪跟蹤,每個月進行復查,包括3次痰涂片找抗酸桿菌、1次痰結核分枝桿菌培養,記錄患者每個月的痰菌情況及藥物不良反應發生情況;每2個月行1次胸部X線攝片檢查,記錄病灶變化情況。
3. 吡嗪酰胺酶活性檢測:采用Wayne法檢測,將2.35 g 7H9肉湯培養基,450 ml超純水,2 ml甘油,400 μg/ml 吡嗪酰胺,1.5%瓊脂糖混勻高壓滅菌,分裝5 ml于滅菌管中,保持管直立,備用。從羅氏培養基上刮取盡可能多的生長良好的細菌,分別接種于2個培養管中,于37 ℃培養,其中一管培養7 d,另一管培養14 d。培養7 d后取出一管加入1 ml 1%的硫酸亞鐵氨(現用現配),于4 ℃冰箱內放置4 h后取出,在日光燈下,以白紙作為背景,通過肉眼觀察培養管中的顏色變化,結果至少經過2名研究者確認。結果判讀:透明培養管中出現紅色條帶者(各種程度),即為吡嗪酰胺酶陽性;如無紅色條帶,14 d后取出第二管,依上法進行測定,如仍無紅色條帶即為吡嗪酰胺酶陰性。
4. 吡嗪酰胺藥物敏感性檢測:采用BACTEC MGIT 960系統法,取結核分枝桿菌培養物,制備1 mg/ml 菌懸液,稀釋到106CFU/L,取0.5 ml菌懸液加入至吡嗪酰胺藥敏試驗專用MGIT培養管中(含吡嗪酰胺添加劑,藥物濃度100 μg/ml);以菌懸液1∶10的比例稀釋加入至吡嗪酰胺藥敏專用MGIT培養管中(生長對照管;不含吡嗪酰胺)。然后置于BACTEC MGIT 960儀器中,儀器根據分枝桿菌生長情況自動報告藥敏試驗結果。
5. 療效評估:比較MDR-PTB患者治療2、4、6個月末痰菌陰轉、病灶吸收和空洞閉合情況。
1)痰菌陰轉:采集患者痰液,痰液涂片檢查抗酸桿菌3次,結果均呈陰性,視為痰菌陰轉。
2)病灶吸收:(1)顯著吸收:病灶吸收≥1/2原病灶;(2)吸收:病灶吸收<1/2原病灶;(3)不變:病灶無明顯變化;(4)惡化:病灶擴大。吸收率(%)=(顯著吸收例數+吸收例數)/總例數×100%。
3)空洞閉合:(1)閉合:空洞閉合或阻塞閉合;(2)縮小:空洞縮小≥原空洞直徑的1/2;(3)不變:空洞縮小或增大<原空洞直徑的1/2;(4)增大:空洞增大>原空洞直徑的1/2。空洞閉合有效率(%)=(閉合例數+縮小例數)/總例數×100%。
4)不良反應:包含胃腸道不良反應、腎功能損傷、肝損傷、神經系統損傷、疲勞等。
四、統計學處理
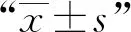
結 果
一、基線資料的比較
76例患者中,根據吡嗪酰胺藥敏試驗結果分為吡嗪酰胺耐藥(36例,47.4%)和吡嗪酰胺敏感(40例,52.6%);根據吡嗪酰胺酶活性檢測結果,分為吡嗪酰胺酶陽性(32例,42.1%)和吡嗪酰胺酶陰性(44例,57.9%);吡嗪酰胺藥物敏感性檢測與吡嗪酰胺酶活性檢測診斷結果一致性較高(Kappa=0.687)。吡嗪酰胺酶陽性與吡嗪酰胺酶陰性患者基線資料的比較,差異均無統計學意義(P值均>0.05)。見表1。

表1 不同臨床特征在吡嗪酰胺酶陽性和陰性患者中的分布情況
二、吡嗪酰胺酶陽性與治療結果的關系
吡嗪酰胺酶陽性患者治療4個月末病灶吸收率及空洞閉合有效率均高于吡嗪酰胺酶陰性患者,差異均有統計學意義(P值均<0.05);吡嗪酰胺酶陽性患者治療6個月末空洞閉合有效率高于吡嗪酰胺酶陰性患者,差異有統計學意義(P<0.05);兩組患者在治療2、4及6個月末痰菌陰轉率的比較,差異均無統計學意義(P值均>0.05);兩組患者在治療2、4及6個月末藥物不良反應發生率的比較,差異均無統計學意義(P值均>0.05)。見表2~5。

表2 吡嗪酰胺酶活性與耐多藥肺結核患者治療后不同時間點痰菌陰轉情況的比較[例(陰轉率,%)]
三、藥物不良反應發生情況
吡嗪酰胺酶陽性患者在治療2個月末有3例患者出現藥物性肝損傷,經護肝治療后好轉;1例出現尿酸升高,無關節疼痛表現,調整低尿酸飲食后好轉;治療4個月末有2例患者出現手足末端指關節麻木感,考慮為環絲氨酸導致的神經毒性,加用維生素B6(200 mg/次,3次/d)治療后癥狀好轉;治療6個月末有1例患者出現聽力下降,考慮為阿米卡星引起的不良反應,在強化期結束,停用阿米卡星后,患者聽力恢復。

表3 吡嗪酰胺酶活性與耐多藥肺結核患者治療后不同時間點病灶吸收情況的比較[例(吸收率,%)]

表4 吡嗪酰胺酶活性與耐多藥肺結核患者治療后不同時間點空洞閉合有效情況的比較[例(有效率,%)]

表5 吡嗪酰胺酶活性與耐多藥肺結核患者治療后不同時間點不良反應發生情況的比較[例(發生率,%)]
吡嗪酰胺酶陰性患者在治療2個月末有1例出現藥物性肝損傷,經護肝治療后好轉;2例出現尿酸升高,伴關節疼痛表現,給予別嘌呤醇治療后尿酸有所下降;2例出現胃腸道不良反應,在調整為餐后服藥后癥狀有所緩解;治療4個月末有1例患者出現明顯疲乏的癥狀,加用維生素B6治療后癥狀好轉;另有1例出現尿酸升高,經控制飲食后好轉。治療6個月末有2例患者出現聽力下降,停用阿米卡星后聽力恢復;2例患者出現促甲狀腺激素升高,經減少丙硫異煙胺用量后,促甲狀腺激素降至正常水平。
討 論
吡嗪酰胺是抗結核化學治療的重要藥品,是唯一可在酸性環境中殺滅半休眠狀態結核分枝桿菌的藥品,可縮短抗結核治療療程。Njire等[6]研究發現,吡嗪酰胺在原發性MDR-PTB患者治療的預后優于未使用吡嗪酰胺的患者,且遠期復發率低于未使用吡嗪酰胺的患者。吡嗪酰胺與氟喹諾酮類藥物及異煙肼聯合使用可提升殺菌活性[7]。WHO于2016年制定的《WHO耐藥結核病治療指南(2016更新版)》[5]建議,耐多藥結核病患者治療的強化期至少選用包括吡嗪酰胺和4種核心的二線抗結核藥品。Shi 等[8]提出,吡嗪酰胺本身并無抗菌活性,其可被動擴散進入結核分枝桿菌內,通過破壞跨膜質子濃度,影響膜的能量代謝及膜的運輸能力,引發細菌死亡。Khan等[9]和Bouzouita等[10]的研究發現,吡嗪酸可綁定對結核分枝桿菌至關重要的核糖體蛋白S1(RpsA),抑制其與tmRNA之間的結合,阻止DNA編碼蛋白途徑,抑制維系結核病生存的蛋白,實現抑菌的功效,吡嗪酰胺耐藥菌株與吡嗪酰胺酶活性喪失密切相關。因此,吡嗪酰胺酶活性可作為吡嗪酰胺在耐多藥結核病療效評估中的重要指標。
隨著吡嗪酰胺的廣泛應用,其耐藥情況也日漸嚴重。車洋等[11]對浙江省寧波地區的110株耐多藥結核分枝桿菌菌株吡嗪酰胺耐藥性進行檢測,發現耐藥率高達59.09%,且耐多藥結核分枝桿菌菌株的吡嗪酰胺耐藥性與鏈霉素、乙胺丁醇、氧氟沙星、左氧氟沙星的耐藥性密切相關。Yee等[12]對218例耐多藥結核病患者進行的研究發現,單耐吡嗪酰胺治愈率低于全敏感患者,復發率及死亡率高于全敏感患者。筆者前期對120例MDR-PTB患者采用WHO推薦的含吡嗪酰胺的治療方案,截至24個月的隨訪研究發現,吡嗪酰胺敏感的耐多藥結核病患者的病灶吸收率高于吡嗪酰胺耐藥的患者;吡嗪酰胺敏感的耐多藥結核病患者的痰菌陰轉率高于吡嗪酰胺耐藥的患者,差異均有統計學意義[13]。
目前,傳統吡嗪酰胺表型藥敏試驗存在諸多缺陷,包括檢測陽性率低、檢測周期長及不同實驗室的檢測結果一致性較差等。由于對吡嗪酰胺敏感的結核分枝桿菌可產生吡嗪酰胺酶,其可將吡嗪酰胺分解為有活性功能的吡嗪酸,而耐吡嗪酰胺者則缺少此酶。因此,測定吡嗪酰胺酶活性代替吡嗪酰胺藥物敏感性檢測可能是一種有效的篩選方法,本研究結果也顯示吡嗪酰胺表型藥敏試驗與吡嗪酰胺酶活性檢測方法的診斷結果一致性較高。檢測吡嗪酰胺酶活性的常見方法為Wayne 法,Wayne法陰性被認為吡嗪酰胺酶無活性,結核分枝桿菌對吡嗪酰胺耐藥。本研究顯示,吡嗪酰胺酶陽性患者在治療4個月末的病灶吸收率及空洞閉合有效率,以及治療6個月末的空洞閉合有效率均高于吡嗪酰胺酶陰性患者,差異均有統計學意義;但是兩組患者在治療2、4及6個月末痰菌陰轉率的比較,差異均無統計學意義。考慮結核空洞的形成可導致局部低氧環境及酸性環境的改變,均可增強吡嗪酰胺的活性,且方案中包含了氟喹諾酮類藥物,吡嗪酰胺與氟喹諾酮類藥物有協同殺菌作用,可增強療效,研究結果顯示治療2個月末吡嗪酰胺酶陽性患者的空洞閉合有效率雖較吡嗪酰胺酶陰性患者有所升高,但未達到有統計學意義的標準,考慮可能與本研究患者例數少,且影像學上吸收改變存在延遲有關。但總體仍說明對吡嗪酰胺敏感的MDR-PTB患者治療效果優于對吡嗪酰胺耐藥的MDR-PTB患者,與文獻[14-16]的研究結論較為符合。
本研究的局限性在于,研究樣本量較小,且為非多中心研究,可能對研究結果產生偏倚。同時由于在進行此項研究時,利奈唑胺、貝達喹啉等藥物在本院未能獲得有效供應,因此所采用的是WHO早先提出的耐多藥結核病治療方案,而非近年的治療方案。對吡嗪酰胺酶活性檢測法為生化顯色反應,檢測結果的判讀會存在主觀性誤判的可能,且吡嗪酰胺酶活性檢測法要求檢測樣本新鮮和樣本量大,如樣本不符合要求可能會導致無紅色條帶出現,從而導致結果的誤判。此外,由于研究時間較短,本研究中MDR-PTB患者療效均為強化期后進行的評估,未納入鞏固期療效數據,吡嗪酰胺敏感性及吡嗪酰胺酶活性對遠期療效的影響值得進一步探討。吡嗪酰胺耐藥性與pncA基因突變關聯密切[17-19],但是吡嗪酰胺酶活性與pncA基因突變的關聯尚未明確,本研究并未對全部患者的耐藥菌株進行基因檢測,故上述基因誘發吡嗪酰胺酶活性的確切關聯還要留待后續研究加以明確。

