子宮內膜癌分子檢測中國專家共識(2021年版)
中國抗癌協會婦科腫瘤專業委員會,中華醫學會病理學分會,國家病理質控中心
子宮內膜癌是常見的婦科惡性腫瘤之一,發病率逐年上升。2020年中國子宮內膜癌新發病例81 964例,死亡病例16 607例[1-2]。風險因素包括高體重指數(body mass index,BMI)、糖尿病、代謝綜合征、雌激素治療、不孕、初潮早、絕經晚、林奇綜合征、Cowden綜合征、聚合酶校正相關息肉綜合征(polymerase proofreading-associated polyposis,PPAP)等[3-4]。90%以上的子宮內膜癌患者發病年齡超過50歲,中位診斷年齡為63歲[3];4%的患者診斷時小于40歲[5],部分患者有保留生育功能的意愿。80%的子宮內膜癌患者診斷時為早期,腫瘤局限在子宮體內,其5年生存率大于95%[3],如有局部擴散或遠處轉移,則5年生存率分別降至68%或17%[6]。
1983年Bokhman[7]依據臨床病理學特征和預后將子宮內膜癌分為兩種類型:Ⅰ型為雌激素依賴型,與肥胖、高血脂、雌激素水平升高相關,包含1~2級的子宮內膜樣癌,發現時多為早期,通常預后較好[4];Ⅱ型為非雌激素依賴型,包含3級的子宮內膜樣癌和非子宮內膜樣腫瘤(如漿液性癌和透明細胞癌)[8],發現時偏晚期,預后較差[9]。Bokhman分型過于簡單,Ⅰ和Ⅱ型定義標準相對模糊,重現性不好,重要區分因素(如肥胖或糖尿病、組織病理學特征)有時難以清晰定義Ⅰ和Ⅱ型;同時組織學診斷存在較大的觀察者誤差,例如部分高級別子宮內膜樣癌與漿液性癌形態學特征相似,難以區分;且對患者復發風險分層不夠精確,在指導后續治療選擇上的作用非常有限,無法有效地指導臨床實踐[6,10]。
2013年,癌癥基因組圖譜(The Cancer Genome Atlas,TCGA)多組學研究[10]全面揭示了子宮內膜癌的分子遺傳圖譜,提出新的分子分型策略,依據多組學特征和預后的關聯性分為4個亞型:POLE(ultramutated)、MSI(hypermutated)、copynumber high(serous-like)和copy-number low(endometrioid),用于患者預后和復發風險評估。TCGA研究通過高通量測序進行分型,臨床實現難度大,后被簡化成ProMisE分型[11],通過錯配修復(mismatch repair,MMR)蛋白、p53蛋白和POLE基因檢測進行分型(4種分子分型分別為POLEEDM、MMR-D、p53 wt和p53 abn),與TCGA分型一致性非常高,更貼合臨床實踐,簡單易操作,該分子分型遂逐步進入臨床實踐中。2016年,Stelloo等[12]結合ProMisE分型、CTNNB1 exon3突變和臨床病理學風險因子,提出Tans-PORTEC分型(favorable、intermediate和unfavorable),對中高危患者進行精準的風險分層,分子分型開始用于指導臨床輔助治療的選擇。2020年,分子分型被納入美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)指南和世界衛生組織(World Health Organization,WHO)女性生殖器官腫瘤分類標準(第5版)中。2021年,基于分子分型的風險評估規則被納入歐洲婦科腫瘤協會(European Society of Gynaecological Oncology,ESGO)指南中[13]。目前,國內關于分子分型的檢測和臨床應用還處于起步階段,檢測方法有待規范,對預后預測或輔助治療選擇的臨床價值也需進一步討論。
此外,3%~5%的子宮內膜癌與林奇綜合征有關,中位發病年齡48歲,較普通患者早10~20歲。目前,國內對林奇綜合征患者的篩查和臨床管理流程的標準化認識尚有不足。同時,高通量測序技術的發展,加深了我們對子宮內膜癌發病機制和分子遺傳特征的理解,基于分子遺傳特征的個體化精準治療,同樣革新了子宮內膜癌的治療手段,為復發或轉移的患者提供了靶向治療、免疫檢查點抑制劑治療等選擇。鑒于上述情況和子宮內膜癌在分子分型、個體化治療等領域的最新研究進展,我們針對子宮內膜癌腫瘤組織標本的分子病理學檢測制訂了《子宮內膜癌分子檢測中國專家共識》(以下簡稱本共識),希望通過本共識,提高中國臨床工作者對于子宮內膜癌分子檢測的認識,提高中國子宮內膜癌的臨床診治水平。
所有新確診的子宮內膜癌患者,推薦進行MMR/MSI狀態檢測,樣本可為活檢、刮宮或手術切除的腫瘤標本,檢測具有以下臨床價值:
①診斷:dMMR或MSI-H可以作為子宮內膜樣癌的診斷標志物;②篩查:林奇綜合征篩查;③預后:分子分型判斷預后;④免疫治療效果預測:預估免疫檢查點抑制劑使用價值。國際婦科病理學家協會(International Society of Gynecological Pathologists,ISGyP)推薦對所有子宮內膜癌患者進行MMR/MSI狀態檢測,不論年齡[14]。曼徹斯特國際共識組同樣推薦子宮內膜癌患者任何階段可獲取的腫瘤組織標本均可進行MMR/MSI狀態檢測[15](附錄Ⅰ、Ⅱ)。
1 推薦對所有確診的子宮內膜癌患者進行林奇綜合征篩查
1.1 臨床問題:子宮內膜癌的遺傳風險篩查方法和臨床管理流程
⑴ 推薦對所有確診的子宮內膜癌患者進行MMR/MSI狀態檢測,篩查林奇綜合征,可選擇活檢、刮宮或手術切除的腫瘤標本(1類)。針對MLH1蛋白表達缺失的患者,有條件的醫療單位可考慮補充MLH1基因啟動子甲基化檢測,MLH1基因啟動子高甲基化狀態提示散發可能性大(2B類)。
⑵ 符合以下任一檢測標準時,推薦對子宮內膜癌患者進行遺傳咨詢及林奇綜合征相關MMR基因胚系突變檢測以確診林奇綜合征,檢測的基因應包括MMR基因(MLH1、PMS2、MSH2和MSH6)和EPCAM基因,建議選擇外周血標本進行檢測(1類)。檢測標準:①任何腫瘤組織檢測結果為dMMR或MSI-H的子宮內膜癌患者;②腫瘤組織篩查結果為pMMR或MSS[歐洲腫瘤內科學會(European Society of Medical Oncology,ESMO)指南推薦MSI-L 和MSS 均歸類為MSS[16]],但是臨床高度可疑林奇綜合征的患者;③有血緣關系的家族成員確診為林奇綜合征者;④在腫瘤組織中檢測到MMR基因致病性突變但不能明確是否為胚系突變的患者(腫瘤組織MMR基因突變檢測并非林奇綜合征的常規篩查手段)。
⑶ 推薦對確診為林奇綜合征的子宮內膜癌患者進行遺傳咨詢和遺傳管理,同時推薦對其直系親屬針對該致病位點進行逐級檢測(cascade testing)(1類)。
1.2 文獻綜述和分析
1.2.1 背景
子宮內膜癌相關的遺傳綜合征有林奇綜合征、Cowden綜合征(由PTEN基因胚系突變引起)和PPAP(由POLE和POLD1基因胚系突變引起),人群發生率分別為3.0%~5.0%、0.1%和0.1%~0.4%[17-21]。普通人群患子宮內膜癌的風險為3.1%,林奇綜合征患者患子宮內膜癌和結直腸癌的風險增加到40%~60%[22-23],因此NCCN指南將林奇綜合征納入子宮內膜癌常規遺傳風險篩查范圍,Cowden綜合征和PPAP則未被納入。林奇綜合征主要是由MMR基因(MLH1、PMS2、MSH2和MSH6)或EPCAM基因胚系突變引起的,EPCAM基因的3'末端外顯子缺失導致MSH2基因啟動子高甲基化使MSH2功能失活,從而形成林奇綜合征表型[24-26]。
1.2.2 林奇綜合征確診方法和高危人群特征
NCCN 指南推薦通過MMR/MSI 狀態檢測對子宮內膜癌患者進行林奇綜合征篩查,對dMMR或MSI-H患者進行林奇綜合征相關MMR基因(MLH1、PMS2、MSH2和MSH6)和EPCAM基因胚系突變檢測確診[27]。檢測標本可為活檢、刮宮或手術切除的腫瘤標本,術前標本(活檢或刮宮)和手術切除腫瘤標本的MMR/MSI狀態檢測結果高度一致[28],且二者間的p53蛋白水平檢測結果也高度一致[29]。有研究[30-31]顯示,MMR蛋白水平(免疫組織化學法)和MSI檢測[聚合酶鏈反應(polymerase chain reaction,PCR)法]的一致性為90.4%~93.4%。林奇綜合征相關的子宮內膜癌高危人群具有如下特征[13,27]:①PMS2(MLH1正常)、MSH2或MSH6蛋白中任一蛋白表達缺失者;②MLH1蛋白表達缺失,且MLH1基因啟動子未見高甲基化者;③MSI-H;④臨床高度懷疑林奇綜合征時,無論MMR狀態如何,可疑特征包括本人有同時或異時發生林奇綜合征相關腫瘤史,或有子宮內膜癌、結直腸癌或其他林奇綜合征相關腫瘤家族史的患者;⑤有血緣關系的家族成員確診為林奇綜合征者。林奇綜合征相關腫瘤史包括結直腸癌、子宮內膜癌、胃癌、卵巢癌、胰腺癌、尿路上皮癌、腦腫瘤(通常是惡性膠質瘤)、膽管癌、小腸腫瘤、皮脂腺瘤、皮脂腺癌和角化棘皮瘤[27]。
1.2.3 MMR狀態檢測
了解MMR狀態可通過采用免疫組織化學法檢測MLH1、MSH2、MSH6和PMS2蛋白表達,結果分為dMMR和pMMR。ISGyP指南推薦優先進行MMR狀態檢測[14],評估上述4種蛋白的表達;更為經濟的簡化方法為先檢測PMS2和MSH6[32-34],如果PMS2和(或)MSH6蛋白表達異常,仍建議補充MLH1和MSH2蛋白檢測。當MLH1蛋白缺失時,進一步補充MLH1基因啟動子甲基化檢測(圖1)。發生MLH1蛋白缺失時,MLH1基因啟動子甲基化或BRAFV600E檢測(僅適用于結直腸癌)常用于判斷散發性腫瘤。散發性事件多由MMR雙等位基因體細胞突變(兩個致病性變異或一個致病性變異和雜合性缺失)或MLH1基因啟動子高甲基化引起[35-36],中國子宮內膜癌患者散發性事件具有dMMR者占比可達80%[2]。BRAFV600E突變常見于MLH1基因啟動子甲基化引起的散發性結直腸癌患者[37];子宮內膜癌患者BRAF基因突變頻率極低,且與MLH1基因啟動子甲基化不相關,因此篩查林奇綜合征時無需檢測BRAFV600E突變[32,38-39]。免疫組織化學方法檢測的局限性:組織處理、抗體質量、染色技術與流程、染色結果分析等均可能導致結果出現誤讀或難以判讀。
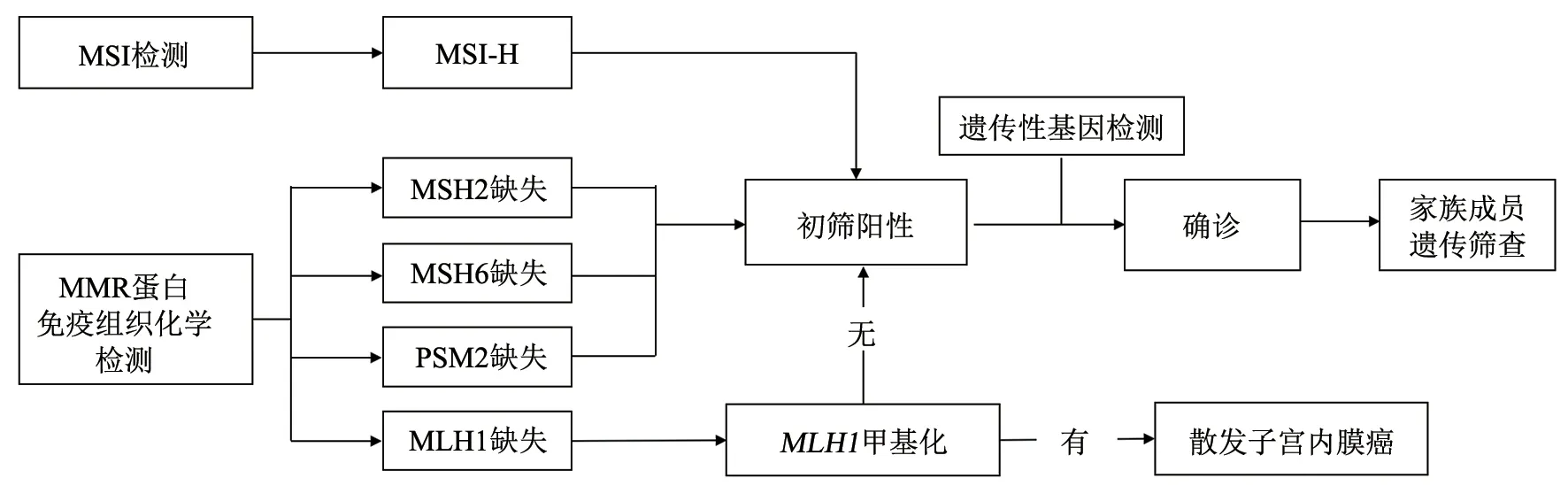
圖1 MMR/MSI狀態檢測指導子宮內膜癌林奇綜合征篩查
1.2.4 MSI狀態檢測
MSI狀態可通過PCR法(MSI-PCR)或高通量測序方法(MSI-NGS)進行判斷,結果分為MSI-H、MSI-L和MSS。MSI-PCR檢測需同時采集腫瘤標本和配對正常外周血標本。在子宮內膜癌和結直腸癌中,MSI-PCR、MSI-NGS和MMR蛋白檢測結果一致性高[28-31,40]。但MSI-NGS檢測在國內尚缺乏統一標準,對檢測平臺的儀器、技術和生信分析能力有著更高的要求[40]。MSI檢測細節可參考MSI檢測ESMO指南[16]。MSI檢測的問題包括:①14%的患者因為DNA抽提產量低或DNA質量不佳導致檢測失敗;②當檢測標本中腫瘤細胞純度低于30%時,易導致假陰性[41]。另外,約30%的MSH6基因胚系突變的子宮內膜癌患者可能表現為MSS,單獨進行MSI檢測時會被漏檢。因此,建議對初診的子宮內膜癌患者進行MMR/MSI狀態檢測篩查林奇綜合征,必要時建議結合臨床病理學特征和家族史綜合判斷。
1.2.5 單腫瘤組織基因測序
有研究團隊采用腫瘤單組織測序對465例Ⅳ期結直腸癌患者進行林奇綜合征篩查,靈敏度可達100.0%,特異度為95.3%[42],而常規MMR/MSI檢測聯合BRAFV600E篩查會漏檢10%的林奇綜合征患者,該團隊提出腫瘤單組織測序可作為晚期患者篩查的首選方案,在進行遺傳風險評估的同時,還可獲取結直腸癌重要靶點突變信息,提供更多的治療選擇。在初診的子宮內膜癌患者中篩查林奇綜合征時,可考慮采用高通量測序方法替代常規MMR/MSI檢測,直接對腫瘤組織(不含配對正常樣本)進行高深度靶向多基因檢測,檢測基因范圍:可包含MLH1、MSH2、MSH6基因的所有外顯子區、內含子區和基因上下游區域,PMS2基因所有的外顯子區,EPCAM基因的所有外顯子區[42]。另外,建議補充POLE基因和TP53基因檢測(POLE基因建議覆蓋POLE基因核酸外切酶結構域9~14號外顯子,TP53基因建議覆蓋該基因全部外顯子及鄰近剪切位點),篩查時還可同時進行分子分型評估。腫瘤組織標本中檢測到任一MMR基因致病突變(致病性判定規則參考相關研究[42]),在不能排除胚系突變可能性時,需要進一步針對該位點進行胚系突變檢測驗證。
1.3 臨床解讀
推薦對所有確診的子宮內膜癌患者進行MMR/MSI狀態檢測篩查林奇綜合征。若初診子宮內膜癌患者同時進行分子分型檢測和林奇綜合征篩查,MMR/MSI的檢測建議參考MMRd亞型的檢測方法進行。腫瘤組織檢測結果為dMMR或MSI-H的患者,推薦進行林奇綜合征相關MMR基因胚系突變檢測。鑒于存在MMR蛋白和MSI檢測結果不一致及誤判的現象,尤其是MSH6基因胚系突變的子宮內膜癌患者MSI的檢測靈敏度僅約70.0%[25,43-44],針對判讀結果有爭議的部分子宮內膜癌患者建議對MMR狀態、MSI狀態、臨床病理學特征和家族史進行綜合分析,以決定是否需要進行林奇綜合征相關MMR基因胚系突變檢測。建議對明確為林奇綜合征的患者進行遺傳咨詢和遺傳管理,需強調進行其他相關惡性腫瘤的篩查及隨訪,同時推薦對與其有血緣關系的親屬盡早進行遺傳咨詢及基因檢測,以便制定相應的遺傳管理措施。
2 推薦對所有確診的子宮內膜癌患者進行分子分型
2.1 臨床問題:子宮內膜癌分子分型檢測策略及其對患者預后評估和治療選擇的臨床價值
⑴ 推薦對所有確診的子宮內膜癌患者進行分子分型,檢測樣本可選擇活檢、刮宮或手術切除的腫瘤標本(2A類)。
⑵ 在資源有限地區,不能對所有子宮內膜癌患者進行普遍檢測時,對于術后傳統臨床病理學評估提示不需要進行輔助治療的患者,可考慮省略POLE基因突變檢測,但仍建議進行MMR/MSI狀態和p53狀態檢測(3類)。
⑶ 推薦結合POLE基因核酸外切酶結構域突變狀態、MMR/MSI狀態和p53狀態進行分子分型。根據WHO女性生殖器官腫瘤分類(第5版)分為4種類型:POLEmut、MMRd、p53 abn和NSMP。
分子分型檢測方案:①基本推薦,聯合POLE基因熱點突變檢測(Sanger測序),MMR蛋白檢測(免疫組織化學法)/MSI檢測(PCR法)和p53蛋白檢測(免疫組織化學法)進行分子分型(2A類)。②可選推薦,采用高通量測序方法檢測POLE基因突變、MSI狀態和TP53基因突變,進行分子分型(2B類)。③其他組合選擇,除上述方案之外,能明確POLE基因突變狀態、MMR/MSI狀態、p53狀態的方法組合(3類)。POLE基因突變檢測,包括熱點突變檢測(2A類)或POLE基因核酸外切酶結構域致病性突變檢測(2B類)。
建議遵循以下判讀順序進行分子分型:①首先依據POLE基因檢測結果進行判斷,發生POLE基因致病變異時,則判定為POLEmut;②在POLE基因為野生型或發生非致病變異時,再依據MMR/MSI狀態進行判斷,若為dMMR或MSI-H,則判定為MMRd;③若MMR/MSI狀態為pMMR或MSS(MSI-L和MSS均歸類為MSS)時,進一步依據p53狀態進行判斷,若p53蛋白表達異常或TP53基因為突變狀態,則判定為p53 abn;若p53蛋白表達正常或TP53基因為野生型狀態,則判定為NSMP(2A類)。
2.2 文獻綜述和分析
2.2.1 分子分型發展背景
子宮內膜癌患者一般預后較好,但仍有15%~20%的人群具有復發風險[45]。常規組織病理學檢查仍然是區分子宮內膜癌亞型及評估復發風險的重要工具,但存在一定的觀察者誤差[46]。2013年,TCGA研究[10]提出子宮內膜癌分子分型,依據分子表型判斷預后,分為4個亞型:POLE(ultramutated)、MSI(hypermutated)、copy-number high(serouslike)和copy-number low(endometrioid)。其中POLE亞型預后最好,copy-number high亞型預后最差。2015年,Talhouk等[11]提出ProMisE分型方法,更貼合臨床實踐,簡單易操作,采用3個免疫組織化學標志物(p53、MSH6和PMS2)和1個分子檢測(POLE基因核酸外切酶結構域突變),分為4個亞型(表1)[47],這種分型的有效性已被證實,在獨立和前瞻性的臨床研究中,對高級別和高危人群的預后判斷非常一致[11,48]。2016年,Stelloo等[12]在ProMisE分型基礎上,結合L1CAM高表達(>10%)[49-50]、CTNNB1外顯子3突變[51]和淋巴血管間隙浸潤(lymphovascular space invasion,LVSI)[52]進一步提出Trans-PORTEC分型,對于NSMP的低級別子宮內膜癌可進行更精準的風險分層。分子分型可能適用于所有子宮內膜癌亞型[13,41,53],但是目前與預后相關的研究中納入的病例主要為子宮內膜樣癌和漿液性癌,在少見組織學亞型(如去/未分化子宮內膜癌等)中的臨床應用價值有待于進一步闡明。POLEmut子宮內膜樣癌和漿液性癌有相似的組織形態學特征,且不少子宮內膜樣和漿液性混合性癌表現為POLEmut或MMRd特征,也有一些為p53 abn,因此即使對于較為明確的漿液性癌,仍然建議進行分子分型檢測,避免過度治療[53]。目前仍在探索進一步精準分層的標志物,例如對于MMRd子宮內膜樣癌,MLH1基因啟動子甲基化狀態有可能作為進一步分層的標志物,發生MLH1基因啟動子甲基化的腫瘤預后要差于發生MMR基因突變的腫瘤[54]。另有小型研究[55]表明,1q32.1拷貝數擴增可能是NSMP組的不良預后因素。
2.2.2 分子分型命名
分子分型檢測樣本,可選擇活檢、刮宮或手術切除腫瘤標本。推薦結合POLE基因核酸外切酶結構域突變狀態、MMR/MSI狀態和p53狀態進行綜合判定,分為4種亞型[與WHO女性生殖器官腫瘤分類(第5版)命名保持一致]:POLEmut(POLEmutation)、MMRd(MMR deficiency)、p53 abn(p53 abnormality)和NSMP(non-specific molecular profile)。
2.2.3 分子分型檢測內容及方法
⑴POLEmut檢測,包括熱點突變檢測(2A類)或POLE基因核酸外切酶結構域致病突變檢測(2B類)[45]。POLE基因編碼DNA聚合酶ε催化亞基,用于修復DNA復制錯誤,該基因核酸外切酶結構域包含外顯子9~14,該區域發生致病突變將導致子宮內膜癌表現“超突變”表型(≥100個突變/Mb)[56]。80%以上的POLE基因致病變異發生在9號和13號外顯子,常見的5個熱點突變包括P286R、V411L、S297F、A456P和S459F,覆蓋95.3%的已知POLE基因致病變異位點。在條件允許的情況下,可考慮POLE基因核酸外切酶結構域致病突變檢測,推薦檢測范圍覆蓋POLE基因9~14號外顯子區域,可采用高通量測序方法進行,該區域變異的致病性依據COSMIC 10 signature、突變類型、腫瘤突變負荷(tumor mutation burden,TMB)、復現突變等因素進行綜合判定,具體判讀規則可參考相關研究[47]。POLE基因核酸外切酶結構域發生致病變異和非致病變異的患者,5年無復發生存率分別為92.3%和76.2%,POLE基因核酸外切酶結構域非致病變異與POLE基因野生型患者5年無復發生存率相似[47]。
⑵ MMR/MSI狀態檢測:推薦MMR蛋白(免疫組織化學法)或MSI(PCR法或高通量測序方法)檢測。免疫組織化學法檢測4個MMR蛋白(MLH1、PMS2、MSH2和MSH6)的表達情況。腫瘤細胞核4個MMR蛋白表達完整/正常為pMMR,腫瘤細胞核一個或多個MMR蛋白表達缺失/異常為dMMR。MMR蛋白免疫組織化學檢測結果的判讀需要緊密結合內對照細胞(與腫瘤細胞緊密相鄰的間質細胞和炎癥細胞)的染色狀態。dMMR或MSI-H可判斷為MMRd。理論上MMR蛋白免疫組織化學檢測與DNA MSI檢測(PCR或高通量測序)檢測結果應具有高度一致性。但每種方法都有其優點與局限性,實際工作中有時候需要互相補充。值得注意的是,在少數子宮內膜癌病例中腫瘤組織的MMR/MSI狀態具有異質性,可能會導致MMR蛋白免疫組織化學檢測與DNA MSI檢測結果不一致,MMR蛋白免疫組織化學檢測可以更直觀地觀察到這種異質性。
⑶ p53狀態:推薦p53蛋白表達(免疫組織化學法)或TP53基因突變(高通量測序方法)檢測進行判斷。TCGA研究[10]中,TP53基因突變在copy-number high和copy-number low兩個分子表型中互斥。Copy-number high(serouslike)組常見TP53基因突變(突變類型包括無義突變、錯義突變、插入缺失、移碼突變和剪切變異,即影響p53蛋白氨基酸序列的突變),發生比例約92.0%。因此,TP53基因突變可用于替代copy-number high分型,而p53蛋白免疫組織化學檢測和TP53基因突變一致性可達92.1%[57],臨床實踐中采用p53蛋白免疫組織化學檢測更易實現,但需注意由此可能導致約15%的copy-number high人群被分類到NSMP組[10,58]。p53蛋白免疫組織化學表達呈現完全陰性、細胞核彌漫強陽性表達或細胞質表達時,為p53蛋白表達異常,提示TP53基因為突變狀態。p53蛋白表達呈現細胞核散在陽性時,為p53蛋白表達正常,提示TP53基因為野生型狀態。高通量方法檢測TP53基因突變建議覆蓋TP53基因所有外顯子區及鄰近剪切位點,發生任何無義突變、錯義突變、插入缺失、移碼突變和剪切變異等變異,提示TP53基因為突變狀態[10]。TP53基因發生同義突變或無任何突變,可判斷TP53基因為野生型狀態。需要留意的是,TP53基因大片段缺失也可能造成p53蛋白功能異常,若基因檢測結果與p53蛋白免疫組織化學(判讀與染色沒有問題的前提下)及形態學結果不符合,必要時可以進行TP53基因大片段缺失的檢測。
2.2.4 分子分型檢測方案
⑴ 基本推薦(經濟性):聯合POLE基因熱點突變檢測(Sanger測序)、MMR蛋白檢測(免疫組織化學法)/MSI檢測(PCR法)和p53蛋白檢測(免疫組織化學法)進行分子分型(2A類)。
⑵ 可選推薦(國內檢測現狀):采用高通量測序方法檢測POLE基因突變、MSI狀態和TP53基因突變進行分子分型(2B類)。POLE基因突變檢測包括熱點突變檢測(2A類)或POLE基因核酸外切酶結構域致病突變檢測(2B類)。
⑶ 其他組合選擇(各醫療單位可及性):除上述方案之外,推薦能明確POLE基因突變狀態、MMR/MSI狀態、p53狀態的方法組合(3類)。
2.2.5 分子分型的判讀順序
3%~5%的患者存在多重分子亞型(multiple classifier)[48,59-60],針對多重分子亞型病例的預后研究提示,同時發生POLEmut和p53 abn的病例,建議歸類為POLEmut[45,59];同時發生POLEmut和MMRd的病例,建議歸類為POLEmut[47];同時發生MMRd和p53 abn的病例,建議歸類為MMRd[45-46,60]。因此分子分型建議遵循以下判讀順序(圖2):①首先依據POLE基因檢測結果進行判斷,發生POLE基因致病變異時,則判定為POLEmut;②在POLE基因為野生型或發生非致病變異時,再依據MMR/MSI狀態進行判斷,若為dMMR或MSI-H,則判定為MMRd;③若MMR/MSI狀態為pMMR或MSS(MSI-L和MSS均歸類為MSS)時,進一步依據p53狀態進行判斷,若p53蛋白表達異常或TP53基因為突變狀態,則判定為p53 abn,若p53蛋白表達正常或TP53基因為野生型狀態,則判定為NSMP(2A類)。
2.3 臨床解讀
2.3.1 分子分型預后風險評估價值
ProMisE分型方法在低、中、高危的子宮內膜癌患者中被證實具有預后指導價值。POLEmut預后最好,MMRd/NSMP預后居中,p53 abn預后最差,這與傳統臨床病理學評估結果可能存在不一致的現象[48]。Trans-PORTEC回顧性研究PORTEC-1和2中-高危子宮內膜癌,探究雌激素受體(estrogen receptor,ER)/孕激素受體(progesterone receptor,PR)表達、CTNNB1基因突變、L1CAM表達、LVSI及分子分型與復發風險的關系,依據分子分型結果對臨床病理學評估的中-高危患者進一步細分,其中15%的患者被調整為高危、50%的患者被調整為低危,通過分子分型提升了早期子宮內膜癌復發風險評估的準確性[12]。
2.3.1.1 2021 ESGO/歐洲放射腫瘤學會(European Society for Therapeutic Radiation Oncology,ESTRO)/歐洲病理學家協會(European Society of Pathologists,ESP)指南提出分子分型預后分層要點
①Ⅰ~Ⅱ期的POLEmut子宮內膜癌(無殘留病灶)歸類為低危組[10];②ⅠA期的p53 abn和(或)非子宮內膜樣腫瘤(無子宮肌層浸潤)歸類為中危組;③Ⅰ~ⅣA期的p53 abn子宮內膜癌和NSMP/MMRd非子宮內膜樣腫瘤(發生子宮肌層浸潤、無殘留病灶)歸類為高危組。傳統臨床病理學評估的低危子宮內膜癌患者,不建議輔助治療[13]。已知分子分型的Ⅰ~Ⅱ期[本共識采用2009年國際婦產科聯盟(International Federation of Gynecology and Obstetrics,FIGO)分期]POLEmut子宮內膜癌患者,可考慮省略輔助治療[13]。因此,低危患者在進行分子分型時,可考慮省略POLE基因突變分析(證據不足,存在爭議),但仍推薦進行MMR/MSI狀態和p53狀態檢測[13],考慮到極少患者表現POLEmut和p53 abn雙重分子表型特征[59,61],對被判讀為p53 abn的低危子宮內膜癌患者,仍建議補充POLE基因突變檢測。
2.3.1.2 基于分子分型的預后風險定義
ISGyP指南推薦,傳統的病理學特征(如組織學類型、組織學級別、子宮肌層浸潤程度和LVSI)是評估子宮內膜癌患者預后風險的重要因素[14]。組織病理學分類依照WHO女性生殖器官腫瘤分類標準(第5版)進行[62]。推薦對子宮內膜癌進行FIGO分級,G1和G2是低級別,G3是高級別。評估子宮肌層浸潤程度時,需考慮子宮內膜和子宮肌層銜接處情況[63]。分子分型給常規形態學特征增加了另一維度的信息,建議整合到病理報告中(表2)。
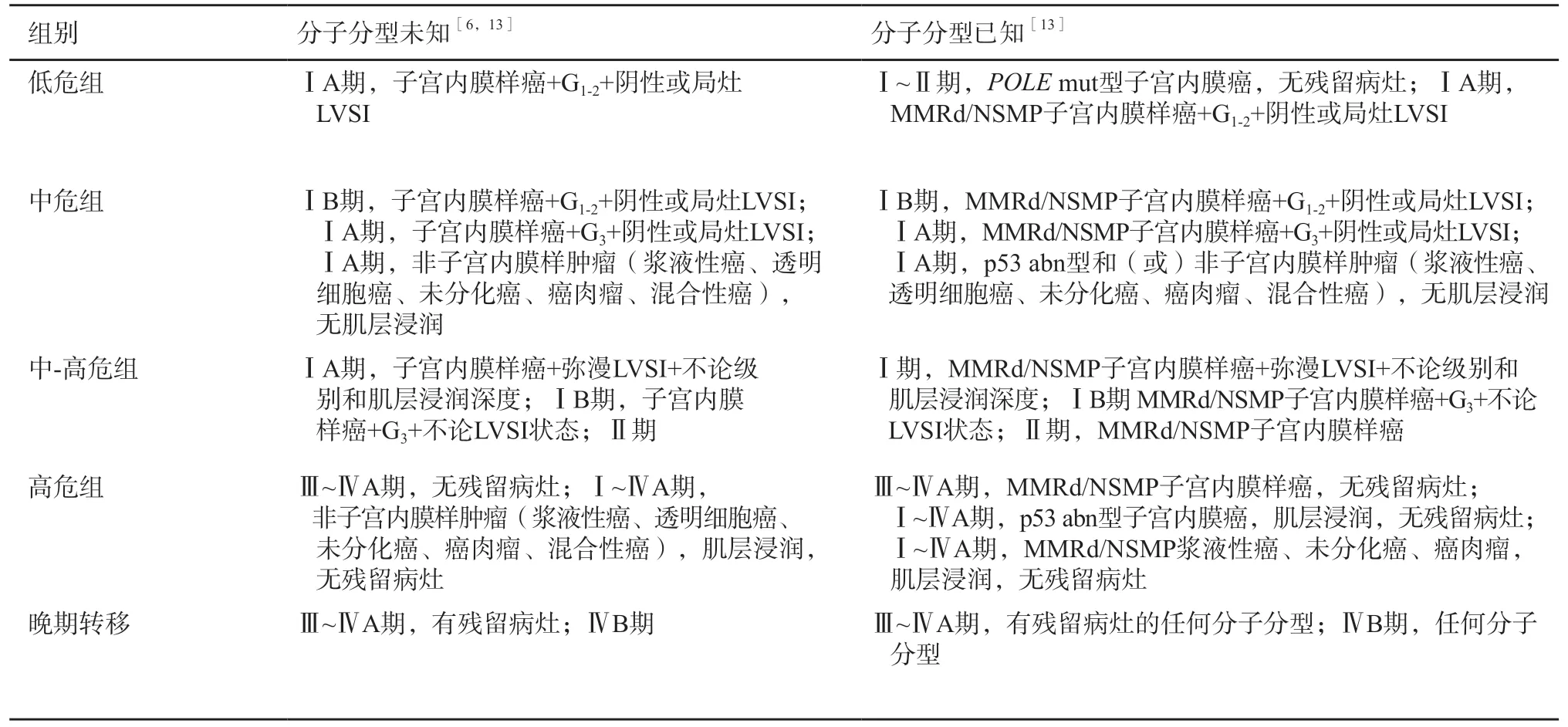
表2 子宮內膜癌預后風險評估定義
一項真實世界研究[61]顯示,部分高級別或Ⅱ~Ⅲ期子宮內膜癌的分子分型結果是預后相對較好的POLEmut或MMRd亞型,基于分子分型評估的復發風險低于基于ESMO指南病理學評估的復發風險。PORTEC-3研究[64]提示,對于高級別或高危子宮內膜癌,分子分型會影響輔助治療方案。當分子分型工具不可及時,建議采用傳統的臨床病理學特征進行分型(表2)。
2.3.2 分子分型和臨床輔助治療決策
分子分型對于輔助治療具有指導作用,在高級別和(或)高危子宮內膜癌患者中對5年無復發生存率和5年總生存率的影響更為顯著[45]。PORTEC-3研究[45]評估輔助放化療對高危子宮內膜癌(ⅠA期G3子宮內膜樣癌伴深肌層浸潤或LVSI、ⅠB期G3子宮內膜樣癌、Ⅱ~Ⅲ期子宮內膜樣癌或Ⅰ~Ⅲ期漿液性癌或透明細胞癌)5年總生存率的影響,結果顯示,與輔助放療相比,輔助放化療并未提高總人群的5年總生存率(81.8%vs76.7%,P=0.11);p53 abn亞組患者,輔助放化療可顯著提高5年無復發生存率(58.6%vs36.2%,P=0.021)和5年總生存率(64.9%vs41.8%,P=0.049)(表3),POLEmut/MMRd/NSMP亞型患者,輔助放化療和輔助放療的5年無復發生存率和總生存率差異無統計學意義(P>0.05),提示分子分型是對高危患者復發風險評估的重要補充。
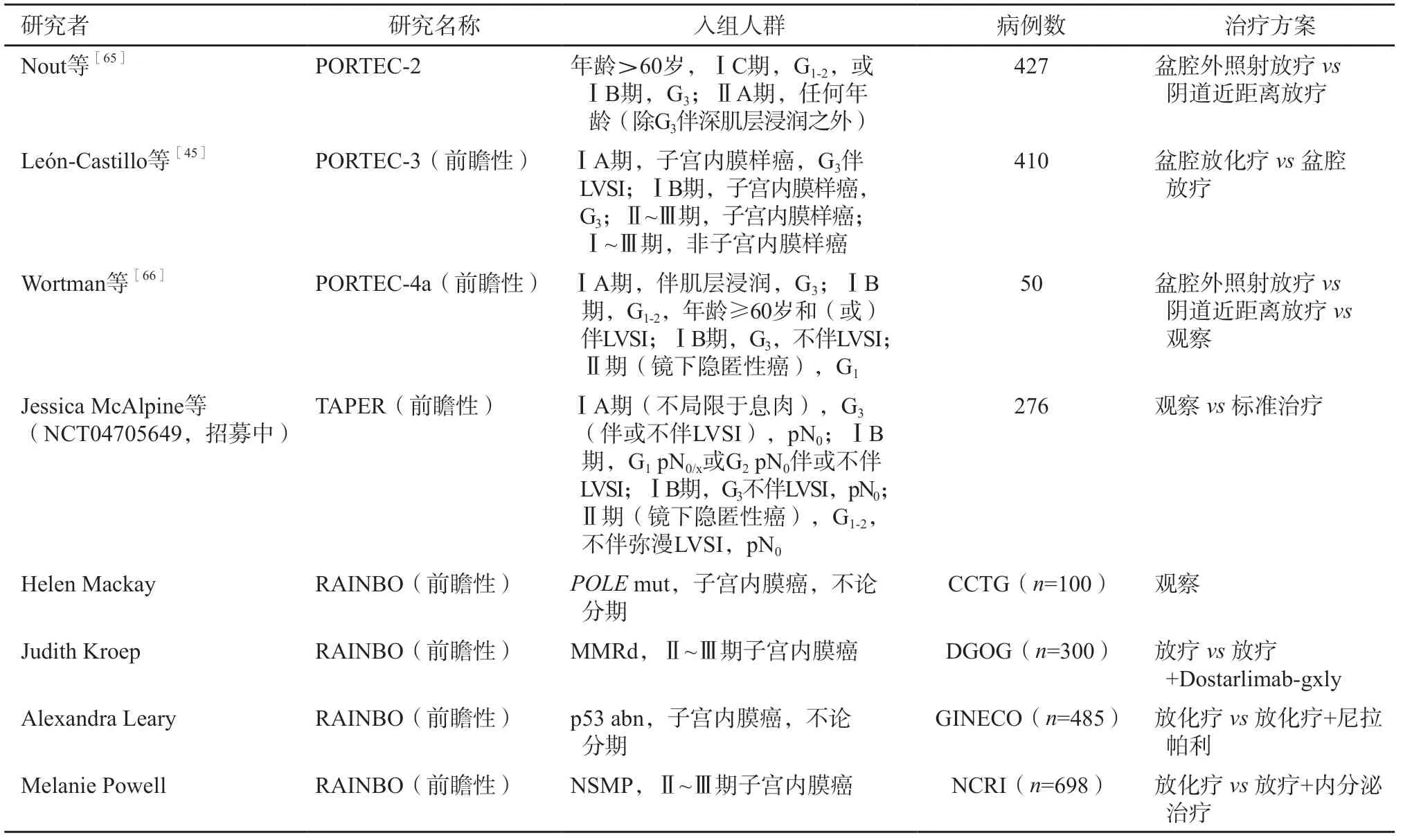
表3 基于分子分型的臨床研究
正在進行的基于分子分型的前瞻性臨床研究包括PORTEC-4a和TAPER(表3),還有即將開展的RAINBO傘形研究(https://www.nvog.nl/koepels-en-pijlers/pijler-oncologie/dgog/lopendestudies/rainbo/)。回顧性Trans-PORTEC研究[12]和正在進行的前瞻性PORTEC-4a、TAPER、RAINBO研究逐步明確了分子分型在子宮內膜癌患者臨床診療中的發展方向和應用價值,期待后續研究在預后風險評估、指導輔助治療和藥物治療{多腺苷二磷酸核糖聚合酶[poly(ADP-ribose) polymerase,PARP]抑制劑治療、內分泌治療、免疫治療}等方面積累高質量的數據,從而完善子宮內膜癌的疾病管理。
3 復發或轉移子宮內膜癌的生物標志物檢測
3.1 臨床問題:復發或轉移的子宮內膜癌患者分子檢測的選擇及其臨床價值
⑴ Ⅲ~Ⅳ期或復發的漿液性子宮內膜癌患者,推薦采用免疫組織化學法或熒光原位雜交(fluorescencein situhybridization,FISH)實驗檢測HER2蛋白水平或基因擴增狀態,評估抗HER2靶向治療的機會(2A類)。
⑵ 推薦采用高通量測序方法檢測TMB、NTRK基因融合,以評估免疫治療或NTRK靶向治療的機會(2A類)。同時可考慮檢測更多的靶點,如PIK3CA、KRAS、AKT1、FBXW7和PTEN等,尋求跨癌種用藥適應證及泛癌種臨床試驗入組機會(3類)。
3.2 文獻綜述和分析
3.2.1 分子遺傳特征
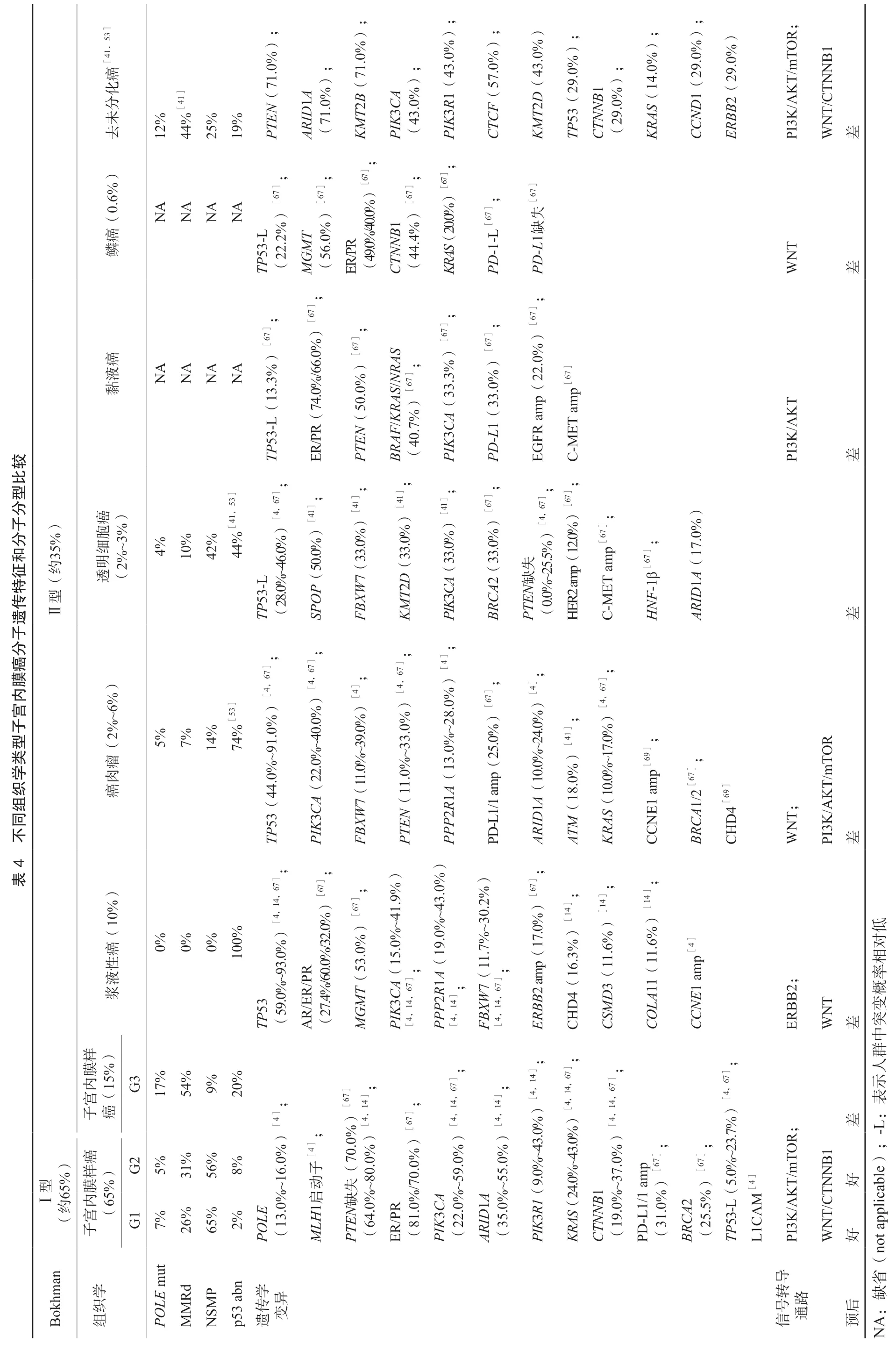
不同組織病理學亞型的子宮內膜癌患者有特定的形態學和分子遺傳特征。子宮內膜樣癌傾向于發生MSI、POLE、PTEN、KRAS、CTNNB1、PIK3CA、MLH1基因啟動子甲基化等改變[4];非子宮內膜樣腫瘤則容易出現TP53基因突變[8](表4)。分子遺傳特征決定了子宮內膜癌患者靶向治療的用藥邏輯和依據。
3.2.2 免疫治療生物標志物
免疫治療已獲批用于復發或轉移性子宮內膜癌患者的治療,目前獲批的藥物主要是針對PD-1靶點的單克隆抗體,如pembrolizumab、nivolumab和dostarlimab-gxly。獲批的伴隨診斷分子標志物有dMMR、MSI-H和TMB-H(表5)。子宮內膜癌dMMR 發生比例為17%~33%[69-70]。2017年,美國食品藥品管理局(Food and Drug Administration,FDA)批準pembrolizumab用于不可手術或轉移的dMMR/MSI-H實體瘤的后線治療[71-72]。2019年,美國FDA批準pembrolizumab聯合侖伐替尼治療既往治療進展的MSS/pMMR子宮內膜癌,客觀緩解率(objective response rate,ORR)達36%,且對漿液性癌具有顯著活性[73-74]。2020年,nivolumab作為發生dMMR的復發、轉移或高危子宮內膜癌的可選治療方案[73-74]。2021 年6 月,美國FDA 批準Dostarlimab-gxly用于既往接受鉑類藥物化療或化療進展的發生dMMR 子宮內膜癌患者,ORR為42%[75]。基于KEYNOTE-158研究[76],2020年,美國FDA批準TMB作為pembrolizumab的泛癌種生物標志物,該研究納入了15例TMB≥10 muts/Mb的子宮內膜癌患者,ORR達到46.7%,而TMB-L組ORR僅為6%。因此,NCCN指南推薦,對于復發、轉移或高危的子宮內膜癌患者,可考慮進行TMB檢測,用于指導pembrolizumab用藥[77]。一些其他免疫聯合治療的Ⅲ期臨床研究正在進行中,如免疫聯合化療(dostarlimab-gxly聯合卡鉑和紫杉醇對比單獨化療,RUBY研究)、免疫聯合靶向治療(pembrolizumab+lenvatinib對比化療,LEAP-1 研究)、免疫聯合PARP 抑制劑(nivolumab+rucapalib,NCT03951415;durvalumab+olaparib,NCT03572478)和免疫聯合抗血管生成藥物(atezolizumab+bevacizumab,NCT03526432),期待后續發布的結果能帶來高質量的研究證據。
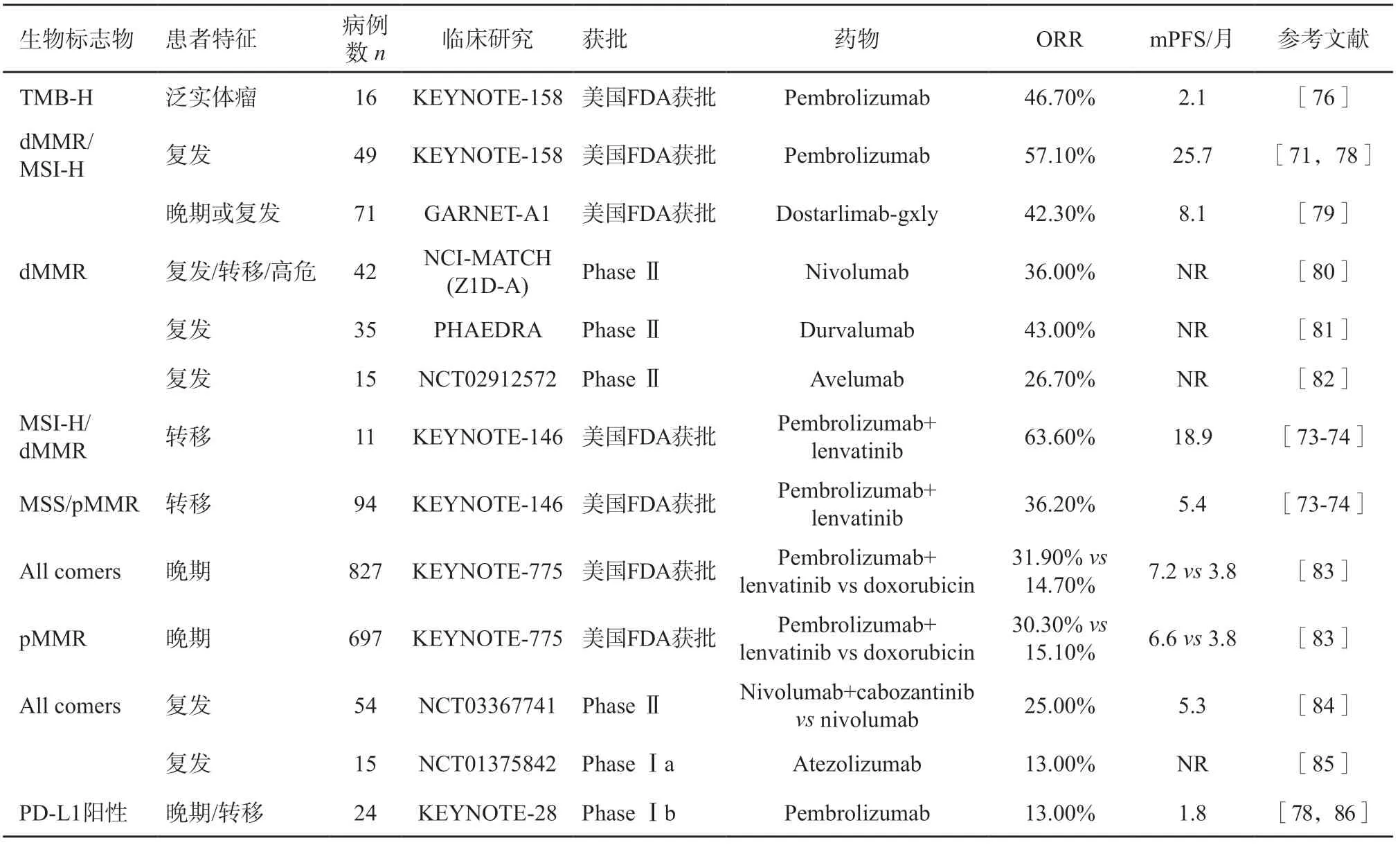
表5 復發或轉移性子宮內膜癌患者的免疫治療研究
3.2.3 靶向治療生物標志物
67%~91%的子宮內膜癌患者中存在至少一個可能提示美國FDA批準藥物或臨床試驗階段藥物靶點的基因變異[87-88]。美國FDA已批準的子宮內膜癌用藥靶點有NTRK和HER2(表9)。NTRK融合基因在實體瘤中的整體檢出率僅為0.5%~1.0%[89],目前美國FDA批準拉羅替尼和恩曲替尼用于復發或轉移的子宮內膜癌患者[90],該藥物在實體瘤中的ORR可達57%~79%[91-92]。約30%的子宮漿液性癌存在HER2過表達。一項Ⅱ期隨機臨床研究[93]發現,在HER2過表達的子宮漿液性癌患者中,一線治療時在卡鉑聯合紫杉醇的基礎上聯用曲妥珠單抗可顯著延長4.6個月的中位無進展生存期。此外,在復發子宮內膜癌患者中同樣有臨床獲益[94-95]。有研究[96]報道,HER2過表達或ERBB2基因突變的晚期實體瘤患者可考慮使用曲妥珠單抗偶聯藥物trastugumab deruxtecan治療,入組2例子宮內膜癌患者均達到部分緩解。
3.2.4 其他生物標志物
目前還有一些泛癌種臨床研究探究PI3K/AKT/mTOR、KRAS、AKT1、FGFR2、FBXW7和PTEN基因等靶向治療效果(表6);PIK3CA在子宮內膜癌中發生比例為22%~59%,目前針對該靶點泛癌種研究的藥物有alpelisib(ORR為6.0%,唯一1例完全緩解的為子宮內膜癌,另有1例部分緩解)[97]、samotosilib(晚期子宮內膜癌患者ORR為16.0%)[98]、sapanisertib(針對后線泛實體瘤,ORR為13.6%,該研究入組2例子宮內膜癌患者,其中1例達到部分緩解)[99]。AKT1 E17K(NCI-MATCH EAY131-Y):入組6例AKT1 E17K突變的子宮內膜癌患者,采用AKT抑制劑capivasertib治療,1例達到完全緩解,治療持續時間35.6個月[100]。FGFR(NCIMATCH EAY131-W):針對FGFR突變和融合的AZD4547(一種FGFR抑制劑),總人群的ORR約8.0%;入組4例FGFR2/3點突變的子宮內膜癌患者,2例疾病穩定,1例疾病進展[101]。KRASG12C:針對KRASG12C突變的泛癌種研究,入組2例KRASG12C突變的子宮內膜癌患者,1例達到部分緩解,治療持續時間6.9個月[102]。FBXW7:針對FBXW7突變的復發漿液性癌,采用WEE1抑制劑adavosertib治療,ORR達29.4%,中位無進展生存期達6.1個月。IMMU-132-01研究針對TROP靶點,sacituzumab govitecan治療難治性子宮內膜癌的ORR達22.0%,總生存期為11.9個月[103]。
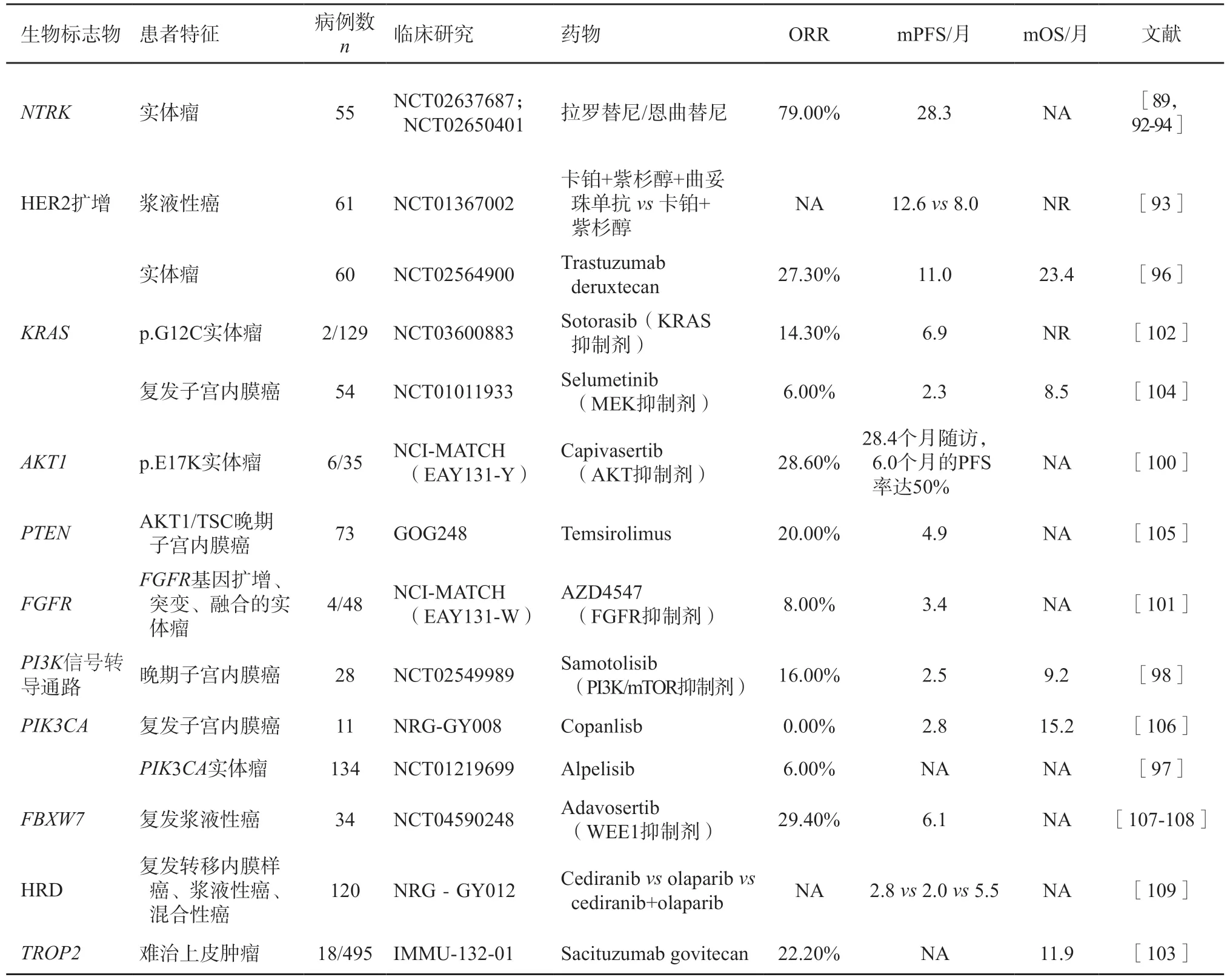
表6 復發或轉移子宮內膜癌的生物標志物
3.2.5 ER/PR陽性
內分泌治療常用于有生育需求的復發子宮內膜癌患者,其ORR達55%[110]。低級別子宮內膜樣、ER/PR陽性的子宮內膜癌患者獲益最大[6]。但ER表達狀態并不是內分泌治療的決定性標志物,一些研究[111-112]表明,ER陰性患者同樣可受益。內分泌治療藥物包括醋酸甲羥孕酮、合成孕激素、促黃體素釋放激素(luteinizing hormone releasing hormone,LHRH)拮抗劑,他莫昔芬和新一代選擇性ER調節劑,每種藥物都有不同的分子機理,藥物活性不同[112],優先考慮孕激素[113],替代性選擇是芳香化酶抑制劑、他莫昔芬和氟維司群。PARAGON研究[114]納入82例復發、ER/PR陽性的子宮內膜癌患者,使用anastrazole治療的ORR為7%,6個月臨床獲益率達44%。一項單臂Ⅱ期研究[115]納入35例復發的子宮內膜癌患者,來曲唑聯合依維莫司臨床獲益率可達40%。另一項研究[116]納入62例復發、PR陽性子宮內膜癌患者,來曲唑、依維莫司聯合二甲雙胍具有更高的臨床獲益率(PR陽性vsPR陰性:89.5%vs27.3%)。內分泌治療過程中應考慮血栓風險。轉移性腫瘤進展過程中ER和PR的表達會發生變化[6],原發灶ER和PR狀態不能反映復發病灶或轉移灶的實時狀態,因此對于復發或轉移的子宮內膜癌患者推薦進行活檢,進一步確認ER和PR表達情況[117]。
3.3 臨床解讀
Ⅲ~Ⅳ期或復發漿液性癌可考慮進行HER2過表達檢測,免疫組織化學法結果有爭議時,推薦采用FISH檢測進行確認;在采用高通量測序技術進行其他靶點檢測的同時,也可以考慮進行ERBB2基因擴增檢測。陽性患者可考慮曲妥珠單抗靶向治療。
TMB、MSI和NTRK已被美國FDA批準作為復發或轉移性子宮內膜癌患者免疫和靶向用藥的伴隨診斷生物標志物。復發或轉移性子宮內膜癌患者可考慮TMB、MSI、NTRK融合基因檢測,檢測樣本為腫瘤組織和配對正常標本(外周血),推薦采用高通量方法進行檢測,可同時檢測PIK3CA、KRAS、FGFR2重排或融合、AKT1、FBXW7、PTEN等基因突變和ERBB2基因擴增等靶點,尋求跨癌種用藥適應證及泛癌種臨床試驗入組機會的同時,還可進行分子分型。
4 結語
本共識依據新近的研究證據,在子宮內膜癌林奇綜合征篩查、分子分型檢測、靶向治療和免疫治療標志物檢測等方面進行了推薦,并形成共識發布,以指導與規范中國子宮內膜癌分子檢測的臨床應用。需要強調的是,由于分子分型在診斷、預后風險評估和治療等方面還缺乏大樣本高質量的循證醫學證據,部分內容可能仍然存在爭議。此外,近年來子宮內膜癌精準診療領域進展迅速,隨著高質量研究證據的不斷積累,檢測共識也需要不斷更新和完善。

附錄1 本共識采用的推薦級別
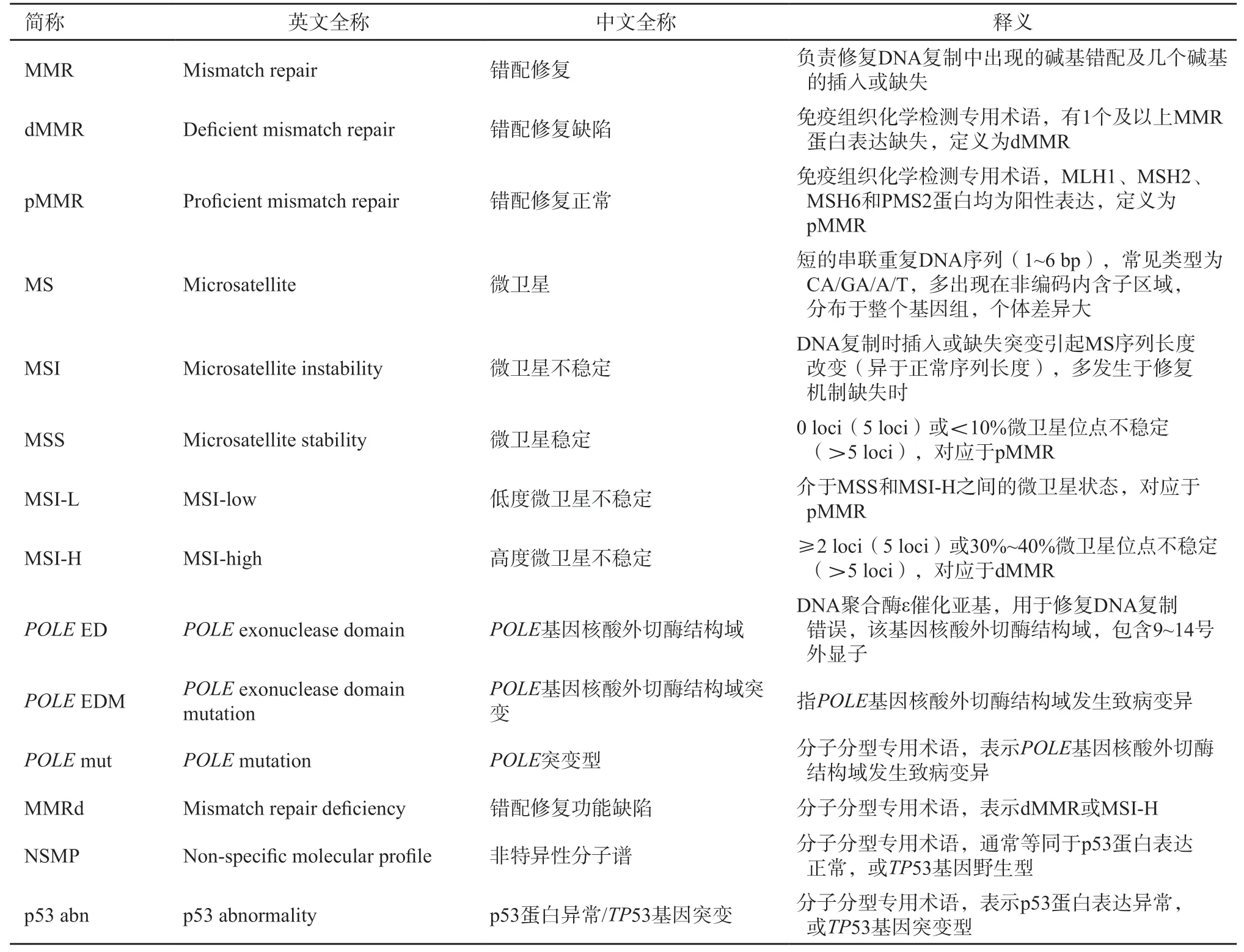
附錄2 名詞解釋

