α-硫辛酸對PM2.5致大鼠睪丸支持細胞內質網應激的影響
楊 陽,徐 鵬,張毓珍,崔留欣,黃 輝
1)鄭州大學第一附屬醫院醫院感染管理科 鄭州 450052 2)鄭州大學第一附屬醫院感染性疾病科 鄭州 450052 3)鄭州大學公共衛生學院環境衛生學教研室 鄭州 450001
大氣顆粒物是影響大氣環境質量和人體健康的主要危害因素之一,其中直徑小于2.5 μm的細顆粒物(PM2.5)是霧霾的主要成分,現已成為公眾和學界關注的重點[1-2]。有學者[3-5]研究發現,PM2.5可對呼吸系統、心血管系統、神經系統、生殖系統等造成損害。內質網應激是在多種生理或病理條件下,由于錯誤折疊蛋白或未折疊蛋白聚集導致的穩態失衡、生理紊亂[6]。近年有研究[7]報道,內質網應激可能是生殖細胞凋亡的重要途徑之一。
α-硫辛酸(ALA)是一種獨特的氧化應激強效抑制劑,近年來一直是抗氧化研究領域的熱點,在糖尿病、急慢性肝炎、男性不育癥、皮膚病等疾病的治療中具有廣大的應用前景[8-9]。氧化應激被認為是PM2.5引起機體損傷的重要機制之一[10]。本課題組前期研究[11]證實,氧化應激介導的內質網應激可能在氟中毒生殖損傷中發揮重要作用;而在PM2.5致睪丸支持細胞損傷中,ALA能否通過抑制氧化應激拮抗內質網應激,目前尚不明確。本研究以原代培養大鼠睪丸支持細胞為載體,建立PM2.5致睪丸支持細胞損傷模型,并采用ALA加以干預,探討ALA對PM2.5引起的睪丸支持細胞內質網應激的影響,為PM2.5致雄性生殖系統損傷的防治提供新思路。
1 材料與方法
1.1 PM2.5樣品的采集及處理本研究所選取的采樣地點為鄭州市某高校園區內,采樣點周圍主要為居民生活區,無明顯工業污染且附近無高層建筑遮擋,該采樣點具有該區域代表性。使用大流量粉塵采樣器(TE6070,美國)采集PM2.5樣品。采集完畢后,從采樣器上取下石英纖維濾膜,置于干燥器中干燥平衡48 h后,使用分析天平對濾膜進行稱重,將稱重后的濾膜剪碎,轉移至含有超純水的燒杯中,超聲振蕩后,用8層紗布過濾振蕩液,將濾液用冷凍干燥機凍干后收集于EP管中,于-80 ℃保存備用。
1.2 大鼠原代睪丸支持細胞的分離和純化SPF級16~20 d齡雄性SD大鼠20只,由河南省實驗動物中心提供,動物許可證編號:SCXK(豫)2010-0002。采用頸椎脫臼法處死大鼠,放入體積分數75%乙醇中浸泡5 min后轉移入超凈臺,然后按照本課題組前期實驗方法[12]對睪丸支持細胞進行分離、培養以及純化。提取的原代細胞加入含體積分數10%胎牛血清的DMEM/F12培養基,于37 ℃、體積分數5%CO2培養箱中進行培養,并制備細胞懸液。
1.3 實驗分組及處理方案根據預實驗結果確定PM2.5染毒劑量為100 mg/L,ALA作用劑量為200 mg/L,作用時間為24 h。將離體培養2 d的原代睪丸支持細胞分4組:對照組(0 mg/L PM2.5)、ALA組(200 mg/L ALA)、PM2.5組(100 mg/L PM2.5)和ALA+PM2.5組(200 mg/L ALA+100 mg/L PM2.5)。
1.4 細胞活性的MTT法測定取制備好的細胞懸液,按照5 000個/孔(每孔200 μL)接種于96孔板,48 h后分組加藥后繼續孵育24 h,每組設6個復孔。培養結束前4 h,每孔加入20 μL MTT溶液,培養結束時,小心吸棄孔內上清液,每孔再加入150 μL DMSO,振蕩5 min,以便藍紫色結晶物充分溶解。用酶標儀在492 nm波長下測定各孔吸光度。細胞存活率=(實驗組吸光度值-空白組吸光度)/(對照組吸光度值-空白組吸光度值)×100%。
1.5 細胞中氧化應激水平檢測①細胞內活性氧(ROS)檢測(檢測試劑盒購自上海碧云天生物技術有限公司):取制備好的細胞懸液,調整細胞密度為2×105個/mL,每孔2 mL接種于6孔板,培養2 d后,更換培養基,按照1.3中分組加藥后繼續培養24 h,消化收集。用無血清培養基稀釋10 mmol/L的DCFH-DA熒光探針,將細胞懸浮于稀釋的含探針的培養基中,置于37 ℃培養箱20 min,采用流式細胞儀檢測DCF熒光,每個樣本檢測2×104個細胞。②細胞內丙二醛(MDA)含量、超氧化物歧化酶(SOD)活力檢測(檢測試劑盒均購自南京建成生物工程研究所):調整細胞密度為2×104個/mL,每孔2 mL接種于6孔板,按照1.3方法分組培養。用超聲破碎法制備細胞勻漿,用于MDA含量及SOD活性的測定,上述操作均按照試劑盒說明書進行,各組檢測設6個復孔。
1.6 細胞中GRP78、IRE1和CHOP蛋白表達的Western blot法測定收集制備的睪丸支持細胞懸液,用預冷PBS沖洗兩遍,加入細胞裂解液(每100 μL中加入1 μL蛋白酶抑制劑)冰上裂解約15 min,低溫12 000 r/min離心8 min后吸取上清,BCA法測定蛋白濃度。總蛋白經SDS-PAGE分離后,轉移到PVDF膜上。分別加入GRP78、IRE1和CHOP的兔多克隆抗體(均購自武漢三鷹生物技術有限公司,均按1∶500稀釋),4 ℃孵育過夜,次日加入HRP標記的羊抗兔二抗,室溫孵育1 h,ECL化學發光法顯色,Bio-Rad凝膠成像系統收集圖像,Quanlity one軟件對結果進行光密度分析。以GAPDH為內參,目的蛋白條帶與GAPDH條帶灰度值的比值為目的蛋白的相對表達量。
1.7 統計學處理采用SPSS 12.0分析數據,應用2×2析因設計的方差分析比較各組細胞存活率、細胞內ROS、MDA含量、SOD活力及GRP78、IRE1和CHOP蛋白表達水平的差異。檢驗水準α=0.05。
2 結果
2.1 4組細胞存活率和細胞內ROS、MDA及SOD水平的比較見表1。由表1可知,PM2.5作用24 h可降低睪丸支持細胞存活率,增高細胞內ROS水平和MDA含量,降低SOD活力;而ALA可拮抗PM2.5的上述作用。

表1 4組細胞存活率,ROS、MDA含量和SOD活力的比較(n=6)
2.2 4組細胞中GRP78、IRE1、CHOP蛋白表達的比較見圖1、表2。由表2可知,PM2.5處理睪丸支持細胞24 h后,GRP78、IRE1、CHOP蛋白表達水平上調,而ALA可抑制PM2.5介導的蛋白表達上調。

圖1 各組睪丸支持細胞中GRP78、IRE1、CHOP蛋白的表達
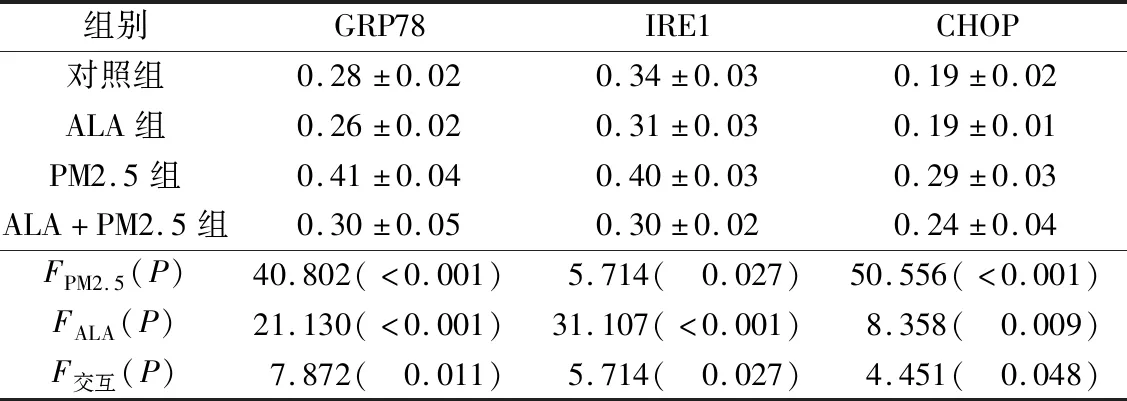
表2 4組細胞中GRP78、IRE1、CHOP蛋白表達水平的比較(n=6)
3 討論
我國大氣污染問題日益受到國內外學者的關注,由于PM2.5粒徑小且比表面積大,極易吸附重金屬等有毒物質,而生殖系統則是重金屬產生毒作用的重要靶器官之一[13]。近年來有文獻[14]報道,PM2.5可直接導致男性精子質量顯著下降,PM2.5暴露水平與精子總數呈顯著負相關。另外,關于PM2.5致機體損傷機制研究有很多,其中包括氧化應激、炎癥因子、生殖激素和MAPK信號通路等[15-16]。有學者[17]研究發現,汽車尾氣來源的PM2.5通過激活PI3K/AKT信號通路,導致生殖細胞中活性氧自由基生成增加,破壞血生精小管屏障,進而損傷雄性生殖功能。睪丸支持細胞具有為生精細胞提供營養、激素轉化、屏障隔離和吞噬等作用,外源性化合物對其影響較大,且是許多毒物的靶細胞,在雄性生殖毒理學的研究中,較多采用體外培養睪丸支持細胞的方法。因此,本研究以原代培養的大鼠睪丸支持細胞為載體,建立PM2.5染毒細胞模型,本實驗結果顯示,PM2.5染毒可引起睪丸支持細胞存活率降低,ROS水平、MDA含量升高及SOD活力降低,內質網應激相關蛋白GRP78、IRE1、CHOP表達上調。上述證據進一步驗證了PM2.5可引起睪丸支持細胞發生氧化應激和內質網應激。
ALA廣泛存在于自然界動植物及微生物中,具有獨特雙硫鍵抗氧化分子結構,可清除氫氧自由基、氫氧化物等氧化應激產物;還可與二氫硫辛酸相互轉化,還原內源性抗氧化酶,使其恢復活性;其是細胞線粒體的主要酶之一,能以輔酶形式參與能量形成,發揮其生理作用[18]。近年來ALA在臨床上的應用取得了明顯成效,且ALA對精子損傷的保護作用受到國內外相關學者[19-20]的關注。據此考慮ALA能否在PM2.5致睪丸支持細胞損傷中發揮作用。本實驗結果表明,ALA可提高睪丸支持細胞存活率,有效拮抗PM2.5組睪丸支持細胞氧化應激水平的升高。另有報道[21]顯示,內質網是ROS的主要作用靶點之一,ROS可作用于內質網,導致內質網應激持續進行性激活。本研究發現,ALA有效拮抗了內質網應激相關蛋白GRP78、IRE1和CHOP表達水平的上調,提示ALA可通過有效抑制睪丸支持細胞氧化應激降低PM2.5介導的睪丸支持細胞內質網應激。
綜上所述,本研究證實了ALA能夠通過減輕PM2.5引起的氧化損傷保護睪丸支持細胞,提高細胞存活率,且能夠拮抗PM2.5對內質網應激相關蛋白表達的上調。以上結果提示,ALA可通過抑制氧化-內質網應激信號通路,對PM2.5介導的大鼠睪丸支持細胞損傷起到一定的保護作用。而目前ALA對PM2.5致雄性生殖損傷作用的研究僅涉及體外實驗,仍需進一步體內研究明確其療效,以期為PM2.5致雄性生殖損傷的防治提供新的思路。

