草丁膦乙酰轉移酶基因序列分析
劉倩琪 王學林
(廣東省深圳市農業科技促進中心,廣東 深圳 518000)
bar基因來源于土壤吸水鏈霉菌(Streptomyces hygroscopicus),具有良好的抗草丁膦除草劑的性能,多用作轉基因植物的選擇標記。據國際農業生物技術應用服務組織(ISAAA)公布,油菜、棉花、菊苣、玉米、水稻、大豆等6種植物58個品系以bar作為篩選標記基因。
我國在轉基因植物研發、選育、鑒定過程中,常把bar基因作為轉基因成分檢測的重要靶標元件。
研發機構因研究材料差異而選擇不同的bar基因或者改造bar基因作為分子標記,國標、行標中bar基因則規定檢測175 bp和262 bp兩個片段,顯然無法滿足bar基因多樣性的要求;檢測出與目的片段大小不一致的特異性電泳條帶,按照標準判定為陰性,可能會造成漏檢;普通的凝膠電泳分辨率較低,亦無法判斷待測樣外源基因序列是否與標準提供的序列一致,從而導致目的片段差異較小或序列內部存在差異時,難以判定。
本文針對檢測工作中發現的水稻和小麥兩個待測樣中與目標序列不同的特異性bar基因片段,采用PCR產物測序法進行序列比對分析,發現水稻和小麥待測樣品的bar基因盡管上下游引物序列相同,內部基因序列差異較大,相似度低,說明測序技術能夠更精準地判定待測樣陰陽性,該研究轉基因成分檢測及其標準修訂具有重要的參考意義。
1.材料與方法
1.1 材料
水稻種子由上級主管部門的市場監督抽查任務所獲得,小麥樣品為某品牌在售干面條;標準對照樣品為檢測bar基因的MS1。
1.2 方法
1.2.1 DNA模板制備
取100 g水稻樣品種子于粉碎機粉碎后取研磨杯杯壁細粉100 mg分裝至離心管備用;小麥樣品取100g樣品折碎后于粉碎機粉碎,同樣取研磨杯杯壁細粉100 mg分裝至離心管備用;標準樣品直接取樣100 mg分裝至離心管,采用DNeasy Plant Mini Kit試劑盒,按照其操作手冊,提取樣品DNA,經超微量核酸蛋白分析儀測定DNA濃度及純度,后調整濃度至50 ng/μl,-20℃冷藏保存備用。
1.2.2 引物及序列
根據現行《轉基因植物及其產品成分檢測bar或pat基因定性PCR方法》(農業部1782-6-2012號公告)公布的bar基因引物序列(bar-F:5'-GAAGGCACGCAACGCCTACGA-3’,bar-R:5'-CCAGAAACCCACGTCATGCCA-3'),分別合成bar基因的上下游引物。bar基因標準序列如下:
1.2.3 PCR擴增及PCR產物檢測
DNA模板2μl、5μl Taq聚合酶、上下游引物各0.2μl,加水2.6μl定容至10μl反應體系。PCR反應程序:94℃10s;94℃ 5s,60℃ 34s,35 cycles;10℃ ∞。PCR 產物用2% 濃度的瓊脂糖凝膠進行電泳檢測。
1.2.4 序列分析
待測樣和對照樣bar基因的PCR擴增產物由華大基因公司進行雙向測序,重復2次,測定的上下游序列采用MEGA3.1 軟件進行分析和拼接。
2.結果與分析
2.1 瓊脂糖電泳凝膠結果分析
根據《轉基因植物及其產品成分檢測bar或pat基因定性PCR方法》(農業部1782-6-2012號公告)公布的bar基因目的片段大小為262 bp,經凝膠電泳檢測(見圖2)。與參照樣品的PCR產物片段大小相比,待測樣1的目標條帶偏小,約為240 bp;待測樣2的目標條帶偏大,約為500 bp。由于凝膠電泳檢測法分辨率較低,只能檢測出bp值區間段而不能準確識別具體bp值,為了確定準確bp值,對PCR產物進行目標序列測序。
注:M為DL-2000Marker,1為待測樣品1,2為待測樣品2,CK+為陽性參照,CK-為空白對照
2.2 目標序列測序結果
利用MEGA 3.1軟件對上下游測序結果進行分析。下游序列反轉后,與上游序列比對,剔除序列兩端不可靠堿基位點,搜尋出上下游引物位置及中間重疊區域,將序列拼接完整。測序結果顯示目標序列的個別位點存在套峰現象(見圖2),待測樣1在bar基因上游序列的第113個堿基存在G堿基中嵌套A堿基,下游序列反轉后確定該處堿基為G;待測樣2在多個位點存在套峰,不影響峰圖判定。
2.3 序列拼接結果
經MEGA3.1 軟件分析,上游序列末端比對出下游引物序列bar-R: bar-R:5'-CCAGAAACCCACGTCATGCCA-3'(見圖3),下游序列反轉后,在起始端比對出上游引物序列bar-F:5’-GAAGGCACGCAACGCC-3’,上下游序列拼接結果發現待測樣1的bar基因序列為236 bp(見圖3 ),比檢測標準中的提供的標準序列小26 bp;待測樣2的bar基因序列為486 bp(見圖4),比標準中的序列片段大224 bp。

圖3 bar基因PCR產物上下游序列(圖示部分序列)

圖4 水稻待測樣1 bar序列拼接結果(陰影示上下游引物位置)
2.4 序列比對分析
經過序列比對分析發現,待測樣1和2的bar基因序列與標準提供的序列盡管上下游引物序列相同,但內部序列與標準序列均不同(見圖5)。待測樣1的bar基因序列在第37、42~45、102、110~ 113、131~ 132、159~169、216、228~231等26個位點發生堿基缺失,內部序列存在103個堿基不同,僅133個堿基相同,序列相似度僅為50.76%。

圖5 小麥待測樣2 bar序列拼接結果(陰影示上下游引物位置)
農業部1782-6-2012號公告提供的262 bp的bar基因序列與美國國家生物信息中心(NCBI)數據庫的序列進行比對分析,發現該序列在已知的轉基因玉米Bt176品系、克隆載體pbar-35S和pSAT1A-ocsAocsP-bar-ocsT均存在100%的同源序列。待測樣1的bar序列有129個堿基與土壤中的鞘氨醇胞菌BN140058亞種存在73%相似度,但上下游引物均不匹配。待測樣2的bar序列有254個堿基與野生二粒小麥在LOC119283572存在71%非典型相似度,且上下游引物均不匹配(見圖7)。測序結果表明待測樣1和2可能分別來源于鞘氨醇胞菌和野生小麥,盡管PCR擴增出特異性片段,片段大小與目的序列不一致,測序結果與標準序列差異較大,與現有已知序列相似度低,故不能判定2個待測樣的bar基因為轉基因陽性。
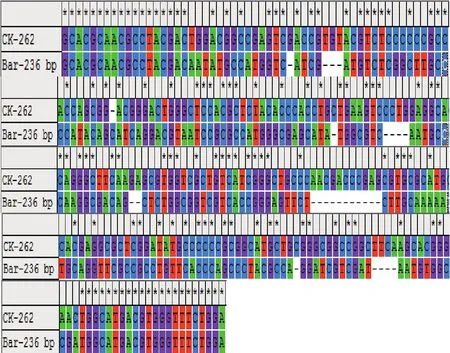
圖6 水稻待測樣1與bar基因標準序列比對結果(★示堿基位點相同)

圖7 小麥待測樣2 bar 序列與NCBI網站序列比對結果
3.結論與討論
農業部1782-6-2012號公告提供的序列為262 bp,國標GB/T 19495.4-2018提供的bar基因片段大小為175 bp,在NCBI數據庫中存在多個同源序列。待測樣水稻中的 bar基因序列比已知序列小26 bp,可能來源于土壤中的鞘氨醇胞菌;待測樣小麥中的 bar基因序列比已知序列大223 bp,可能來源于野生小麥;待測樣水稻中的 bar基因序列與已知序列同源性僅50.76%,待測樣小麥中的 bar基因序列與標準序列幾乎無同源性,該兩個樣品的bar基因檢測結果應判定為陰性。
標準選擇的175 bp和262 bp是bar基因的骨干序列,但bar基因的完整需要遠大于262 bp。我國2008年啟動轉基因重大專項以來,已經十多年,國內研究轉基因水稻、小麥、油菜等作物的科研機構較多。bar基因是常用的植物轉基因的選擇標記,各研發單位采用的bar基因偏差段大小從100多bp到500 多bp都有,因此該基因序列極有可能是存在經過基因改造的新的外源片段,在檢測工作中應予以重視,必要時應輔助其它外源基因或測序加以判定。在轉基因成分鑒定的標準修訂時,應針對與目標片段大小不一致的特異性電泳條帶,考慮采用測序、酶切等方法加以佐證,以防漏檢或誤檢。

