“物質(zhì)的量”的數(shù)學(xué)模型
吳維松 尚九

摘要:本文論述:令學(xué)生頭疼的“物質(zhì)的量”,它是微觀領(lǐng)域的(分子、原子和質(zhì)子等)與宏觀可稱量的質(zhì)量、體積的樞紐,深入淺出構(gòu)建數(shù)學(xué)模型,解釋他們的數(shù)量關(guān)系。
關(guān)鍵詞:物質(zhì)的量;阿伏伽德羅常數(shù);摩爾質(zhì)量;氣體摩爾體積建模
中圖分類號(hào):A?文獻(xiàn)標(biāo)識(shí)碼:A?文章編號(hào):(2021)-37-447
化學(xué)是自然科學(xué)學(xué)科,在微觀層面上,研究物質(zhì)的組成、結(jié)構(gòu)、性質(zhì)、轉(zhuǎn)化。其中的性質(zhì)和轉(zhuǎn)化都是宏觀的。
2018年最新修訂:1mol粒子集團(tuán)所含的粒子數(shù)約為6.02×1023。
一、物質(zhì)的量
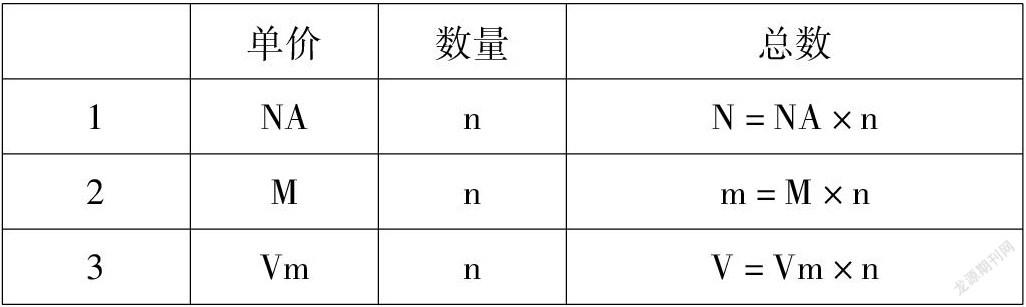
物質(zhì)的量:是一定數(shù)目粒子的集團(tuán)名稱符號(hào)單位物質(zhì)的量n摩爾(mol)?類似小學(xué)數(shù)學(xué)的乘除法問題:工廠出品啤酒:1箱24元,1000箱?,共多少元錢?
1000*24
那么換成符號(hào):1箱NA元,n箱,共多少元?其他符號(hào)呢?
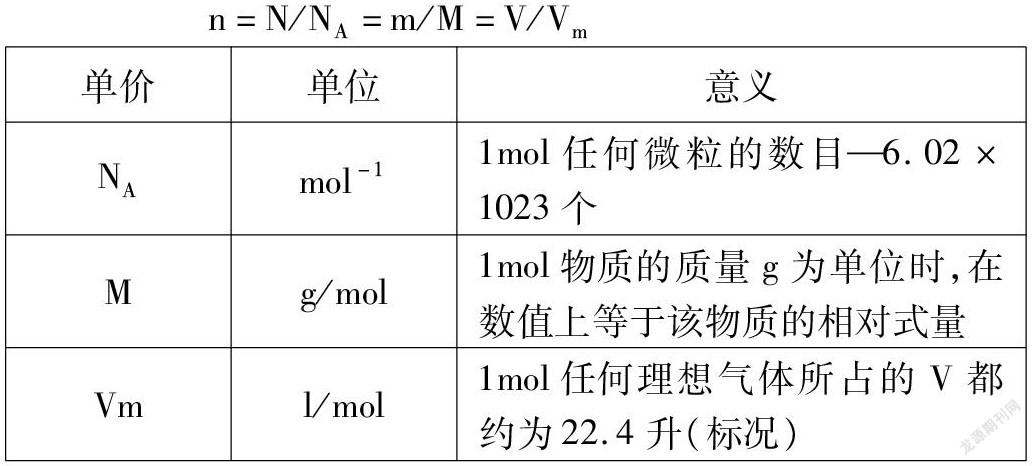
單價(jià)數(shù)量總數(shù)1NAnN=NA×n2Mnm=M×n3VmnV=Vm×n?都與n有關(guān),公式變形,得出:物質(zhì)的量(n)、微粒數(shù)目(N)和阿伏加德羅常數(shù)(NA)、摩爾質(zhì)量(M)、氣體摩爾體積(Vm)間公式:
n=N/NA=m/M=V/Vm單價(jià)單位意義NAmol-11mol任何微粒的數(shù)目—6.02×1023個(gè)Mg/mol1mol物質(zhì)的質(zhì)量g為單位時(shí),在數(shù)值上等于該物質(zhì)的相對(duì)式量Vml/mol1mol任何理想氣體所占的V都約為22.4升(標(biāo)況)
利用連等式來幫助學(xué)生解決“物質(zhì)的量”的計(jì)算問題,微觀的微粒數(shù)目用物質(zhì)的量為樞紐聯(lián)系起了宏觀的質(zhì)量、體積、濃度。而且宏觀三量間也可以互算。方便、簡(jiǎn)潔、概括,充分體現(xiàn)理科的嚴(yán)謹(jǐn)。
總之,“物質(zhì)的量”學(xué)習(xí)的理解過程很是簡(jiǎn)單,雖然陌生、抽象,但是建立數(shù)學(xué)思維可以化繁為簡(jiǎn)。并建立符合化學(xué)學(xué)科特點(diǎn)的學(xué)習(xí)的一般理論。
中學(xué)生進(jìn)入高中階段,化學(xué)公式借鑒數(shù)學(xué)思想,類比法、遷移法等手段都是很好的,方便過渡,深刻理解內(nèi)涵,既鍛煉學(xué)生的思維,又教會(huì)了學(xué)生學(xué)習(xí)的方法。
參考文獻(xiàn)
[1]王開科-以物質(zhì)的量為核心的化學(xué)計(jì)量系統(tǒng)構(gòu)建及其產(chǎn)生式教學(xué)策略《化學(xué)教育(中英文)》-2019-
[2]王萍,劉耀輝-學(xué)生合理認(rèn)知結(jié)構(gòu)構(gòu)建的教學(xué)策略研究-《德州學(xué)院學(xué)報(bào):哲學(xué)社會(huì)科學(xué)版》-2005-

