慢性萎縮性胃炎、胃癌患者外周血ALDH1、G-17水平變化及意義
嚴波,楊善峰,李祥,肖強,何雁,金娟
合肥市第二人民醫院(安徽醫科大學附屬合肥醫院)消化內科,合肥230011
胃癌作為世界范圍內常見的惡性腫瘤,在東亞地區高發,特別是我國安徽中部地區,具有高發病率、高病死率的特點[1-2]。胃癌在我國的發病率、病死率分別占第2、3 位,約占全世界的42.56%和44.97%。探尋新的腫瘤標志物對于胃癌的及早發現及診斷,降低病死率,提高患者生存率及生存質量均具有重要意義。乙醛脫氫酶1(ALDH1)、胃泌素17(G-17)均為新發現的腫瘤標志物,在腫瘤的發展、轉移及耐藥過程中存在協同機制[3]。既往研究主要集中于ALDH1、G-17 在腫瘤轉移、耐藥及預后等方面的作用,而對兩者在腫瘤發生過程中所起的作用尚不明確。本研究觀察了胃癌、慢性萎縮性胃炎患者外周血ALDH1、G-17 水平變化,并對其進行相關性分析,探討二者是否參與了慢性萎縮性胃炎進展至胃癌的過程。現報告如下。
1 資料與方法
1.1 臨床資料 選取 2020 年 4 月—2021 年 3 月我院收治的胃癌患者41例(胃癌組)、慢性萎縮性胃炎患者52 例(萎縮性胃炎組);其中胃癌組男25 例、女16 例,年齡(59.3 ± 6.2)歲;萎縮性胃炎組男31 例、女21例,年齡(56.2±6.1)歲。胃癌組、萎縮性胃炎組患者經胃鏡及病理組織活檢確診。排除標準:①合并炎癥感染性疾病或自身免疫性疾病;②近期大量使用抑酸劑、糖皮質激素、胃黏膜保護劑、抗生素及非甾體藥物;③合并其他類型腫瘤或精神疾病;④合并嚴重心肺肝腎功能不全;⑤既往接受放化療者或孕婦。另選同期我院體檢中心體檢確診的非萎縮性慢性胃炎患者25例(對照組),患者胃鏡檢查均示正常胃黏膜,病理組織學檢查示輕度非萎縮性慢性胃炎;男13 例、女12 例,年齡(52.9 ± 4.3)歲。三組性別、年齡均具有可比性(P均>0.05)。本研究通過醫院倫理委員會審核,患者及其家屬均簽署知情同意書。
1.2 外周血ALDH1、G-17 水平檢測方法 采用ELISA 法。晨起抽取三組外周血6 mL,2 000 r/min離心8 min,取上層血清,-70 ℃冰箱保存待檢。采用 ELISA 法檢測外周血 ALDH1、G-17 水平,ALDH1試劑盒購自美國RayBiotech 公司,G-17 試劑盒購自芬蘭Biohit公司,嚴格按照試劑盒說明書進行操作。
1.3 統計學方法 采用SPSS18.0 統計軟件。計量資料以表示,多組間比較采用方差分析,組間比較采用成組t檢驗;外周血ALDH1、G-17 的相關性采用Pearson 相關分析。P<0.05 為差異有統計學意義。
2 結果
2.1 三組外周血ALDH1、G-17 水平比較 胃癌組外周血ALDH1、G-17水平均明顯高于萎縮性胃炎組和對照組,萎縮性胃炎組外周血ALDH1、G-17 水平均明顯高于對照組(P均<0.05)。見表1。
表1 三組外周血ALDH1、G-17水平比較()
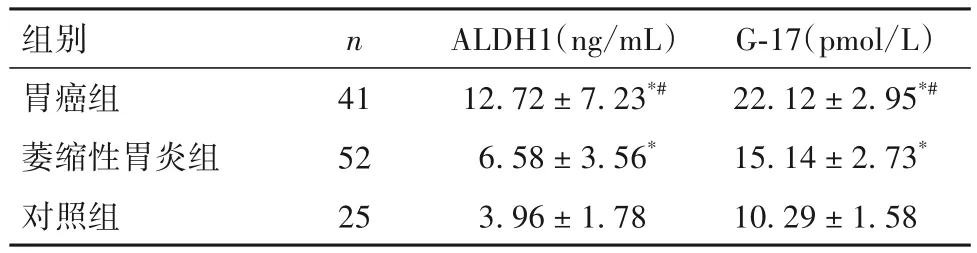
表1 三組外周血ALDH1、G-17水平比較()
注:與對照組比較,*P<0.05;與萎縮性胃炎組比較,#P<0.05。
組別胃癌組萎縮性胃炎組對照組G-17(pmol/L)22.12±2.95*#15.14±2.73*10.29±1.58 n 41 52 25 ALDH1(ng/mL)12.72±7.23*#6.58±3.56*3.96±1.78
2.2 三組外周血ALDH1 與G-17 水平的關系 胃癌組外周血ALDH1 與G-17 水平呈正相關關系(r=0.518、P<0.05),萎縮性胃炎組外周血ALDH1 與G-17 水平呈正相關關系(r=0.632,P<0.05),對照組外周血ALDH1 與G-17 水平無明顯相關性(r=0.208,P>0.05)。
3 討論
我國是胃癌高發國家,且胃癌發病率有逐步升高趨勢[4]。慢性萎縮性胃炎屬于癌前病變,其進展為胃癌的風險明顯增大,尤其是胃竇萎縮性胃炎,癌變風險尤其高。早期胃癌患者多局限于胃黏膜或黏膜下層,通常有黏膜腺體組織的晚期丟失(腺體萎縮),并且發展為新胃癌的風險非常高。因此,尋找與胃癌發生、發展密切相關的腫瘤指標對于明確萎縮性胃炎進展為胃癌的相關機制具有重要意義,同時也可為胃癌早期發現、浸潤、轉移、預后判斷提供可靠的腫瘤標志物。
ALDH1是乙醛脫氫酶(ALDH)家族中新發現的一種腫瘤干細胞標志物,ALDH 超家族編碼特定生命進程中的關鍵酶,在腫瘤的發生、演變、轉移、復發中具有重要作用,可作為胃癌干細胞標志物,為胃癌的診斷和治療提供新的途徑[5-6]。既往研究顯示,ALDH1 蛋白表達與胃癌原發灶腫瘤分級和淋巴結轉移有關,其在胃癌組織中的表達明顯高于癌旁組織,在轉移淋巴結中的表達明顯高于未轉移淋巴結,在低分化癌組織中的表達明顯高于高分化癌組織,對于臨床分期高、有淋巴結轉移灶的胃癌組織ALDH1 表達也更高[7]。有研究顯示,ALDH1 蛋白表達與胃癌的分期、轉移及患者預后有明顯相關性,可作為胃癌早期診斷或預后判斷的指標之一,其與腫瘤干細胞標志物聯合檢測可能對于胃癌患者預后的預測具有重要意義[8]。ALDH1低表達于正常人胃黏膜上皮,但高表達于胃腺癌患者的癌組織中[9]。本研究結果顯示,在正常胃黏膜組織—慢性萎縮性胃炎—胃癌的進展過程中,患者外周血ALDH1水平逐漸升高且差異具有統計學意義,表明在胃癌的發生、發展過程中,ALDH1 可通過一定機制導致或加速胃癌的進程,可能與血管內皮生成因子(VEGF)、上皮—間質轉換(EMT)等促進腫瘤侵潤、轉移有關,但具體機制尚不清楚。研究顯示,NUAK2能夠促進胃癌腫瘤干細胞標志物表達上調,可促進胃癌細胞增殖及轉移[10]。幽門螺桿菌(Hp)感染可引發炎癥并改變胃局部微環境,促使干細胞分化并導致腺體增生,這些變化均可能會影響胃干細胞的分化,并誘導胃癌的發生[11]。
G-17 具有刺激胃酸分泌、促進胃黏膜細胞增殖和分化的生理功能,是胃竇和十二指腸G 細胞合成和分泌的一種胃泌素,占人體胃泌素總量的90%,對于調節消化道功能和維持其結構完整具有重要作用。外周血G-17 水平變化可反映胃黏膜病變情況,常用于癌前病變及胃癌篩查,具有無創、簡便等優點,被稱為“血清學活檢”,在臨床應用中具有重要價值[12]。但 G-17 在胃癌的發生、發展、轉移及預后判斷中的研究較少,且相關機制尚不完全明確。本研究結果顯示,在正常胃組織黏膜—慢性萎縮性胃炎—胃癌的進展過程中,患者外周血G-17 水平逐漸升高且差異具有統計學意義,提示G-17 可能通過多個信號傳導通路參與胃癌細胞增殖。研究顯示,G-17 可激活混合譜系激酶3(MLK3),使金屬基質蛋白酶活化,細胞外基質降解,從而降解細胞間聯接,促進腫瘤侵潤及轉移[13]。Hp可刺激胃泌素釋放增多,導致胃黏膜炎癥、腸腺化生、萎縮、不典型增生,從而參與胃癌的發生、發展,提示胃癌的發生過程中胃泌素和Hp感染有協同作用。
腫瘤的發生、發展是一個漸進式過程,涉及多級反應和積累,因此腫瘤的發生、發展呈網絡狀復雜機制,很多環節尚不明確。不同的致癌因素可能通過不同機制共同促進腫瘤的發生和發展,相關機制之間可能存在交叉,甚至有共同的機制或相近的協同機制促進腫瘤的發生和發展。本研究結果顯示,慢性萎縮性胃炎與胃癌患者的外周血ALDH1 與G-17水平均呈正相關關系,而對照組卻沒有明顯相關性,這表明ALDH1 和G-17 之間可能通過相互作用或協同作用促進胃癌的發生和發展[14]。結合國內外研究,考慮其作用機制可能如下:①ALDH1 可通過VEGF 促進血管內皮細胞增殖,導致胃癌和新生組織中異常血管生成。②G-17通過與膽囊收縮素2受體(CCK-2R)結合發揮作用,在血管生成中增強內皮細胞活性,增加微血管和小靜脈的通透性,從而促進胃癌發展[3]。③Hp 感染可引發炎癥并改變胃內的局部微環境,使Hp與胃上皮祖細胞和干細胞相互作用,加速干細胞增殖,導致胃黏膜炎癥、腸腺化生、萎縮、不典型增生的發生[11];而ALDH1 是組織中正常干細胞和腫瘤干細胞生長、分化的必需物質,同時ALDH1 在胃癌組織中高表達,可作為評價胃癌預后的指標,而L 型幽門螺旋桿菌(Hp-L)感染可促進ALDH1 的表達[15],因此 ALDH1 可能與 Hp 共同作用影響胃干細胞的分化并誘導胃癌發生。
綜上所述,慢性萎縮性胃炎、胃癌患者外周血ALDH1、G-17 水平均升高,二者共同參與了慢性萎縮性胃炎進展至胃癌的過程。由于腫瘤的發生、發展是一個極其復雜的過程,本研究只能證實ALDH1和G-17 共同參與慢性萎縮性胃炎進展至胃癌的過程,且在此過程中存在一定相關性,但其具體機制需要進一步研究明確。

