基于網絡藥理學探討仙茅-淫羊藿藥對治療卵巢儲備功能減退的作用機制※
胡長容,周艷艷,付佳琳,任靜雯,劉陽陽,黃旭博,袁俊俊
(1.河南中醫藥大學,河南 鄭州 450002;2.河南省中醫院,河南 鄭州 450002;3.中國中醫科學院廣安門醫院,北京 102618)
卵巢儲備功能減退(diminished ovarian reserve,DOR)是指卵巢內卵母細胞的數量減少和/或質量下降,伴抗苗勒管激素(AMH)水平降低、竇卵泡數(AFC)減少、卵泡刺激素(FSH)水平升高,表現為生育能力下降,但不強調年齡、病因和月經改變[1]。目前,該病趨于年輕化,如果未能及早發現并治療,可在1~6年內發展為卵巢早衰甚至卵巢功能衰竭[2]。西醫常采用激素替代療法(HRT)和輔助生殖技術(ART)治療,但存在周期取消率高、臨床妊娠率、抱嬰率低等情況[3]。DOR可歸于中醫“月經過少”“閉經”“不孕癥”“絕經前后諸證”等范疇。基于“治未病”思想,對于DOR患者應做到早診斷、早治療,發揮中醫藥特色,積極調整其月經,保留育齡期女性的剩余卵巢功能,改善妊娠結局。
仙茅-淫羊藿藥對始載于?本草綱目?,是上海中醫藥大學張伯訥教授創制的二仙湯中的核心組方,是常用的補腎陽藥對。研究表明,淫羊藿中的主要有效成分淫羊藿苷和仙茅中的仙茅乙醇提取物均有類激素樣雙向調節作用[4]。周艷艷教授認為,DOR的病因責之于腎陰陽兩虛,腎精、腎陰是卵泡生長發育的物質基礎,腎中陽氣是卵泡生長發育的動力;腎精充足和腎陰、腎陽的平衡與否,與卵巢儲備功能、卵子發育成熟密切相關。因此,臨床組方補腎精時,常加用仙茅-淫羊藿藥對,使陰陽互助而泉源不竭,從而達到調整卵巢功能、促進內分泌水平恢復的效果。
仙茅-淫羊藿藥對用于臨床療效確切,但其作用靶點和分子機制尚不清楚。網絡藥理學是多學科相互滲透,運用在線數據庫及各項技術,揭示藥物-基因-靶點-疾病相互作用的網絡關系,通過網絡關系預測藥物的作用機制,用以尋找高效低毒藥物的一門新興學科[5]。臨床上目前對于DOR的病因、病機、診療方案尚無規范化的認識,故本研究通過網絡藥理學的方法探討仙茅-淫羊藿治療DOR的作用機制,旨在為臨床治療DOR提供新思路。
1 研究方法
1.1 仙茅、淫羊藿相關靶點篩選 通過中藥系統藥理學數據庫與分析平臺(TCMSP,http://tcmspw.com/tcmsp.php)檢索仙茅、淫羊藿的化學成分,以口服利用度(OB)≥30%、類藥性(DL)≥0.18為篩選條件,獲取活性成分及蛋白質靶點,在UniProt蛋白質數據庫(https://www.uniprot.org)中將化合物對應的蛋白質靶點進行統一標準化,將生物種類設定為“Homo sapiens”。
1.2 DOR相關靶點篩選 以“diminished ovarian reserve”為關鍵詞進行搜索,挖掘人類基因注釋數據庫(GeneCards,https://www.genecards.org)、在線人類孟德爾遺傳數據庫(OMIM,https://www.omim.org)、疾病相關的基因與突變位點數據庫(DiSGeNET,http://www.disgenet.org)中DOR的相關靶點,合并疾病數據庫靶點后去重,得到DOR的靶點信息,在UniProt蛋白質數據庫中進行標準化。
1.3 仙茅、淫羊藿-DOR靶點PPI網絡構建 利用Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)將仙茅、淫羊藿活性成分作用靶點與DOR相關靶點取交集,并繪制韋恩圖。將交集靶點提交至STRING 11.0數據庫(https://string-db.org)并構建蛋白-蛋白交互(PPI)網絡,將生物種類設定為“Homo sapiens”,最小互相作用閾值設定為“medium confidence”>0.4,其余設置均為默認設置,得到PPI網絡后通過Cytoscape 3.7.2對其進行分析,篩選關鍵靶點。
1.4 仙茅-淫羊藿與疾病交集靶點網絡圖構建 將1.3中獲取的交集靶點與相對應的藥物活性成分錄入Cytoscape3.7.2,構建藥物成分與靶點之間的網絡圖,根據網絡拓撲學參數獲得治療DOR可能發揮藥效的主要活性成分。
1.5 仙茅、淫羊藿-DOR關鍵靶點功能與通路的富集分析 將仙茅-淫羊藿藥對治療DOR的靶點錄入Metascape數據庫(http://metascape.org),物種信息選擇為“H.sapiens”,對交集靶點進行GO富集分析和KEGG信號通路富集分析,設置P<0.01。
2 結果
2.1 仙茅-淫羊藿藥對活性成分信息 經A DME屬性篩選后共獲得仙茅中的活性成分7種(剔除缺乏靶點信息成分MOL004146,余6種),淫羊藿中的活性成分23種,包括槲皮素(quercetin)、木犀草素(Luteolin)、山柰酚(kaempferol)、β-谷甾醇(beta-sitosterol)等,見表1。仙茅作用靶點61個,淫羊藿作用靶點221個,合并去重后得到作用靶點228個。
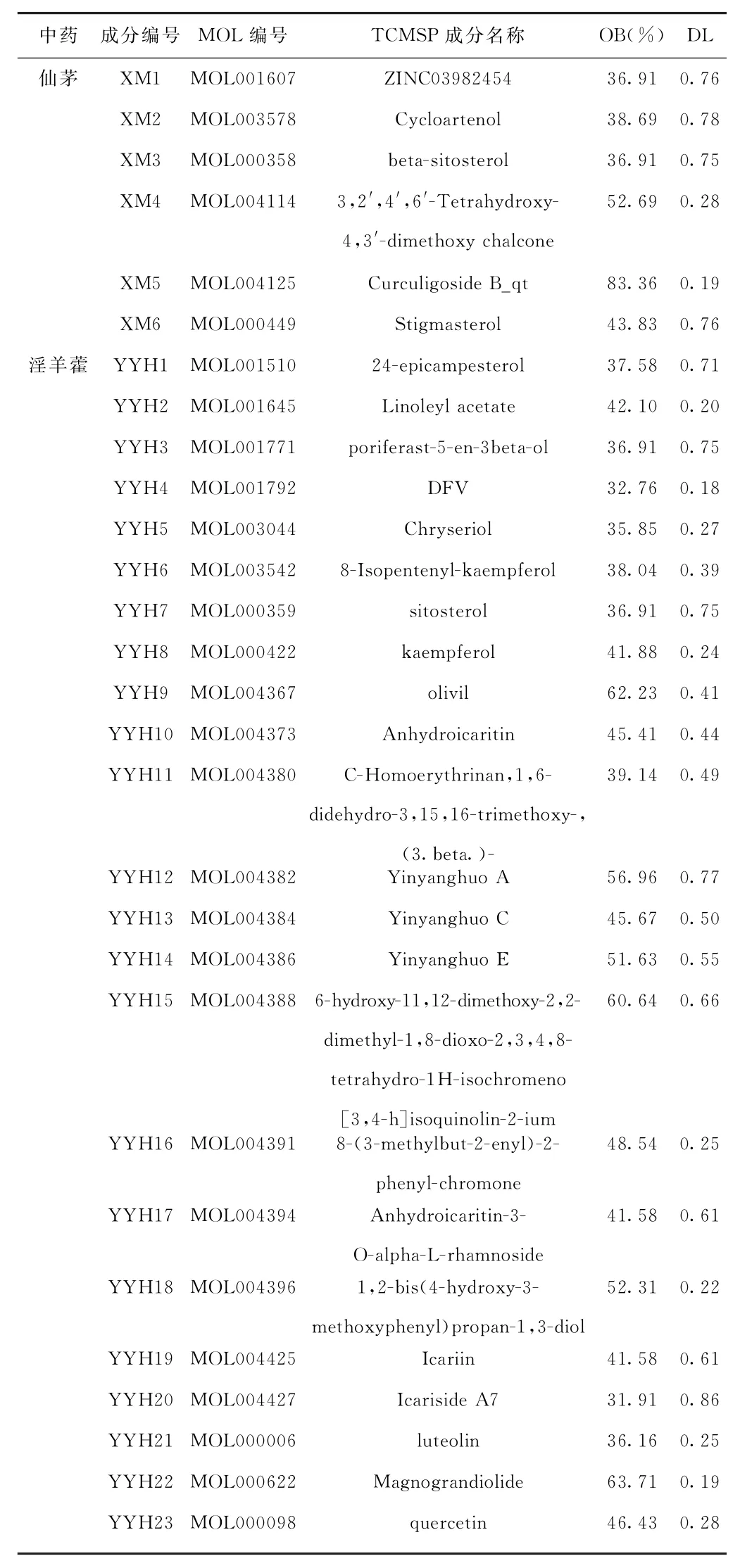
表1 仙茅-淫羊藿藥對活性成分信息
2.2 DOR靶點 從OMIM、GeneCards、DiSGeNET數據庫中分別獲取DOR靶點145、1 093、43個,將所得數據合并去重后進入UniProt數據庫規范,選擇生物種類“Homo sapiens”,最終得到1 138個DOR相關靶點。
2.3 仙茅、淫羊藿-DOR靶點PPI網絡構建與分析 將篩選的仙茅-淫羊藿活性成分靶點與DOR疾病靶點通過Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)取交集并繪制韋恩圖。將獲得128個交集靶點提交至STRING 11.0平臺,得到仙茅、淫羊藿-DOR的靶點PPI網絡。運用CytoScape 3.7.2進行可視化分析,該網絡圖包括128個節點與2 271條相互作用關系連線,節點大小與靶點蛋白的度值呈正相關。掃描題目右側二維碼查看圖1—3。
2.4 仙茅-淫羊藿藥對與疾病交集靶點網絡圖構建與分析 仙茅-淫羊藿藥對與DOR交集靶點共128個,與其相關的藥物活性成分是XM1、XM2、XM3、XM4、XM6、YYH5、YYH6、YYH8、YYH11、YYH21、YYH23。利用Cytoscape 3.7.2軟件構建“藥物-活性成分-靶點-疾病”網絡。該網絡包括141個節點,267條邊,度值較高的活性成分為槲皮素、木犀草素、山柰酚、β-谷甾醇。掃描題目右側二維碼查看圖4。
2.5 靶點功能與通路富集分析 仙茅-淫羊藿藥對主要參與的生物信息學過程(BP)包括對有毒物質的反應(responsETo toxic substance)、對無機物質的反應(responsETo inorganic substance)、細胞對有機循環化合物的反應(cellular responsETo organic cyclic compound)、對脂多糖的反應(responsETo lipopolysaccharide)、對氧氣水平的反應(responsETo oxygen levels)、血液循環(blood circulation)、凋亡信號通路(apoptotic signaling pathway)等。分子功能(MF)包括細胞因子受體結合(cytokine receptor binding)、蛋白質域特異性結合(protein domain specific binding)、G蛋白耦合胺受體活性(G protein-coupled amine receptor activity)、蛋白質激酶結合(protein kinase binding)、轉錄因子結合(transcription factor binding)、核受體活性(nuclear receptor activity)等。細胞組成(CC)包括膜筏(membrane raft)、突觸前膜的積分成分(integral component of presynapticmembrane)、囊腔(vesicle lumen)、細胞質核周區(perinuclear region of cytoplasm)、蛋白激酶復合物(protein kinase complex)等。參與的富集通路主要有癌癥途徑、晚期糖基化產物-晚期糖基化終末產物受體(AGE-RAGE)信號通路、白細胞介素-17(IL-17)信號通路、磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信號通路、細胞凋亡通路、缺氧誘導因子-1(HIF-1)信號通路、核因子-κB(NF-κB)信號通路掃描題目右側二維碼查看圖4。
3 討論
現代醫學研究表明,仙茅-淫羊藿藥對廣泛用于治療臨床各科疾病,包括骨質疏松癥、卵巢早衰、抑郁癥等[5-7]。本研究結果顯示,仙茅-淫羊藿藥對治療DOR的主要活性成分可能為槲皮素、木犀草素、山柰酚、β-谷甾醇等,主要靶點可能為 AKT1、IL-6、TP53、VEGFA、CASP3等,可能參與的通路有癌癥途徑、AGE-RAGE信號通路、IL-17信號通路、PI3K-AKT信號通路、細胞凋亡、HIF-1信號通路、NF-κB信號通路等。由此可見,仙茅-淫羊藿藥對治療DOR是通過多成分、多靶點、多途徑來達到治療效果的。
槲皮素是一種黃酮類化合物,具有抗炎、抗菌、抗腫瘤、抗氧化、清除自由基及類雌激素樣作用[8]。槲皮素既可改變卵巢內各級卵泡的比例及卵巢分化,又可抑制卵泡閉鎖,影響相關激素的分泌,達到抑制卵泡發育的作用[9]。β-谷甾醇可作用于卵巢顆粒細胞,促進其產生雌二醇(E2),具有雌激素活性[10]。
蛋白激酶B(AKT1)是PI3K/AKT信號通路中重要的下游靶激酶,位于通路的核心位置,參與細胞生長的調控,當AKT1正常表達時,可以維持原始卵泡正常的生長發育,調節卵母細胞生長和顆粒細胞增殖分化,并可抑制細胞凋亡;當AKT1表達異常時,會使原始卵泡生長發育失常,導致卵巢發生病理性改變,加速卵巢衰老[11]。白細胞介素(IL-6)是一種多效性細胞因子,是PI3K/AKT通路的上游調控因子,參與人體免疫調節,且在卵泡閉鎖中起著至關重要的作用[12]。有研究表明,IL-6等炎癥因子是引起免疫性卵巢早衰的關鍵[13]。腫瘤相關蛋白TP53的一個同系物TAp63是脫氧核糖核酸(DNA)損傷凋亡通路的關鍵調控因子,當細胞DNA受損時,TAp63與磷酸化的非受體酪氨酸激酶c-Abl相互作用,激活下游信號分子促凋亡基因,誘發細胞凋亡級聯反應,直接或間接促使卵巢儲備功能降低[14]。TP53也與卵巢顆粒細胞的凋亡與增殖密切相關[15]。血管內皮生長因子A(VEGFA)是對血管形成具有特異性的重要作用因子,可通過促進內皮細胞的遷移及增殖促進血管新生[16]。卵泡的發育過程與血管新生密切相關,卵泡周圍血管網絡的發育障礙將導致卵泡顆粒細胞凋亡,進而導致卵泡閉鎖。胱天蛋白酶3(CASP3)是胱天蛋白酶(CASP)家族中的一個凋亡效應因子,在卵母細胞、顆粒細胞中均有表達,主要參與細胞凋亡過程,當CASP3系統被激活時可觸發細胞凋亡,加速卵巢早衰[17]。仙茅-淫羊藿藥對可能通過調節以上主要靶點而發揮治療DOR的作用。
PI3K/AKT是最重要的信號轉導途徑之一,參與細胞增殖、細胞周期調控、細胞凋亡和其他相關病理、生理過程[18]。磷脂酰肌醇3-激酶(PI3K)和下游效應器蛋白激酶(AKT)屬于一個保守的家庭信號轉導酶,參與調節細胞的激活、炎性反應和細胞凋亡。卵母細胞中的PI3K信號能控制原始卵泡的存活、丟失和激活[19]。PI3K可以激活磷酸肌苷依賴激酶-1/2(PD K 1/2),然后磷酸化AKT的兩個關鍵蘇氨酸和絲氨酸殘基。在卵巢中,AKT是PI3K/AKT通路中的重要激酶,并且在人類卵泡的卵母細胞和顆粒細胞中均有表達。AKT具有廣泛的底物,在卵泡激活過程中具有直接和間接的作用。原始卵泡激活支配著卵母細胞的生長發育及周圍體細胞顆粒細胞的分化和增殖,因此這兩個過程都是實現排卵的必要過程。此外,研究表明,該通路在免疫和自身免疫中發揮關鍵作用[20]。當超過10%的顆粒細胞出現凋亡時,卵泡可能處于閉鎖狀態,提示顆粒細胞凋亡是各發育階段卵泡閉鎖的主要機制。此外,顆粒細胞為卵母細胞成熟提供必要的生長信號和營養。顆粒細胞的狀態對卵泡發育至關重要,其本質上是減少顆粒細胞凋亡,修復原始卵泡儲備池,是修復卵巢功能的主要機制。PI3K/AKT通路參與代謝、細胞穩態、神經發育等過程,并調控細胞發育的各個方面,如凋亡、細胞周期和細胞分化。此外,PI3K/AKT通路參與卵母細胞生長、原始卵泡發育、顆粒細胞增殖和凋亡。研究發現,細胞毒性藥物通過抑制PI3K/AKT信號通路,導致顆粒細胞凋亡,增加卵巢功能早衰發生的風險[21]。HIF-1是一種異源二聚體轉錄因子,由氧敏感亞基HIF-1 α和芳基烴核轉位器HIF-1β組成。HIF-1的激活可以保護神經元免于凋亡,可以調節多種基因的表達。一方面,HIF-1可能通過抑制細胞色素C的釋放、DNA修復酶PA R P的切割和含半胱氨酸的天冬氨酸蛋白水解酶(CASPa Se)的激活來阻止凋亡細胞的死亡;另一方面,HIF-1可能通過抑制P53的激活來維持細胞生存。HIF-1激活后,葡萄糖運輸和糖酵解流量的增加也與組織活力和細胞存活有關[22]。HIF-1通路中特定的轉錄因子被激活,可誘導卵巢中HIF-1 αm R NA和蛋白表達增加,并在顆粒細胞中進行特異性表達,表明HIF-1信號通路可能直接作用于卵巢,促進卵巢發揮其生理功能,從而防止卵巢早衰[23-24]。在卵泡的生長發育過程中,細胞凋亡起重要作用[25],顆粒細胞凋亡率過高影響卵母細胞發育,這可能是因為顆粒細胞向卵母細胞傳遞凋亡信息。NF-κB是體內最重要的核轉錄因子之一,參與多種基因調控、機體免疫應答和細胞凋亡的信號傳導過程[26-27]。NF-κB對細胞凋亡存在雙向調節,既可以促進細胞凋亡,也可以抑制細胞凋亡。由此可見,PI3K-AKT信號通路、細胞凋亡、HIF-1信號通路、NF-κB信號通路對卵泡的調節起著至關重要的作用。
仙茅-淫羊藿藥對是臨床常用的補腎陽藥對,本文基于網絡藥理學的方法,初步預測了此藥對作用于DOR的基本藥理學作用機制,為臨床組方提供了新的思路。因數據庫數據有限等客觀原因,其具體作用機制仍需進一步研究來闡明。

