食管鱗狀細胞癌中MGP基因的表達和啟動子區甲基化狀態及其臨床意義
薛 麗 葉 明 王 剛
食管鱗狀細胞癌(ESCC)是食管癌的主要亞型,在中國的發病率較高[1]。目前ESCC的臨床診斷和治療方法已取得了實質性的進步,但ESCC患者的5年生存率仍低于15%[2]。因此,迫切需要探究ESCC發生、發展的分子機制。研究表明,ESCC細胞易于侵襲周圍組織,從而難以進行完整的手術切除,容易復發,導致ESCC患者的生存率較低[3]。從生物學的角度來看,ESCC細胞的侵襲是基于與其他腫瘤或非腫瘤細胞,以及食管上皮細胞外基質(ECM)的相互作用。
基質Gla蛋白(MGP)是一種細胞黏附相關蛋白和ECM相關蛋白,最初從骨組織中分離而來,表達于腎、肺、心、軟骨和血管平滑肌細胞中[4]。MGP蛋白含有79個氨基酸,包含因維生素K依賴的羧化作用而產生的翻譯后修飾的γ-羧基谷氨酸殘基。研究表明MGP參與了抑制動脈和軟骨的鈣化過程[5],并且MGP的種系突變會引發Keutel綜合征,從而導致異位鈣化異常和面部發育不全[6]。目前關于MGP表達水平與ESCC進展相關的機制的研究報道較少。MGP已被證明可促進胃癌細胞、膠質瘤細胞的侵襲,并且在多種人類腫瘤(包括乳腺癌、膠質瘤、胃癌)中均發現MGP基因啟動子區甲基化的改變與腫瘤的侵襲及患者預后相關[7-9]。由此推測,MGP基因啟動子區甲基化狀態失調與ESCC細胞的侵襲可能有關。本研究觀察了ESCC組織中MGP的表達和啟動子區甲基化狀態的變化,并分析了MGP對ESCC細胞侵襲的影響。
1 材料與方法
1.1 標本來源
收集2014年5月至2019年5月于中國人民解放軍空軍第九八六醫院腫瘤科接受手術治療的253例ESCC患者的ESCC組織標本和癌旁非癌組織(距離腫瘤邊緣2~3 cm的健康組織)標本,分別設為ESCC組和癌旁非癌組。納入標準:(1)根據2013年中國抗癌協會食管癌專業委員會發布的《食管癌規范化診治指南》確診為ESCC[10];(2)術前未進行放射治療或化學治療。排除標準:(1)食管腺癌患者;(2)非原發ESCC,腫瘤轉移至食管的患者;(3)其他國家和民族的患者。采用隨機數字表法從253例患者中選擇經實時熒光定量PCR(Real-time qPCR)法驗證ESCC組織中MGP基因表達水平高于癌旁非癌組織的5例患者,收集其ESCC組織標本和癌旁非癌組織標本,按收集順序編號為1~5號,將這5例患者的ESCC組織標本設為A組,將相匹配的癌旁非癌組織標本設為B組,檢測兩組MGP的蛋白表達水平和分布。收集所有入選患者的年齡、性別、腫瘤位置、腫瘤大小、分化程度、TNM分期[美國癌癥聯合委員會(AJCC)發布的食管癌第八版分期標準][11]、淋巴結狀態、浸潤程度等臨床資料。所有患者均知情同意,本研究經醫院醫學倫理委員會批準(批件號986-2019041204)。
1.2 試劑與耗材
人ESCC細胞系KYSE30購自中國典型培養物保藏中心;杜氏改良Eagle培養基(DMEM培養基)購自美國HyClone公司;Real-time qPCR試劑盒購自日本TaKaRa公司;MGP一抗購自美國Abcam公司;DNA甲基化轉移酶1(DNMT1)的沉默質粒(si-DNMT1)和陰性對照(si-NC)、MGP的重組高表達質粒(pcDNA3.1-MGP)和其空載體(EV)均購自上海吉瑪制藥技術有限公司;TRIzol試劑盒、Lipofectamine 2000轉染試劑和Transwell小室均購自美國Invitrogen(Thermo Fisher Scientific)公司。
1.3 MGP mRNA相對表達量的檢測
采用Real-time qPCR法檢測組織中MGP的表達水平。采用TRIzol一步法提取253例組織樣本(包括ESCC組和癌旁非癌組)及KYSE30細胞的總RNA,反轉錄后得到cDNA,以GAPDH作為內參,引物序列見表1。PCR反應條件:95 ℃預變性360 s,之后96 ℃變性10 s,55 ℃退火25 s,71 ℃延伸30 s,循環數為38。每個樣本重復檢測2次。以2-△△Ct表示MGPmRNA的相對表達量。相對表達量的判定標準:log2FC>1為高表達,log2FC<-1為低表達,其中FC指兩組表達量的比值。

表1 引物序列
1.4 MGP啟動子區甲基化檢測
提取ESCC組和癌旁非癌組中的DNA,使用HhaI和McrBC酶切每組的DNA樣品,并以非酶切樣本作為對照。具體步驟:包含1 μg DNA樣本和60 U限制性內切酶且總體積為100 μL的體系,在37 ℃下反應16 h,添加10 U限制酶反應5 h。使用德國Qiagen PCR純化系統對經HhaI和McrBC消化的DNA樣本進行純化。MGP甲基化判斷:(1)無甲基化,指經McrBC消化的DNA中有擴增,但經HhaI消化的DNA中無擴增;(2)不完全甲基化,指每個等位基因均包含甲基化和未甲基化區域,導致HhaI和McrBC消化,但無后續擴增;(3)完全甲基化,指經HhaI消化的DNA中有擴增,但無來自McrBC消化的DNA。定量PCR反應條件同1.3小節。甲基化率=C/(C+T)×100%,其中C指胞嘧啶,T指胸腺嘧啶。甲基化率的判定標準:log2FC>1為高甲基化水平,log2FC<-1為低甲基化水平,其中FC指兩組甲基化率的比值。
1.5 DNA亞硫酸氫鹽修飾及測序
使用亞硫酸氫鹽對ESCC組和癌旁非癌組的基因組DNA進行處理,甲基化亞硫酸氫鹽測序試劑盒購自武漢默沙克生物科技有限公司。嚴格按照說明書操作,對亞硫酸氫鹽修飾后的MGP基因啟動子區DNA進行測序。MGP引物序列:正向為5′-TGCGTCAGTCTTATGCTAAGCA-3′,反向為5′-TTGCACAGTGCATCGACCACGT-3′。樣品均由生工生物工程(上海)股份有限公司進行測序。
1.6 MGP蛋白表達水平的檢測
采用蛋白質印跡法檢測MGP的蛋白水平。取1~5號患者的ESCC組織標本和癌旁非癌組織標本,在冰浴中研磨,使用磷酸鹽緩沖液清洗后加入裂解液。采用Bio-Rad蛋白測定法進行蛋白質定量,將10 mg總蛋白上樣至4%~12%的十二烷基硫酸鈉聚丙烯酰胺凝膠,并進行電泳。將電泳分離的蛋白質轉印至硝酸纖維素膜上,并用MGP一抗(1∶500)和GAPDH一抗(1∶2 000)孵育轉印有蛋白質的硝酸纖維素膜;以GAPDH作為內參蛋白。兩種一抗均在4 ℃下孵育8 h。使用辣根過氧化物酶(HRP)連接的抗兔IgG二抗(1∶4 000)室溫孵育45 min。使用Luminol溶液顯影,應用ImageJ v1.8.0軟件進行灰度分析。
1.7 MGP蛋白的定位和分布檢測
采用免疫組織化學染色法評估MGP蛋白在組織中的定位和分布。取1~5號患者的ESCC組織標本和癌旁非癌組織標本,切成4 μm厚度的組織薄片。將切片于二甲苯溶液及乙醇梯度溶液中脫蠟、脫水后,使用3% H2O2處理,隨后在微波爐中使用枸櫞酸鈉緩沖液進行抗原修復。使用5%山羊血清封閉,加入稀釋后的MGP一抗(1∶400)和Ki67(1∶500,作為陽性對照),置于4 ℃冰箱中過夜。滴加生物素偶聯二抗,室溫放置30 min。緩沖液清洗后,滴加辣根酶標記的鏈霉卵白素工作液,DAB工作液顯色。用自來水充分沖洗,復染,脫水,中性樹脂封片。陽性判定標準:細胞被標記為黃色、棕黃色、黃褐色為陽性細胞。陽性率=目標區域陽性細胞數量/目標區域總細胞數量×100%。
1.8 細胞培養和轉染
使用含有10%胎牛血清的DMEM培養基,在含5% CO2的恒溫(37 ℃)培養箱中培養KYSE30細胞。將細胞以1×105個/孔的密度接種于24孔板中。分別使用si-DNMT1、si-NC、pcDNA3.1-MGP和EV對KYSE30細胞進行轉染,轉染時間為24 h,分別設為si-DNMT1組、si-NC組、MGP過表達組和EV組,另外將不進行任何處理的KYSE30細胞設為對照組。
1.9 Transwell侵襲實驗
使用100 μL無血清培養基稀釋基質膠并混合,將稀釋后的基質膠均勻涂抹于Transwell上室,然后置于24孔底部腔室中。底部腔室有250 μL含10%胎牛血清的DMEM培養基,將si-DNMT1組、si-NC組、MGP過表達組、EV組和對照組細胞以1×105個/孔的密度接種于Transwell上室中。孵育24 h后,分別使用甲醇和0.1%的結晶紫固定侵襲的細胞。在倒置顯微鏡下計數侵襲細胞的數量。相對細胞數量=各處理組細胞數量平均值/對照組細胞數量平均值。
1.10 統計學分析
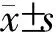
2 結果
2.1 ESCC患者的一般資料
253例ESCC患者中,男性158例,女性95例;年齡43~78歲,年齡中位數為65歲。按照解剖學部位劃分,腫瘤位于食管中段有210例,位于上、下段有43例。腫瘤直徑<4 cm 107例,≥4 cm 146例。根據組織病理學分級,高分化43例,中分化196例,低分化14例。按照侵襲程度劃分,T1~T2期59例,T3~T4期194例。有淋巴結轉移124例,無淋巴結轉移129例。根據AJCC第七版的分期標準,腫瘤Ⅰ期18例,Ⅱ期72例,Ⅲ期163例。
2.2 MGP mRNA的相對表達量
采用Real-time qPCR法檢測ESCC組和癌旁非癌組中MGP基因的轉錄水平。結果顯示,與癌旁非癌組相比,ESCC組中MGPmRNA的相對表達量較高,兩組差異有統計學意義(P<0.05),見圖1A。由圖1B可知,166例(65.6%)患者的ESCC組織中MGPmRNA的相對表達量高于與之配對的癌旁非癌組織(|log2FC|>1,P<0.05)。

注:與癌旁非癌組相比,*P<0.05
2.3 MGP蛋白的表達水平
蛋白質印跡法結果顯示,A組中MGP的蛋白表達水平高于B組,兩組差異有統計學意義(P<0.05),見圖2。

注:A組指5例患者的ESCC組織標本,B組指該5例患者的癌旁非癌組織標本
MGP的免疫組織化學染色結果如圖3A、圖3B所示,B組中MGP的陽性率高于A組。 以Ki67基因作為陽性對照,其在ESCC組和癌旁非癌組中的表達見圖3C、圖3D。

圖3 MGP在ESCC組和癌旁非癌組中的表達 免疫組織化學染色 A ESCC組中MGP的表達 左×40 右×400 B 癌旁非癌組中MGP的表達 左×40 右×400 C ESCC組中Ki67的表達 ×40 選區×400 D 癌旁非癌組中Ki67的表達 ×40 選區×400
2.4 MGP啟動子區甲基化水平
甲基化檢測結果顯示,253例患者MGP基因低甲基化的有180例。ESCC組中MGP基因啟動子區CpG島平均甲基化率為(10.07±5.29)%,低于癌旁非癌組(17.92±3.49)%,兩組的差異有統計學意義(t=-9.15,P=0.025)。見圖4A。
ESCC組和癌旁非癌組使用亞硫酸氫鹽修飾DNA后,采用Real-time qPCR法擴增MGP基因的啟動子區域。PCR產物經瓊脂糖凝膠電泳分離后,兩組PCR產物的特異性條帶長度均為243 bp(見圖4B),與預期片段長度一致。對PCR擴增產物測序,并比對測序結果與MGP基因啟動子區的原始序列。結果顯示,癌旁非癌組中MGP基因啟動子區CpG島發生甲基化且未被亞硫酸氫鹽所修飾,而ESCC組中MGP基因啟動子區CpG位點呈低甲基化水平。
2.5 MGP過表達對于ESCC細胞侵襲能力的影響
如圖5所示,與EV組及對照組相比,MGP過表達組的侵襲細胞數量顯著增多,差異均有統計學意義(t=5.610,P=0.027;t=6.223,P=0.018);而對照組與EV組的差異則無統計學意義(P>0.05)。這表明MGP過表達能增強ESCC細胞的侵襲能力。
2.6 敲低DNMT1對于ESCC細胞侵襲能力的影響
如圖6所示,與si-NC組和對照組相比,si-DNMT1組的侵襲細胞數量均顯著增多,差異均有統計學意義(t=7.551,P=0.004;t=7.119,P=0.012)。對照組與si-NC組的差異無統計學意義(P>0.05)。這表明敲低DNMT1能增強ESCC細胞的侵襲能力。

注:與EV組比較,a P<0.05

注:與si-NC組比較,a P<0.05
3 討論
惡性腫瘤是表觀遺傳疾病。表觀遺傳的變化可能導致抑癌基因的轉錄沉默。在人類基因組中,CpG二核苷酸分布不協調形成的富含CpG的區域稱為CpG島。CpG島異常甲基化是常見的表觀遺傳修飾,可影響細胞網絡中的多種信號通路,例如細胞凋亡和上皮間充質轉化等。本研究結果顯示,人ESCC組織中的MGP甲基化狀態異常,MGP的表達受啟動子區域甲基化的調控,且MGP可促進ESCC細胞的侵襲。
本研究發現,ESCC患者的腫瘤組織中MGP表達普遍上調,并通過蛋白質印跡法和免疫組織化學染色法證實了該結果。有研究報道,胃癌組織中MGP的mRNA和蛋白表達水平均升高[9]。MGP是一種細胞外基質調節蛋白,在胞外廣泛表達[9],在胃癌細胞內亦存在MGP積累[12]。研究表明,MGP可作為信號轉導與轉錄激活因子5(STAT5)的新型轉錄共激活因子,促進腫瘤細胞的侵襲[8-9]。本研究表明,MGP過表達能顯著增強ESCC細胞的侵襲能力。研究發現,與細胞轉移密切相關的磷脂酰肌醇激酶(PI3K)/蛋白激酶B(Akt)信號通路的激活可促進MGP表達[13],該通路與腫瘤進展密切相關,并可能通過MGP發揮作用[14]。另有研究指出,MGP是多種腫瘤(包括胃癌、膠質瘤等)的潛在治療靶點[9,15]。因此,MGP在ESCC中高表達可能通過增強細胞的侵襲能力,從而促進ESCC的進展。
MGP甲基化改變在結直腸癌的發展中扮演著重要角色[16]。本文探究了MGP的表觀遺傳調控功能,結果發現MGP在人ESCC組織中表達水平較高,但其甲基化水平較低,且MGP的高表達受啟動子區甲基化的調控。以上結果提示MGP的低甲基化和高表達可作為ESCC早期診斷的標志物。此外,體外實驗表明,MPG過表達可增強ESCC細胞的侵襲能力,而敲低DNMT1同樣可以增強ESCC細胞的侵襲能力,這提示MGP基因啟動子區CpG島甲基化改變可促進ESCC的進展,因此MGP甲基化有望作為ESCC的治療靶點。
綜上所述,MGP在ESCC組織中高表達,MGP表達水平和甲基化水平的改變是調控ESCC進展的關鍵機制之一。本課題組今后將進一步擴大觀察樣本,在體內分析MGP的表達和甲基化水平與ESCC患者生存率的相關性,深入探究MGP對ESCC的調控機制。

