腺苷A3受體激活對腸上皮細胞屏障的調(diào)節(jié)作用及其機制
肖 鵬 呂敏敏 安曉萌 張 霽 司徒偉基 任天華
腸上皮屏障由單層上皮細胞組成,通過緊密連接結(jié)合在一起。緊密連接由ZO-1、Claudins和Occludin等蛋白質(zhì)介導(dǎo),是維持腸上皮細胞屏障所必需的[1]。腸上皮屏障在將腔內(nèi)微生物和抗原分子與內(nèi)環(huán)境隔離的過程中起著至關(guān)重要的作用。腸上皮屏障功能障礙可破壞免疫平衡并誘導(dǎo)炎性反應(yīng),在炎癥性腸病(IBD)的發(fā)病機制中起著重要作用[2]。IBD患者的腸上皮屏障功能發(fā)生障礙,腸道通透性增高,表現(xiàn)為緊密連接受損,緊密連接蛋白表達異常[3]。腸上皮屏障損傷修復(fù)可能是維持IBD患者黏膜愈合的關(guān)鍵[4]。研究表明,腺苷A3受體(A3AR)在IBD患者的腸上皮細胞中表達異常[5-6],并在腸道炎性反應(yīng)中發(fā)揮作用[7-9]。目前關(guān)于A3AR在腸上皮屏障功能中的作用尚未完全闡明。本研究采用體外方法探討A3AR激動劑對腸上皮屏障的作用,以期為改良IBD的治療方案提供新的思路。
1 材料和方法
1.1 材料和儀器
人結(jié)腸上皮細胞系Caco-2細胞購自中國科學(xué)院上海細胞庫;DMEM培養(yǎng)基、非必需氨基酸、胎牛血清、抗ZO-1特異性抗體、Bis-Tris SDS-PAGE蛋白分離凝膠、胞核蛋白提取試劑盒均購自美國Thermo Fisher公司;A3AR激動劑2-Cl-IB-MECA購自英國Tocris公司;重組人TNF-α、磷酸化肌球蛋白輕鏈(p-MLC)、NF-κB p65、GAPDH和抗Histone H3特異性抗體、辣根過氧化物酶(HRP)偶聯(lián)的羊抗兔免疫球蛋白G(IgG)抗體和增強化學(xué)發(fā)光(ECL)液均購自美國Cell Signaling公司;CCK-8試劑盒購自日本Dojindo公司;總蛋白提取試劑盒購自德國Qiagen公司;FITC-葡聚糖(相對分子質(zhì)量為4 000)購自美國Sigma-Aldrich公司;肌球蛋白輕鏈激酶(MLCK)和抗A3AR特異性抗體均購自美國Abcam公司;Alexa Fluor 488偶聯(lián)的驢抗兔IgG抗體購自美國Jackson ImmunoResearch公司;IL-1β和IL-8的ELISA試劑盒購自美國RayBio公司;Transwell嵌入小室(孔徑4.0 μm)購自美國Corning公司;Millicell ERS-2細胞電阻儀購自美國Merck MilliPore公司。
1.2 方法
1.2.1 細胞培養(yǎng)和處理 將Caco-2細胞置于添加了20%胎牛血清、1%非必需氨基酸和1%青霉素/鏈霉素的DMEM培養(yǎng)基中培養(yǎng),培養(yǎng)環(huán)境為37 ℃、5% CO2。將不同濃度的(0、1、10、30、100、300、1 000 nmol/L)A3AR激動劑2-Cl-IB-MECA加入培養(yǎng)基中預(yù)處理細胞30 min,使用TNF-α(100 ng/mL)刺激Caco-2細胞48 h,收集細胞和上清液用于后續(xù)實驗。將經(jīng)DMEM培養(yǎng)基處理的細胞設(shè)為對照組,經(jīng)TNF-α處理的細胞設(shè)為TNF-α組,經(jīng)2-Cl-IB-MECA處理的細胞設(shè)為2-Cl-IB-MECA組。每組實驗重復(fù)6次。
1.2.2 體外腸上皮屏障功能障礙的誘導(dǎo)和檢測 為了探究2-Cl-IB-MECA對腸上皮屏障功能的影響,本研究使用TNF-α作用于Caco-2細胞單層,誘導(dǎo)腸上皮屏障功能障礙,然后分析經(jīng)2-Cl-IB-MECA處理后細胞的跨上皮細胞電阻值(TEER)和細胞旁通透性(FITC-葡聚糖通量)變化。將Caco-2細胞以1×105個/孔的密度接種于Transwell嵌入小室的頂側(cè)室,培養(yǎng)至少2周。使用Millicell ERS-2細胞電阻儀測量TEER,評估細胞單層的完整性,以確保獲得TEER絕對值>500 Ω/cm2的功能性上皮單細胞層,這表明已形成完整的上皮屏障。將100 nmol/L的2-Cl-IB-MECA加入Caco-2細胞單層的頂側(cè)室進行預(yù)處理30 min,然后將100 ng/mL的TNF-α加入Caco-2細胞單層的基側(cè)室進行孵育,以誘導(dǎo)腸上皮屏障功能障礙。TNF-α處理48 h后檢測TEER。隨后,檢測細胞單層的通透性,具體步驟:將1 mg/mL的FITC-葡聚糖加入細胞頂側(cè)室并孵育2 h后,將基側(cè)室溶液收集至96孔板中,使用Synergy H2微板閱讀器在激發(fā)波長490 nm和發(fā)射波長520 nm下分別測定FITC-葡聚糖的濃度,通過計算FITC-葡聚糖從頂側(cè)室到基側(cè)室的轉(zhuǎn)運來測量細胞旁通透性。
1.2.3 CCK-8法測定細胞存活率 采用CCK-8法評估2-Cl-IB-MECA 對Caco-2細胞存活的影響。將Caco-2細胞以5 000個/孔的密度接種于96孔板中,在添加了20%胎牛血清、1%非必需氨基酸的DMEM培養(yǎng)基中培養(yǎng),加入不同濃度的2-Cl-IB-MECA,再孵育48 h。每孔加入新鮮配制的含10 μL毒性檢測液的CCK-8,置于培養(yǎng)箱中繼續(xù)培養(yǎng)4 h后,使用酶標儀檢測波長為450 nm的OD值。
1.2.4 ELISA實驗 按照ELISA試劑盒說明書,測定基底外側(cè)培養(yǎng)液中IL-1β和IL-8的表達水平。
1.2.5 免疫熒光法 采用免疫熒光法檢測ZO-1的表達水平。將培養(yǎng)的Caco-2細胞用4%多聚甲醛固定20 min,用含有0.1% Triton X-100和5%正常驢血清的PBS溶液孵育30 min,加入抗ZO-1抗體于4 ℃孵育過夜,再加入Alexa Fluor 488偶聯(lián)的驢抗兔IgG抗體于室溫避光孵育1 h,最后用含有DAPI和防熒光淬滅的封片劑封片。使用熒光顯微鏡捕獲圖像并進行免疫熒光分析。
1.2.6 蛋白質(zhì)印跡法 采用蛋白質(zhì)印跡法檢測ZO-1、NF-κB p65、MLCK和p-MLC的蛋白表達水平。將Caco-2細胞以1×106個/孔的密度接種于6孔板中,添加100 nmol/L 2-Cl-IB-MECA 預(yù)處理30 min,再用重組人TNF-α(100 ng/mL)分別處理6 h(用于檢測NF-κB p65、MLCK和p-MLC)或48 h(用于檢測ZO-1)。然后將細胞溶解在蛋白提取試劑盒中的裂解緩沖液中,在4 ℃下以離心力15 000 g離心10 min,除去細胞碎片,吸取上清液獲得蛋白樣本。采用BCA蛋白測定法測定蛋白質(zhì)的濃度。每個蛋白樣品取樣30 μg,95 ℃ 5 min變性,在10%梯度的Bis-Tris SDS-PAGE凝膠上分離,轉(zhuǎn)印至PVDF膜上。在4 ℃下與不同的一抗(抗ZO-1、NF-κB p65、MLCK和p-MLC抗體)孵育過夜。以GAPDH作為總蛋白內(nèi)參,以Histone H3作為核蛋白內(nèi)參。用1∶1 000 HRP偶聯(lián)的羊抗兔IgG二抗于室溫孵育1 h。使用ECL液進行顯像。使用Bio-Rad成像系統(tǒng)拍攝蛋白質(zhì)印跡條帶。應(yīng)用Quantity One軟件定量分析蛋白質(zhì)印跡條帶。
1.3 統(tǒng)計學(xué)分析
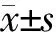
2 結(jié)果
2.1 2-Cl-IB-MECA對Caco-2細胞存活率的影響
CCK-8法檢測結(jié)果指出,各濃度(0、1、10、30、100、300、1 000 nmol/L)2-Cl-IB-MECA組的細胞存活率與對照組相比,差異均無統(tǒng)計學(xué)意義(P均>0.05)。這提示1 000 nmol/L以下濃度的2-Cl-IB-MECA對Caco-2細胞的活性沒有影響。見圖1。
圖1 不同濃度2-Cl-IB-MECA 預(yù)處理后Caco-2細胞的存活率
2.2 2-Cl-IB-MECA對TNF-α誘導(dǎo)的腸上皮屏障功能障礙的影響
如表1所示,與對照組相比,TNF-α組Caco-2細胞單層的TEER顯著降低,F(xiàn)ITC-葡聚糖通量顯著升高,差異均有統(tǒng)計學(xué)意義(P均<0.05)。與TNF-α組相比,30 nmol/L和100 nmol/L 2-Cl-IB-MECA組的TEER均顯著升高,F(xiàn)ITC-葡聚糖通量均顯著降低,差異均有統(tǒng)計學(xué)意義(P均<0.05)。結(jié)果還顯示,隨著2-Cl-IB-MECA濃度升高,上述效應(yīng)也隨之增強。
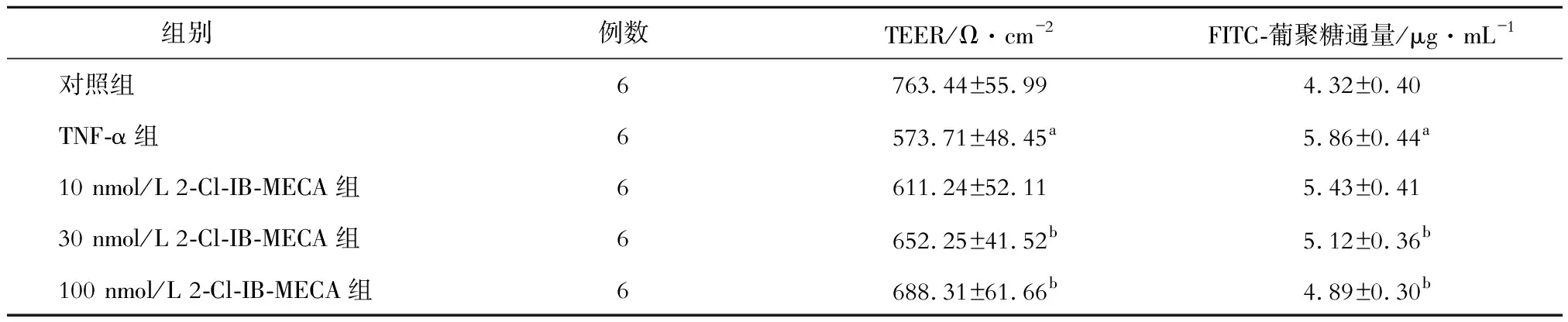
表1 各組TEER和FITC-葡聚糖通量的比較
2.3 2-Cl-IB-MECA 對TNF-α誘導(dǎo)的Caco-2細胞IL-1β和IL-8水平的影響
如表2所示,與對照組相比,TNF-α組的IL-1β和IL-8表達水平均明顯升高,差異均有統(tǒng)計學(xué)意義(P均<0.01)。與TNF-α組相比,100 nmol/L 2-Cl-IB-MECA組(下文簡稱2-Cl-IB-MECA組)的IL-1β和IL-8表達水平均明顯降低,差異均有統(tǒng)計學(xué)意義(P均<0.05)。

表2 各組IL-1β和IL-8表達水平的比較
2.4 2-Cl-IB-MECA對Caco-2細胞ZO-1的表達水平和分布的影響
TNF-α組ZO-1的相對表達量為0.06±0.01,低于對照組(0.17±0.04),差異有統(tǒng)計學(xué)意義(P<0.01)。2-Cl-IB-MECA組ZO-1的相對表達量為0.12±0.02,高于TNF-α組,差異有統(tǒng)計學(xué)意義(P<0.05)。見圖2。
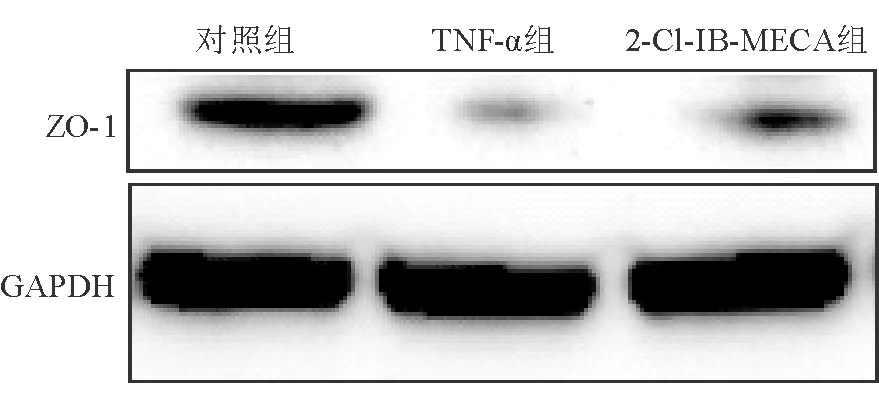
圖2 各組Caco-2細胞ZO-1的蛋白質(zhì)印跡條帶
如圖3所示,對照組的ZO-1沿細胞邊緣定位,呈網(wǎng)格狀分布。經(jīng)TNF-α處理48 h后,ZO-1的分布變得不規(guī)則和不連續(xù)。經(jīng)2-Cl-IB-MECA處理后,ZO-1的破壞情況得到改善。

圖3 各組Caco-2細胞ZO-1的分布 免疫熒光 ×400 A 對照組 B TNF-α組 C 2-Cl-IB-MECA組
2.5 2-Cl-IB-MECA對TNF-α誘導(dǎo)的NF-κB p65、MLCK和p-MLC表達水平的影響
如表3、圖4所示,與對照組相比,TNF-α組NF-κB p65、MLCK和p-MLC的表達水平均顯著升高,差異均有統(tǒng)計學(xué)意義(P均<0.01)。與TNF-α組相比,2-Cl-IB-MECA組NF-κB p65、MLCK和p-MLC的表達水平均顯著降低,差異均有統(tǒng)計學(xué)意義(P均<0.05)。
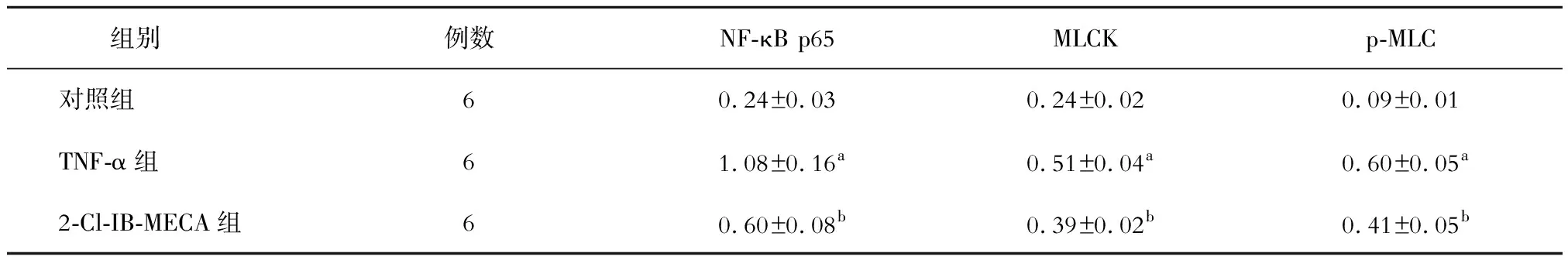
表3 各組NF-κB p65、MLCK和p-MLC相對表達量的比較
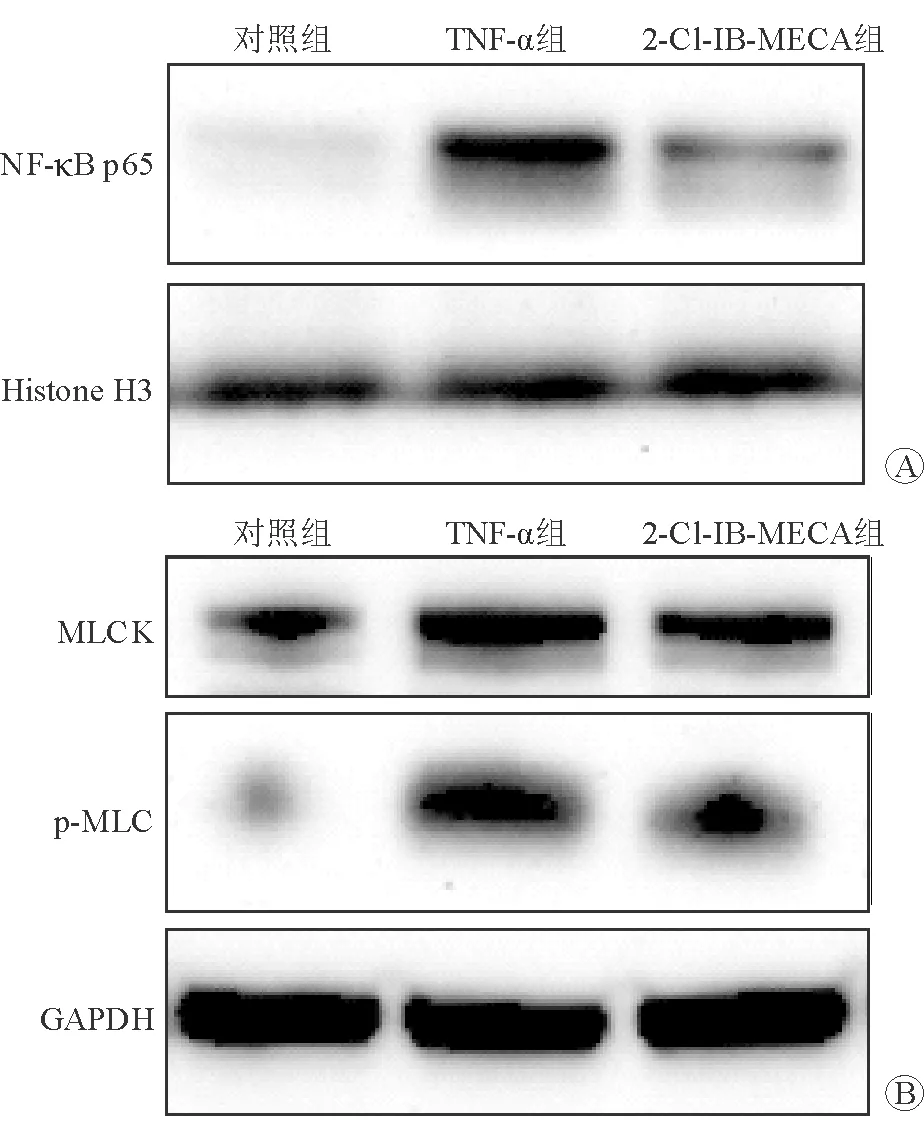
圖4 各組Caco-2細胞NF-κB p65、MLCK和p-MLC的蛋白質(zhì)印跡條帶 A NF-κB p65蛋白 B MLCK和p-MLC蛋白
3 討論
IBD包括潰瘍性結(jié)腸炎和克羅恩病,是一種慢性、復(fù)發(fā)性腸道炎性疾病,腸上皮屏障功能障礙是其重要特征[2]。機體腸上皮屏障功能障礙,緊密連接的破壞在IBD發(fā)病中起重要作用。腸上皮細胞表達緊密連接蛋白,包括ZO-1、Claudins和Occludin等,形成一種天然的腸道屏障,阻止微生物抗原和毒素滲透至黏膜固有層。緊密連接的破壞可導(dǎo)致腸上皮屏障功能障礙[10]。研究表明,IBD患者腸上皮細胞緊密連接的完整性受損,活動期患者結(jié)腸黏膜ZO-1的表達水平較健康對照者顯著降低[11]。TNF-α誘導(dǎo)的緊密連接蛋白表達降低可導(dǎo)致IBD患者腸上皮屏障功能障礙[12]。此外,在體外通過使用TNF-α刺激Caco-2細胞單層來模擬屏障受損,會導(dǎo)致ZO-1表達下調(diào)[11]。本研究構(gòu)建了TNF-α誘導(dǎo)的Caco-2細胞單層屏障損傷模型,結(jié)果發(fā)現(xiàn)TNF-α組的TEER降低,細胞旁通透性增高,ZO-1的表達水平降低且形態(tài)被破壞,這與以往的文獻報道相符[11,13],表明腸上皮屏障損傷模型構(gòu)建成功。
研究表明,A3AR在活動期潰瘍性結(jié)腸炎患者結(jié)腸黏膜上皮細胞中的表達水平降低[5-6],A3AR激動劑2-Cl-IB-MECA在體內(nèi)可減輕小鼠腸道的炎性反應(yīng)[7-8],在體外可抑制人腸上皮細胞的炎性反應(yīng)[9]。本研究結(jié)果發(fā)現(xiàn),2-Cl-IB-MECA可改善TNF-α誘導(dǎo)的Caco-2單層細胞中TEER下降和細胞旁通透性增高情況,同時可以升高ZO-1蛋白的表達水平,改善ZO-1蛋白的分布情況。這提示A3AR的激活可調(diào)節(jié)腸上皮細胞ZO-1的表達,減輕TNF-α誘導(dǎo)的Caco-2單層細胞屏障的損傷。
NF-κB的激活介導(dǎo)了TNF-α誘導(dǎo)的腸上皮細胞緊密連接蛋白表達下調(diào)和腸上皮通透性增高[14],并有助于MLCK的表達上調(diào)[13-14]。研究表明,MLCK可介導(dǎo)肌球蛋白輕鏈(MLC)的磷酸化,在促炎細胞因子誘導(dǎo)的腸上皮屏障破壞中起關(guān)鍵作用[15]。此外,A3AR激動劑可抑制NF-κB信號轉(zhuǎn)導(dǎo)通路表達[9]。本研究結(jié)果顯示,2-Cl-IB-MECA可抑制TNF-α誘導(dǎo)的Caco-2細胞NF-κB p65、MLCK和p-MLC的表達,這提示2-Cl-IB-MECA可能通過抑制NF-κB和MLCK的活化,以及隨后的MLC磷酸化來減輕TNF-α誘導(dǎo)的Caco-2細胞單層屏障功能障礙。
在腸道炎性反應(yīng)的發(fā)生、發(fā)展過程中,NF-κB的激活參與了IL-6等促炎細胞因子信號通路表達,導(dǎo)致腸上皮屏障的完整性受損,黏膜免疫應(yīng)答增強[16]。本研究結(jié)果表明,2-Cl-IB-MECA可抑制促炎細胞因子IL-1β和IL-8的分泌。這提示A3AR激活可能通過抑制促炎細胞因子的分泌,從而調(diào)節(jié)IBD的發(fā)生和發(fā)展。一項結(jié)腸炎小鼠模型研究結(jié)果指出,A3AR激動劑可減輕結(jié)腸黏膜組織的炎性反應(yīng),降低促炎細胞因子的表達水平,從而抑制結(jié)腸炎的發(fā)展[7],這與本研究的結(jié)論相符。
綜上所述,A3AR激活可調(diào)節(jié)TNF-α誘導(dǎo)的Caco-2細胞單層的緊密連接蛋白的表達和分布,改善腸上皮屏障功能障礙,其分子機制可能是通過抑制NF-κB/MLCK/p-MLC信號通路的表達。A3AR對腸道屏障功能的作用機制值得進一步研究,A3AR可能為IBD的治療提供新的途徑。

