乳酸菌在腸道定植的影響因素及研究方法
秦文飛,宋 馨,夏永軍,艾連中,王光強(qiáng)
(上海理工大學(xué)健康科學(xué)與工程學(xué)院,上海食品微生物工程技術(shù)研究中心,上海 200093)
聯(lián)合國糧食及農(nóng)業(yè)組織和世界衛(wèi)生組織聯(lián)合專家將益生菌定義為:當(dāng)給予宿主足夠數(shù)量的活微生物時,對宿主的健康有益[1]。乳酸菌是以發(fā)酵碳水化合物產(chǎn)生大量乳酸的細(xì)菌的總稱,其作為益生菌家族中最重要的菌株之一,在參與調(diào)節(jié)腸道菌群平衡、參與免疫應(yīng)答和抑制腸道病原菌的生長繁殖等多種益生功能中發(fā)揮重要的作用[2-3]。而在人體內(nèi)乳酸菌數(shù)量和種類最豐富的地方是消化道,并且乳酸菌的種類和數(shù)量也因消化道部位不同而有較大差異[4],其中在胃中的乳酸菌數(shù)量較少,主要是由于胃酸能將部分乳酸菌殺死,而在盲腸和結(jié)腸中乳酸菌的數(shù)量最多,能達(dá)到106~1010CFU/g。
在通常情況下,乳酸菌經(jīng)口服進(jìn)入體內(nèi)后大部分將隨著胃腸道的蠕動排出體外,只有少部分定植于腸道中[5]。而定植于腸道中是乳酸菌持續(xù)發(fā)揮其益生作用的前提,但是乳酸菌的定植能力會因種類的不同而存在差異,一般來說,對乳酸菌體內(nèi)定植能力的評價通常是從定植于體內(nèi)的數(shù)量和位點兩方面進(jìn)行,首先要求乳酸菌對胃酸、膽鹽有一定的耐受能力,保證菌株到達(dá)定植位點時有較高活性和增殖能力。并且乳酸菌只有在定植位點達(dá)到一定的數(shù)量,才可能成為局部優(yōu)勢菌且在局部微環(huán)境起到調(diào)節(jié)腸道菌群作用并發(fā)揮其功能[6-7]。另外,乳酸菌在宿主腸道中的定植豐度也會影響到宿主的健康水平[8]。
乳酸菌腸道定植帶給宿主的諸多有益作用(如緩解便秘[9]、降低膽固醇[10]、減輕性結(jié)腸炎[11]及降低血糖[12]等)吸引眾多研究學(xué)者對其在腸道定植的機(jī)制進(jìn)行探究,旨在更加透徹地梳理其在宿主腸道內(nèi)進(jìn)行定植的過程,闡明乳酸菌在腸道定植的機(jī)制,輔助乳酸菌在實際應(yīng)用中更好地在腸道中定植,進(jìn)而持續(xù)發(fā)揮其特殊的益生功能。但是到目前為止,對乳酸菌在腸道定植的機(jī)制鮮有詳盡的闡述,其主要原因可能是復(fù)雜的腸道環(huán)境中存在較多的干擾因素,并且評估乳酸菌在腸道定植能力的方法還存在一定的局限性,難以精確地反映其與腸道之間發(fā)生的相互作用。本文綜述近年來報道的乳酸菌腸道定植的影響因素,并針對腸道菌群的復(fù)雜多樣性總結(jié)多種乳酸菌腸道定植的研究方法、定植模型及評估方法一系列關(guān)鍵技術(shù),為進(jìn)一步闡明乳酸菌的腸道定植機(jī)制提供參考。
1 乳酸菌定植的影響因素
乳酸菌在宿主腸道中持久發(fā)揮生理功能的前提是必須能在宿主腸黏膜上皮細(xì)胞中發(fā)生黏附并進(jìn)一步定植,在腸道中某個部位逐漸能形成穩(wěn)定的菌群。但是在復(fù)雜的腸道中,影響乳酸菌在宿主腸道定植的因素并不少,概括起來包括內(nèi)因和外因。內(nèi)因主要指菌體自身的一些理化特性,比如菌株黏附能力、自身的運動性、乳酸的分泌以及自身的增殖能力等。外因主要指環(huán)境狀態(tài),比如宿主基因及體征因素、腸道菌群、胃酸和膽鹽的耐受性、飲食等。
1.1 黏附能力
乳酸菌的各種表面成分介導(dǎo)了乳酸菌與其環(huán)境的接觸和相互作用,形成各菌株獨特的表面特性,對其在腸道生存有著至關(guān)重要的作用[13]。而乳酸菌對腸道上皮細(xì)胞的黏附是其表面成分介導(dǎo)形成的一種物理表觀現(xiàn)象,有助于其在腸道定植、增強(qiáng)乳酸菌與腸道細(xì)胞之間的信號交流、抑制病原菌在腸道的定植和提高機(jī)體的免疫力等作用[14-15]。黏附通常認(rèn)為是定植的關(guān)鍵步驟[16]。目前的研究發(fā)現(xiàn),與黏附作用相關(guān)的主要是黏附素(如脂磷壁酸、S-層蛋白、脂多糖、肽聚糖等)的分泌及其與黏附素受體結(jié)合,而這些與乳酸菌自身表面的疏水性、自聚性、共聚性以及環(huán)境中的溫度、pH值和離子濃度等因素密切相關(guān)。
表面疏水性是一個理化概念,特指表面具有非極性成分的細(xì)菌在具有極性性質(zhì)的水中所表現(xiàn)出的非穩(wěn)態(tài),從而引起非穩(wěn)態(tài)體系中的熱能和分子的重新排列。乳酸菌表面疏水性作為其細(xì)胞表面的一種普遍特性,是與宿主細(xì)胞之間的非特異性相互作用,是影響菌株黏附性的內(nèi)在因素,近年來被用來作為評價乳酸菌黏附性能的一個重要參數(shù)[13]。Todorov等[17]在評估乳酸菌益生特性的實驗中,得出鼠李糖乳桿菌GG疏水性約為55%,約32%的菌株可以黏附于HT-29細(xì)胞;而戊糖乳桿菌ST712BZ疏水性較低(38%),但卻有63%的菌株能黏附在HT-29細(xì)胞上。實驗結(jié)果表明,菌株表面疏水性與HT-29細(xì)胞的黏附率呈負(fù)相關(guān)。但楊振泉等[18]的研究結(jié)果卻表明,戊糖片球菌的表面疏水性與Caco-2細(xì)胞黏附率呈顯著正相關(guān)。實驗結(jié)果的不同可能與乳酸菌菌株種類、黏附細(xì)胞種類以及實驗方法等因素有關(guān)。另外,菌株疏水性受乳酸菌表面蛋白、脂磷壁酸等因子的調(diào)節(jié)。并且表面疏水性作為間接評價黏附性的方法,只起到輔助判斷的作用,應(yīng)結(jié)合其他模型同時使用[19]。
乳酸菌的聚集能力(自聚性和共聚性)作為促進(jìn)其益生效應(yīng)的方式之一,Gupta等[20]認(rèn)為一株良好的益生菌的自聚集比例最小約為40%。也有研究表明益生菌的自聚性能可能影響其對腸上皮細(xì)胞和黏膜表面的黏附能力[21]。Kumar等[22]將乳酸片球菌NCDC 252在不同條件(溫度、重懸液)下檢測其自聚性,結(jié)果均表現(xiàn)出90%以上的聚集,在黏附實驗中,乳酸片球菌NCDC 252對豬腸道上皮細(xì)胞有較強(qiáng)的黏附能力,表明該菌株的自聚性與黏附性存在正相關(guān)性,并預(yù)測其在人和動物腸道可能存在定植潛能。這一結(jié)論與宋雨心等[23]的研究結(jié)果一致,即自聚集能力強(qiáng)的乳酸菌往往與腸道上皮細(xì)胞有較強(qiáng)的黏附性,并且他們認(rèn)為乳酸菌自聚集能力可以作為篩選其黏附特性的首要指標(biāo)。另一方面,乳酸菌的自聚作用不僅可以形成生物膜屏障,還可以阻止致病菌的侵入和感染。在乳酸菌共聚性方面,許文杰等[24]認(rèn)為乳酸菌與致病菌的共聚性能力越高,與細(xì)胞的黏附率就越高。其對10 株乳桿菌與致病菌的共聚性以及與Caco-2細(xì)胞的黏附率進(jìn)行測定,結(jié)果發(fā)現(xiàn)菌株C88與金黃色葡萄球菌和沙門氏菌有很高的共聚力(40.03%和34.09%),與Caco-2細(xì)胞的黏附率也達(dá)到約500個細(xì)菌/100個細(xì)胞,并且菌株C88的共聚力和自聚力存在一定的相關(guān)性。這在García-Cayuela等[25]的研究中得到證實,他們發(fā)現(xiàn)乳酸菌的自聚性和共聚性存在正相關(guān)性。另外,具有與其他細(xì)菌(如病原體)共聚的能力可能使其比非共聚性生物體具有定植優(yōu)勢,因為后者更容易從腸道環(huán)境中清除。
另外,pH值和鈣離子濃度也影響著乳酸菌在宿主腸道中的黏附。外部環(huán)境pH值的變化對乳酸菌的黏附存在較大的影響,在酸性環(huán)境更有利于乳酸菌的黏附[26]。Bergonzelli等[27]研究發(fā)現(xiàn),乳酸菌在pH 5.0時與Caco-2細(xì)胞有較強(qiáng)的黏附能力,但是在pH 7.0時幾乎不發(fā)生黏附,表明乳酸菌的黏附存在pH值依賴性。另外,Larsena等[28]向乳酸的生長環(huán)境菌中添加鈣離子,結(jié)果顯示,植物乳桿菌Q47、約氏乳桿菌NCC533和羅伊氏乳桿菌DSM12246等黏附能力明顯提升,鈣離子能促進(jìn)黏附可能是因為激活了鈣離子介導(dǎo)的信號通路,從而促進(jìn)細(xì)菌與細(xì)胞表面受體間的特異性結(jié)合[4]。另外,蔣建軍等[29]通過改變鈣離子濃度發(fā)現(xiàn),鈣離子濃度為2 mmol/L時豬小腸黏膜上皮細(xì)胞黏附乳酸桿菌數(shù)量最多,表明鈣離子濃度也影響乳酸桿菌對豬小腸黏膜上皮細(xì)胞的黏附率。
1.2 乳酸菌的運動性
乳酸菌在自然界中種類很多,分布極廣。但是絕大多數(shù)的乳酸菌并不具備運動的能力[30]。而宿主是通過胃腸道的蠕動輸送物質(zhì),在這種環(huán)境下,乳酸菌在胃腸道的時間以及菌株本身的運動性會影響乳酸菌在腸道中的滯留時間。Kajikawa等[31]從雞糞便中分離得到一株敏捷乳桿菌BKN88,通過對motB基因的突變構(gòu)建了一株有鞭毛但不能運動的敏捷乳桿菌BKN134,在無菌小鼠模型中,野生型BKN88和突變型BKN134在糞便標(biāo)本中的數(shù)量均穩(wěn)定維持在1010CFU/g,二者并沒有差異;但是在小腸局部取樣計數(shù)時,發(fā)現(xiàn)回腸黏膜中野生型BKN88數(shù)量比突變型BKN134高出約10 倍。另外,在體外實驗中,具有運動性的菌株BKN88易與黏蛋白發(fā)生黏連,模擬黏液層穿透實驗表明,運動的菌株更易穿透黏液層,表明具有運動性的敏捷乳桿菌更容易在黏液層占據(jù)生態(tài)位,有利于自身進(jìn)一步增殖,并在腸道中滯留時間會有延長。任世英等[32]從泡菜中篩選出一株具有運動性的鼠李糖乳桿菌屬A5,該菌株有較廣的抑菌譜,對酸有良好的耐受性,表明該菌株可能在腸道中有較好的定植潛能。
1.3 乳酸的分泌
乳酸是一種弱有機(jī)酸,是乳酸菌自身的一種代謝產(chǎn)物,在生長繁殖過程中,它可將90%的代謝糖轉(zhuǎn)化為乳酸,對自身周圍的微環(huán)境產(chǎn)生影響[33]。Wu Chongde等[34]通過在培養(yǎng)基中添加乳酸改變培養(yǎng)基中的pH值,在初始pH值為6.5時,干酪乳桿菌Zhang(CGMCC No. 1697)及其耐酸性突變菌株(CCTCC No. M2010292)的生物量并沒有差異,但是隨著pH值降低到4.3時,野生型菌株的生長受到嚴(yán)重的抑制,比突變型菌株的生物量少了57%。當(dāng)pH值調(diào)整到3.3時,7 h后,只有不到0.01%的野生型菌株存活,而突變體的存活率超過10%。但是也有研究表明,可以通過添加血紅素和醌類物質(zhì)使乳酸菌進(jìn)行有氧呼吸,改變代謝途徑,減少乳酸的積累[35-36]。乳酸菌通過利用外源血紅素進(jìn)行有氧呼吸,其在有氧條件下生物量提高,產(chǎn)酸量減少,菌體活力顯著提高。另外,Hall[37]、Mao Ning[38]等的研究表明乳酸菌產(chǎn)生的乳酸能夠改變小鼠腸道中的pH值,從而顯著抑制霍亂弧菌在腸道中的定植。
1.4 與腸道菌群的作用
乳酸菌能同腸道病原菌爭奪營養(yǎng)物質(zhì),從而讓病原菌因缺營養(yǎng)而無法生長;另外,乳酸菌還與腸道中的細(xì)菌協(xié)同作用,促進(jìn)其在腸道中的定植;它還能通過分泌細(xì)菌素、雙乙酰、乳酸等物質(zhì)對部分細(xì)菌的生長繁殖產(chǎn)生抑制作用,促使腸道菌群達(dá)到平衡,也對致病菌的生長和毒素的黏附具有一定的拮抗作用[39]。Kingamkono等[40]利用植物乳桿菌299 V對米粥進(jìn)行發(fā)酵,讓健康兒童以每天1 次、一周3 次的頻率食用,并在第7天、第13天等時間點分別對實驗組和對照組宿主腸道里的病原菌進(jìn)行檢測,發(fā)現(xiàn)與對照組相比,食用發(fā)酵米粥的兒童腸道中總致病菌明顯減少。Lash等[41]對植物乳桿菌ATCC801進(jìn)行了研究,發(fā)現(xiàn)該菌株可以抑制大多數(shù)革蘭氏陽性菌和革蘭氏陰性菌的生長,該植物乳桿菌分泌的細(xì)胞素對金黃色葡萄球菌、綠膿桿菌和大腸桿菌的生長具有抑制作用。舒中玉等[42]研究也發(fā)現(xiàn)羅伊氏乳桿菌能夠提高腸道菌群豐度,改變腸道菌群結(jié)構(gòu)。但是腸道微生物群非常復(fù)雜,個體之間差異很大,想要完全了解腸道菌群與乳酸菌之間的作用并不是很容易,還需要更加深入的探究。
1.5 宿主基因與體征因素
宿主基因型和體征因素(性別、年齡、疾病與健康等)會影響乳酸菌在腸道中的定植。郭飛翔等[43]通過不同培養(yǎng)基對巴馬人群來源的乳酸菌菌群數(shù)量進(jìn)行分離比較,發(fā)現(xiàn)分離的桿菌數(shù)要多于球菌數(shù),女性腸道乳酸菌總數(shù)略高于男性,青少年組的腸道中乳酸菌數(shù)量最多,隨著年齡的增長,乳酸菌的數(shù)量逐漸減少,但是長壽組中的乳酸菌數(shù)量還保持在一個很高的水平。另外,徐鳳等[44]對2 月齡斷奶羔羊、8 月齡和2 歲山羊瘤胃及回腸黏膜刮取物中的乳酸菌進(jìn)行了分離,隨著山羊年齡的增加,分離到的乳酸菌種類逐漸增多。
另外,在沒有大的干擾的情況下,宿主腸道內(nèi)的菌群在一段時間內(nèi)大多是穩(wěn)定的。但抗生素等藥物的服用以及食物不耐受、吸收不良和瀉藥等引起的腹瀉已被證明能迅速(但通常是短暫的)降低宿主腸道菌群豐富度[45-46]。Tropini等[46]以6~12 周齡的小鼠為模型宿主,通過在飲用水中添加體積分?jǐn)?shù)15%聚乙二醇誘發(fā)小鼠產(chǎn)生輕度滲透性腹瀉,結(jié)果表明,聚乙二醇處理會導(dǎo)致小鼠腸道菌群多樣性下降,顯著地改變微生物群落。Cabral等[47]采用4 周齡雌性C57BL/6J小鼠為宿主模型,用阿莫西林、環(huán)丙沙星或鹽酸多西環(huán)素添加至飲用水中,與對照組相比,阿莫西林顯著降低除擬桿菌門等之外的幾乎所有物種的相對豐度。相反,鹽酸多西環(huán)素和環(huán)丙沙星都降低了幾種擬桿菌門的相對豐度,同時增加了厚壁菌門相對豐度。以上研究中雖并沒有在目科屬水平上進(jìn)行進(jìn)一步的豐度測定,但是乳酸菌廣泛存在于宿主腸道中,且其屬于厚壁菌門,在抗生素服用以及腹瀉的條件下可能會影響其在腸道中的定植。
1.6 胃酸和膽鹽的耐受性
乳酸菌在腸道中定植的首要條件是對胃酸和小腸膽鹽具有一定的耐受性,因為人體胃酸環(huán)境(pH 3)和小腸高膽鹽環(huán)境(膽鹽質(zhì)量分?jǐn)?shù)0.1%~0.3%)[48]會殺死部分的乳酸菌或?qū)ζ浠钚援a(chǎn)生抑制作用,乳酸菌以較高數(shù)量和活性到達(dá)小腸中有利于其在腸道中的黏附定植。然而乳酸菌的個體差異性對酸和膽鹽的耐受性存在差異。Liong等[49]對比了11 株乳酸菌對酸、膽鹽的耐受性,在耐酸實驗中嗜酸乳桿菌ATCC 4962、干酪乳桿菌ASCC290和干酪乳桿菌ASCC292在pH 2.0下培養(yǎng)2 h后其數(shù)量超過107CFU/mL,表現(xiàn)出較強(qiáng)的耐酸能力。而干酪乳桿菌ASCC1520、干酪乳桿菌ASCC1521、干酪乳桿菌 ASCC279、干酪乳桿菌ATCC 15820、干酪乳桿菌 CSCC2607對酸較敏感,培養(yǎng)2 h后數(shù)量僅存104CFU/mL。在膽鹽實驗中,嗜酸乳桿菌ATCC 4356在有膽鹽(牛膽汁和膽酸)和無膽鹽的情況下生長沒有表現(xiàn)出顯著差異,而干酪乳桿菌ASCC 290在有牛膽汁的情況下生長受到抑制。
目前,通過包埋的方式有望解決這些影響菌株在腸道成功定植的問題。Anselmo等[50]通過采用殼聚糖和海藻酸鈉對菌株進(jìn)行逐層包封,使其菌株在通過胃腸道時減少損傷,同時包埋材料的使用也會影響菌株對腸道的黏附。Ding等[51]將鼠李乳桿菌、長雙歧桿菌、唾液乳桿菌、植物乳桿菌、嗜酸乳桿菌、副干酪乳桿菌、乳酸乳桿菌型Bl-O4和Bi-07型乳酸乳桿菌8 種益生菌采用藻酸鹽進(jìn)行微膠囊化處理。結(jié)果表明,微膠囊化提高了菌株在酸性條件、膽鹽作用下的存活率。另外,Watson等[52]通過生物技術(shù)手段在乳酸菌中克隆和表達(dá)Bile基因,在質(zhì)量分?jǐn)?shù)1%豬膽汁的耐受性實驗中,工程乳酸菌比野生型菌株的生物量高出約316 倍,在小鼠胃腸道中的存活率(在糞便測定)也顯著得到提高。
1.7 飲食
飲食被認(rèn)為是能調(diào)節(jié)胃腸道菌群組成和代謝活動重要的環(huán)境因素之一,是影響腸道菌群的主要因素。Shepherd等[53]將卵形擬桿菌NB001以細(xì)菌菌落總數(shù)約為108CFU喂食小鼠,平衡7 d后喂食紫菜多糖。NB001菌株在腸道中的豐度得到顯著增長(4~6個數(shù)量級),并可通過調(diào)節(jié)紫菜多糖的含量調(diào)節(jié)菌株在小鼠腸道中的豐度。另外,Sonnenburg等[54]在飼糧中添加菊粉后喂食老鼠,在飼糧變化前后,糞便總細(xì)菌密度并沒有顯著差異,在改變以菊粉為基礎(chǔ)的飼糧后,多形擬桿菌的相對豐度從第6天的(74±3)%增加到第21天的(84±5)%,表明菊粉能夠促進(jìn)擬桿菌在腸道中增殖。
2 乳酸菌腸道定植的研究方法
乳酸菌的益生功效通常是特定菌株產(chǎn)生的,而很大程度上腸道定植能力決定了其益生功效的高低。因此,在非常復(fù)雜的腸道微生物群中追蹤單一菌株非常重要,必須采用特定的方法在菌株水平進(jìn)行識別,以便檢測胃腸道中特定乳酸菌的定植和豐度,這對于菌株整體功能性的評價、篩選以及工業(yè)應(yīng)用具有重要的意義。目前,對乳酸菌菌株在腸道定植能力的評估,一般采用體外模擬實驗和體內(nèi)實驗(圖1)。
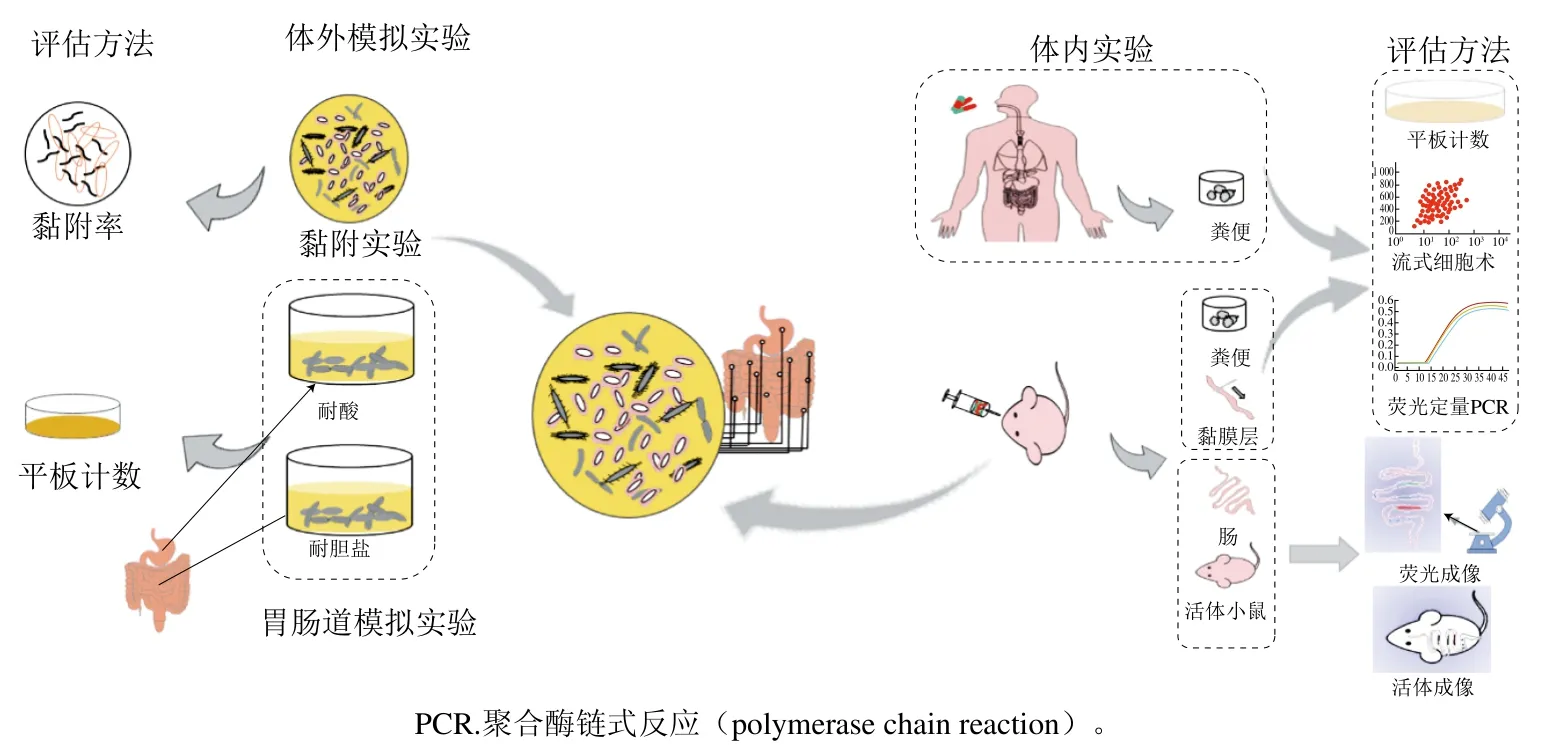
圖1 乳酸菌定植能力評估流程Fig. 1 Flowchart for the evaluation of LAB colonization ability
在體外模型選擇中主要是考慮乳酸菌的黏附能力,因為黏附通常被認(rèn)為是定植的關(guān)鍵一步[16],近年來很多研究者將其作為評估其菌腸道定植的一個關(guān)鍵指標(biāo),常用的有Caco-2、HT-29及HT-29 MXT細(xì)胞等細(xì)胞系建立的模型[55-57],可以模擬宿主細(xì)胞與微生物的直接接觸,并對其黏附率進(jìn)行測定。大量的研究證實,體外細(xì)胞模型能夠簡單、快速、直觀有效地檢測益生菌的黏附能力[58-59]。而活體實驗主要是以小鼠、人體等作為實驗對象。對人體主要是采用收集糞便的方式進(jìn)行分析,而對小鼠可采用取糞便、活體成像以及對活體腸道黏液層取樣分析進(jìn)行判定。但是,體外模型通常沒有考慮活體宿主的先天免疫反應(yīng)和腸道微生物群落[60]。因此,體外模型并不能可靠地預(yù)測菌株在復(fù)雜的活體內(nèi)的真實情況[61];并且對于其腸道黏附能力的檢測尚未建立精確、經(jīng)濟(jì)高效、省時省力的理想模型。而活體實驗雖能更能體現(xiàn)菌株在宿主腸道中的定植情況,但是如何能精確地判定乳酸菌在宿主中的定植情況,還存在很大的挑戰(zhàn),需要開發(fā)更加快速方法且可靠的工具來鑒別和量化[62],并由此來對乳酸菌進(jìn)入宿主腸道后的定植情況進(jìn)行評估。
2.1 平板計數(shù)法
平板計數(shù)作為傳統(tǒng)對腸道分離物或糞便進(jìn)行培養(yǎng)計數(shù)的方法,一般采用兩種方式。一是通過不同的培養(yǎng)基進(jìn)行微生物的分離選擇;二是通過在培養(yǎng)基中添加抗生素對特定的菌株進(jìn)行選擇性培養(yǎng)。Lee等[63]將擬桿菌引入無菌小鼠,并通過平板計數(shù)法評估其在腸道中的定植能力。Kajikawa等[31]對野生型和突變菌株經(jīng)抗生素(鏈霉素)處理后在雌性Balb/c小鼠的定植進(jìn)行了評估。實驗通過收集小腸和盲腸的標(biāo)本,采用粗略分批灌洗法對小腸局部黏液層進(jìn)行沖洗并對乳桿菌進(jìn)行計數(shù)。但此方法獲得的實驗結(jié)果常常準(zhǔn)確性并不高,而且操作繁瑣。但它仍然是用來了解腸道微生態(tài)菌群組成與作用最重要的方法。
平板計數(shù)技術(shù)是衡量細(xì)胞生存能力的標(biāo)準(zhǔn)方法,但并不能實時獲得檢測結(jié)果。對于腸道菌群構(gòu)成復(fù)雜性和樣本在處理過程中較多的干擾因素,有些腸道微生物不能在體外進(jìn)行培養(yǎng),且平板計數(shù)的實驗結(jié)果重現(xiàn)性差,因此選擇能替代平板計數(shù)法且特異性好、準(zhǔn)確性較高的檢測方法顯得尤為重要。
2.2 熒光標(biāo)記法
熒光標(biāo)記依靠熒光物物質(zhì)對菌株進(jìn)行標(biāo)記或者通過將熒光基因?qū)刖昊蛑校蛊湓谒拗髦斜磉_(dá)熒光物質(zhì),有利于實現(xiàn)對菌株在腸道中定植位點和繁殖速度進(jìn)行監(jiān)測,并采用流式細(xì)胞儀、熒光成像儀或熒光顯微鏡等儀器進(jìn)行分析。
2.2.1 熒光物質(zhì)標(biāo)記
目前,大多數(shù)的細(xì)菌還不能進(jìn)行基因操作,無法實現(xiàn)基因標(biāo)記,而熒光物質(zhì)標(biāo)記因操作相對簡單而被用于細(xì)菌標(biāo)記。羥基熒光素二醋酸鹽琥珀酰亞胺脂(carboxyfluorescein diacetate, succinimidyl ester,cFDA-SE)是一種對活細(xì)胞進(jìn)行熒光標(biāo)記的細(xì)胞染色試劑,它可以透過細(xì)胞膜,進(jìn)入細(xì)胞后可以偶發(fā)性地并不可逆地和細(xì)胞內(nèi)蛋白的賴氨酸殘基或其他氨基發(fā)生結(jié)合反應(yīng),并標(biāo)記這些蛋白,由于cFDA-SE標(biāo)記細(xì)胞的熒光非常均勻和穩(wěn)定,每分裂一次,子代細(xì)胞的熒光會減弱一半,因此可以通過檢測其熒光強(qiáng)度對菌株的傳代速度進(jìn)行實時監(jiān)測分析[64-65]。Lee等[66]以BALB/c老鼠為實驗對象,采用細(xì)胞增殖示蹤熒光探針cFDA-SE對干酪乳桿菌在小腸的定植潛力進(jìn)行探究,并用流式細(xì)胞儀對干酪乳桿菌在腸道不同部位的倍增時間進(jìn)行測定。Fogliano等[67]將可可中不溶于水的組分體外消化酶解后添加到體外結(jié)腸模型中,并采用熒光原位雜交技術(shù)對模型中的細(xì)菌進(jìn)行計數(shù),結(jié)果乳酸桿菌數(shù)量顯著增加。劉倩等[68]采用異硫氰酸熒光素標(biāo)記鼠李糖乳桿菌P15和干酪乳桿菌,并刮取牙鲆的胃、盲囊和前腸的黏液進(jìn)行實驗,在熒光顯微鏡下用血球計數(shù)板計數(shù)黏附的乳酸菌個數(shù),發(fā)現(xiàn)在盲囊和腸道中干酪乳桿菌的黏附率顯著高于鼠李糖乳桿菌P15,但兩者對胃的黏附差異無顯著性。采用熒光物質(zhì)標(biāo)記的不足之處是標(biāo)記效率并不高,還可能會改變細(xì)菌的表面性質(zhì),從而影響到其他性質(zhì)測定的準(zhǔn)確性[19]。
2.2.2 熒光基因標(biāo)記
盡管熒光染料的種類繁多,但采用熒光物質(zhì)標(biāo)記常常會出現(xiàn)光信號丟失,造成假陰性的結(jié)果,且成像效果易受體內(nèi)生物分子的影響,所用的熒光物質(zhì)存在一定的安全隱患。因此開發(fā)其他的標(biāo)記方法就顯得更加重要了。van Zyl等[69]通過同源重組將編碼紅色熒光蛋白的mCherry基因整合到植物乳桿菌423基因組的非功能區(qū)。mCherry基因的表達(dá)并沒有改變植物乳桿菌423的生長速度,對細(xì)菌素的產(chǎn)生也沒有影響,通過動物實驗在體外對小鼠腸道進(jìn)行熒光活體成像,確定植物乳桿菌423在小鼠的盲腸和結(jié)腸中發(fā)生定植。北婷婷[70]利用紅色熒光蛋白dsred2(具有熒光強(qiáng)度高、檢測方便等優(yōu)點)標(biāo)記鼠李糖乳桿菌05-28,然后將其灌胃小鼠,取小鼠各腸道制作石蠟切片,利用熒光顯微鏡觀察重組菌株在小鼠腸道黏附情況。發(fā)現(xiàn)在3 h后小鼠腸道各部位均能檢測到重組菌株,4 d后達(dá)到定植的高峰,第15天小鼠各腸道均未檢測到重組菌株,表明該菌株在腸道中的定植偏好順序依次為回腸、結(jié)腸、空腸、十二指腸。另外,董浩等[71]以綠色熒光蛋白為報告基因應(yīng)用于示蹤重組乳酸乳球菌在小鼠體內(nèi)的位點,采用熒光顯微鏡鏡檢發(fā)現(xiàn)小鼠胃腸道都存在一定數(shù)量的重組乳酸乳球菌。
為解決同源菌種在腸道定植問題,Whitaker等[72]將綠色熒光基因和紅色熒光基因(對照)導(dǎo)入擬桿菌VPI-5482中,并將其灌喂小鼠,進(jìn)行熒光成像分析。當(dāng)同時定植時,對近端結(jié)腸的管腔和隱窩的成像結(jié)果顯示,兩株菌在兩個位置的豐度大致相同,然而,當(dāng)先對小鼠進(jìn)行7 d灌喂表達(dá)紅色熒光基因的擬桿菌VPI-5482后,再對其引入表達(dá)綠色熒光基因的擬桿菌VPI-5482,僅在24 h后管腔內(nèi)表達(dá)綠色熒光基因的擬桿菌VPI-5482的水平就顯著降低,而且這種變化在官腔隱窩處的定植中更為顯著。Shephsed等[53]利用帶有紅色熒光基因的野生型多形擬桿菌對小鼠進(jìn)行喂食,7 d后,用綠色熒光蛋白標(biāo)記并攜帶有21個利用海藻多糖基因的多形擬桿菌進(jìn)行喂食,當(dāng)飲食中不加入海藻多糖,帶綠色熒光基因的菌株不能夠成功定植;加入海藻多糖后,帶綠色熒光基因菌株能夠定植在結(jié)腸。
2.3 聚合酶鏈?zhǔn)椒磻?yīng)
在復(fù)雜的腸道菌群中,采用熒光物質(zhì)和熒光標(biāo)記菌株的效果會受到熒光信號強(qiáng)弱、熒光穩(wěn)定性以及是否需要外源激發(fā)光等的影響。而采用PCR和實時熒光定量PCR(real-time quantitative PCR,qPCR)能對其進(jìn)行定量分析,并且具有耗時短、結(jié)果準(zhǔn)確性高等特點。但這兩種方法對于實驗菌株中存在的特異性DNA片段的選擇要求較嚴(yán)格,并且需要通過對該片段進(jìn)行引物設(shè)計,才能在菌株水平上對其進(jìn)行準(zhǔn)確的定性定量分析。Nation等[73]利用qPCR技術(shù),通過特異性基因(tuf)引物對嬰兒糞便中的羅伊氏乳桿菌進(jìn)行定量分析。這種方法在陸文偉等[74]的研究中也得到了應(yīng)用,他們將副干酪乳桿菌LC01灌胃老鼠,采用副干酪乳桿菌種屬特異性引物對老鼠糞便進(jìn)行qPCR,結(jié)果發(fā)現(xiàn)菌株并不能長期定植在小鼠腸道中,但可在一段時間內(nèi)調(diào)節(jié)腸道菌群,從而改善小鼠腸道健康。在Treven等[75]的實驗中則是從14 對加氏乳桿菌K7分泌的加氏細(xì)菌素K7 A和K7 B決定基因簇的特異性引物中篩選出一對針對K7 A和K7 B總基因簇具有特異性的引物,并以人為實驗對象,收集糞便,采用qPCR對人糞便標(biāo)本中的加氏乳桿菌K7進(jìn)行定量分析。
另外,在乳酸菌鑒定和對多態(tài)性分析中隨機(jī)擴(kuò)增多態(tài)DNA(random amplified polymorphic DNA,RAPD)的應(yīng)用較廣泛,能在菌株水平對乳酸菌進(jìn)行鑒別。Fujimoto等[76]以人體為實驗對象,利用RAPD分析得到干酪乳桿菌特異性引物,并采用qPCR和4’,6-二氨基-2-苯基吲哚染色對人體糞便中干酪乳桿菌進(jìn)行鑒定和量化,由此對干酪乳桿菌被攝入后在人體腸道中的增殖能力進(jìn)行探究。重復(fù)序列PCR(repetitive sequence-based PCR,rep-PCR)能將乳酸菌鑒定到種和菌株的水平。黃麗麗等[77]初步采用16S rRNA基因序列確定冷水魚腸道中乳酸菌的系統(tǒng)發(fā)育關(guān)系,并通過rep-PCR指紋圖譜技術(shù)進(jìn)一步區(qū)分高度同源性菌株。隨著下一代測序技術(shù)的出現(xiàn)和基因組數(shù)據(jù)量的增加,對于生物信息學(xué)工具的開發(fā)需求日益增長,目前有很多工具可以進(jìn)行泛基因組分析[78],如PGAP(pan-genome analysis pipeline)、Pan-seq(pan-genome sequence analysis program)以及PGAT(prokaryotic genome analysis tool)等工具能實現(xiàn)對同一種或?qū)俚母鞣N生物信息進(jìn)行比較,能高效且準(zhǔn)確地篩選出目的菌株特有的DNA片段,可以用于乳酸菌在腸道或糞便中進(jìn)行檢測和定量分析。
2.4 新型納米材料
近年來,納米材料發(fā)光技術(shù)越來越多地應(yīng)用到益生菌在活體體內(nèi)的示蹤上,主要包括長余輝納米材料和上轉(zhuǎn)換納米材料等,其具有較強(qiáng)的組織穿透性,在生物組織中的吸收也較少且傷害較小,在體內(nèi)成像應(yīng)用中備受青睞[79-80]。Liu Yaoyao等[81]將Cr3+摻雜的鋅鎵鍺長余輝納米材料用革蘭氏陽性菌LTA抗體進(jìn)行功能化,然后對羅伊氏乳桿菌進(jìn)行標(biāo)記,以監(jiān)測其在口服后進(jìn)入胃腸道的“行蹤”,體內(nèi)動物成像證明,經(jīng)過納米材料標(biāo)記的羅伊氏乳桿菌經(jīng)口服給藥后能夠?qū)崟r、無損地檢測羅伊氏乳桿菌在小鼠體內(nèi)的分布。Martín等[82]報道了一種用氧化鐵納米粒子標(biāo)記乳酸桿菌的方法,并且磁性在細(xì)菌分裂后還存在。與磁性細(xì)菌不同的是,這種人工磁化的細(xì)菌可以通過調(diào)整細(xì)菌培養(yǎng)條件和磁性納米粒子的數(shù)量來調(diào)節(jié)細(xì)菌的磁性,磁性可進(jìn)行量化,操作便捷。基于新型納米材料對益生菌體內(nèi)分布進(jìn)行示蹤的生物光學(xué)成像技術(shù)具有高度選擇性、敏感性和非侵入性等優(yōu)點,已廣泛應(yīng)用于生物醫(yī)學(xué)領(lǐng)域[83]。
3 結(jié) 語
目前,對乳酸菌在腸道定植的探究已經(jīng)做了很多研究工作,其定植的機(jī)制仍還未完全探明。盡管已有的體外黏附模型有助于乳酸菌在腸道定植機(jī)制的研究,但現(xiàn)有的體外模型還無法可靠地反映乳酸菌在腸道環(huán)境中真實的定植效果,因此,選擇建立一個合適的體外定植能力的評估模型尤為重要。另外,復(fù)雜腸道環(huán)境中各種因素的干擾給乳酸菌在示蹤和定量上帶來很大的挑戰(zhàn)。未來研究的重點可以針對這些環(huán)境干擾因素開發(fā)各類示蹤技術(shù)和定量方法以及通過與其他組學(xué)結(jié)合進(jìn)行研究,旨在追蹤乳酸菌在復(fù)雜的腸道環(huán)境中定植位點以及精確評估定植時間和數(shù)量。另外,還需要與其他學(xué)科結(jié)合,如利用新型納米材料、軟件分析技術(shù)等對乳酸菌腸道定植機(jī)理進(jìn)行更精確、更大規(guī)模、更加深入的研究。

