長鏈非編碼RNA LOC100130476在腎細胞癌的表達及啟動子區(qū)甲基化狀態(tài)*
張曉宇,蘇建志,齊盼,衛(wèi)書飛,張愛莉
050000 石家莊,河北醫(yī)科大學第四醫(yī)院 泌尿外科
腎細胞癌(renal cell carcinoma,RCC)為常見惡性腫瘤,約占成人惡性腫瘤的2%~3%,其死亡率呈不斷增長的態(tài)勢,全球每年約有10萬人死于RCC,嚴重威脅人類的健康[1]。腎透明細胞癌是RCC最常見的亞型,多發(fā)生于近端小管,約占腎癌的75%[2]。隨著RCC診療技術的不斷進步,早期確診的患者可通過手術治愈,但術后仍有20%~40%的患者發(fā)生復發(fā)或遠處轉移,且大多數(shù)患者在診斷時已處于中晚期,預后較差。盡管靶向藥物可以改善患者的生存率,但耐藥性幾乎是不可避免的[3]。因此,探索RCC發(fā)生發(fā)展的具體機制,尋找有效的腫瘤轉移和耐藥靶點,對RCC的診斷和治療具有深遠的意義。
長鏈非編碼RNA(long non-coding RNA,lncRNA)是長度大于200 bp的RNA分子,其特點為缺乏可識別的開放閱讀框,以及不具有編碼蛋白質(zhì)的能力[4]。研究表明,lncRNA在腫瘤的發(fā)生和發(fā)展中起著重要作用,其調(diào)控方式包括介導染色質(zhì)重塑、組蛋白修飾、轉錄和轉錄后調(diào)控[5]。由于lncRNA表達的組織特異性,一些特定的lncRNA可成為腫瘤診斷和治療的有效分子靶標。LOC100130 476又名WAKMAR2,是位于6q23.3的lncRNA。研究表明,LOC100130476與食管鱗癌和胃賁門腺癌的侵襲、轉移以及患者預后緊密相關[6-7],但LOC100130476在RCC的研究較少。本研究旨在檢測RCC中LOC100130476的表達和甲基化狀態(tài),分析其表達與甲基化狀態(tài)的相關性,揭示LOC10013 0476甲基化在RCC進展中的作用,為RCC的診斷與治療提供實驗依據(jù)。
1 材料與方法
1.1 主要試劑
RPMI 1640培養(yǎng)基購自美國Gibco公司;FBS購自德國Pan-Biotech公司;TRIzol購自北京索萊寶公司;逆轉錄試劑盒、綠色體系和Wizard DNA純化試劑盒購自美國Promega公司;引物由北京賽百盛公司合成;5-Aza-dC購自Sigma公司。
1.2 研究對象及標本來源
組織標本取自河北醫(yī)科大學第四附屬醫(yī)院泌尿外科2018年7月1日至2020年7月1日確診為腎癌的手術患者,所有患者的臨床資料均來自病歷記錄。腎癌患者70 例,其中男性42 例(60%),女性28 例(40%)。60 歲以下26 例(37.14%),60 歲以上44 例(62.86%)。所有患者未接受術前放療或化療。每對標本均取腎癌原發(fā)灶及距原發(fā)灶5 cm以上的相應正常組織(針對較大腫瘤,盡可能選取距原發(fā)灶2 cm以上的正常組織),并將標本分為兩部分,一部分以新鮮狀態(tài)放入組織固定液(RNA later)中,在4℃冰箱孵育過夜,然后轉移到-80℃冰箱中以備提取RNA; 另一部分用4%中性甲醛溶液固定,常規(guī)制備蠟塊,切4 μm切片用于HE染色和病理分析。腫瘤組織標本由3位病理醫(yī)師診斷為腎透明細胞癌,且在正常組織中沒有癌細胞浸潤。所有標本均具有完整的病理診斷和臨床數(shù)據(jù),患者的臨床分期符合美國癌癥聯(lián)合會和國際抗癌聯(lián)盟的標準,腫瘤病理分級符合WHO標準。本研究的所有患者均已簽署了經(jīng)河北醫(yī)科大學第四醫(yī)院倫理委員會批準的知情同意書(倫理編號:2020k-1147)。
1.3 方法
1.3.1 細胞培養(yǎng) 將腎癌細胞系(A498、ACHN、786-O)及人腎皮質(zhì)近曲小管上皮細胞(HK-2)置于含有10%胎牛血清的RPMI 1640培養(yǎng)基中,并在37℃、5% CO2的培養(yǎng)箱中培養(yǎng)。
1.3.2 5-Aza-dC藥物干預 將對數(shù)生長期細胞分為2組:1)未處理組:不加藥,加入等體積培養(yǎng)液;2)5-Aza-dC處理組:按參考文獻[6]將5 μmol/L 5-Aza-dC加入到培養(yǎng)基中培養(yǎng)48 h。
1.3.3 RT-qPCR檢測 根據(jù)TRIzol試劑說明書,從HK-2細胞、腎癌細胞系、腎癌及相應正常組織樣本中提取總RNA。根據(jù)逆轉錄試劑盒說明書,將總RNA逆轉錄成cDNA,然后以cDNA為模板,以β-肌動蛋白(β-Actin,ACTB)作為內(nèi)參,進行RT-qPCR擴增。RT-qPCR引物如下,LOC100130476上游引物:F:5’-AGACAGTCTAACCGTGGGGTA -3’,下游引物:R:5’-CCCAAATTGTRCCGGACCAG-3’;ACTB上游引物:F:5’-ACCGAGCGCGGCTACAG-3’,下游引物:R:5’-CTTAATGTCACRCCCGATT TCC-3’。RT-qPCR反應條件:95 ℃預變性10 min后;95 ℃變性15 s、60 ℃退火30 s、72 ℃延伸30 s,共35 個循環(huán);每個樣本設3個復孔。根據(jù)每孔熒光信號達到閾值時經(jīng)歷的循環(huán)數(shù)記為該組織中LOC100130476和ACTB基因轉錄水平的CT值。采用相對定量法:△CT=CTLOC100130476-CTACTB,△△CT=△CT癌組織-△CT配對正常組織,以N=2-△△CT表示目的基因的相對表達量,其數(shù)值表示癌組織與正常組織的相對倍數(shù),實驗重復3次取平均值。
1.3.4 甲基化特異性PCR(methylation specific PCR,MSP)檢測 采用酚/氯仿抽提法,提取組織DNA,定量后,將適量的DNA用2 mol/L氫氧化鈉變性,置10 mmol/L氫醌和3 mmol/L亞硫酸氫鈉中50℃反應16 h,然后用DNA純化試劑盒純化DNA樣品。經(jīng)亞硫酸鹽處理后,單鏈DNA的未甲基化胞嘧啶可通過亞硫酸氫鹽脫氨作用轉化為尿嘧啶,而甲基化的胞嘧啶則不能被修飾。根據(jù)這一原理,并結合Meth primer軟件,分別設計該基因的甲基化及非甲基化引物,然后進行擴增和MSP檢測。圖1中顯示了LOC100130476轉錄起始點上游1 000 bp及CpG島的分布情況,黑色箭頭標示MSP引物所在的位置。甲基化引物:F:5’-TATTGCGGTATTTTACGTTTCGTCG-3’,R:5’-AAACGCCCCTCGAACCCTCCGATCG-3’(產(chǎn)物長度169 bp);非甲基化引物:F:5-’TATTGTGGTATTTTATGTTTTGTTG-3’,R:5’-AAACACCCCTCAAACCCTCCAATCA-3’(產(chǎn)物長度169 bp)。PCR反應條件為95 ℃預變性10 min后,95 ℃變性45 s,56 ℃退火45 s,72 ℃延伸45 s,35個循環(huán)后進行數(shù)據(jù)統(tǒng)計。用經(jīng)甲基化酶處理以后的基因組DNA作為甲基化的陽性對照,用正常人外周血DNA作為非甲基化的陽性對照,陰性對照則用滅菌雙蒸水取代DNA模板進行PCR。另隨機選取10%標本進行重復實驗以驗證結果的可靠性。

圖1 LOC100130476 CpG島及引物位置
1.3.5 MSP結果判定 使用凝膠電泳成像和GeneSys軟件進行圖像分析。MSP的結果如下:1)甲基化:甲基化特異性引物(M)擴增出目標條帶,而非甲基化特異性引物(U)未擴增;2)非甲基化:非甲基化引物(U)擴增出靶條帶,而甲基化的引物(M)未擴增;3)甲基化不完全:這兩對引物均具有靶條帶擴增功能,并包含在非甲基化中以進行統(tǒng)計分析。甲基化率是發(fā)生完全甲基化和不完全甲基化標本數(shù)占總的標本數(shù)的百分比。隨機選擇10%的樣品進行重復測試,空白對照沒有擴增產(chǎn)物,則說明結果可靠[8]。
1.4 統(tǒng)計學方法
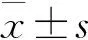
2 結 果
2.1 LOC100130476在腎癌及其相應正常組織中的表達情況
腎癌組織中LOC100130476的表達明顯低于其相應正常組織(0.593±0.306vs1.000±0.018,t=-11.143,P<0.001)(圖2)。結合表1的臨床病理資料分析,LOC100130476在無淋巴結轉移組的表達高于有淋巴結轉移組(0.736±0.367vs0.527±0.251,t=2.774,P=0.007),并與臨床分期相關(F=5.436,P=0.002);按照年齡、性別以及分化程度分組進行統(tǒng)計分析,LOC100130476的表達差異均不具有統(tǒng)計學意義(P>0.05)。

圖2 腎癌組織及其相應正常組織中LOC100130476表達

表1 70例腎癌組織中LOC100130476表達與臨床病理特征的關系
2.2 LOC100130476在腎癌細胞系中的表達情況
HK-2作為正常細胞對照組,RT-qPCR分析結果顯示,LOC100130476在786-O、ACHN、A498腎癌細胞的相對表達量分別為 0.338±0.029、0.144±0.016、0.133±0.018,均低于對照組1.102±0.149,差異有統(tǒng)計學意義(F=107.068,P<0.001),其中786-O、ACHN、A498各自與正常細胞HK-2相比,差異均具有統(tǒng)計學意義(t=8.737,P=0.001;t=11.090,P<0.001;t=11.215,P<0.001;圖3)。

圖3 LOC100130476在腎癌細胞系中的表達
2.3 經(jīng)5-Aza-dC處理前后LOC100130476在腎癌細胞系的表達情況
使用配對t檢驗進行統(tǒng)計(圖4),LOC100130476在786-O未處理組的表達量為1.105±0.096,5-Aza-dC處理組為3.943±0.321,差異具有統(tǒng)計學意義(t=-12.531,P=0.006);LOC100130476在ACHN未處理組的表達量為0.473±0.053,5-Aza-dC處理組為2.110±0.273,差異具有統(tǒng)計學意義(t=-11.990,P=0.007);LOC100130476在A498未處理組的表達量為0.434±0.058,5-Aza-dC處理組為4.398±0.386,差異具有統(tǒng)計學意義(t=-18.603,P=0.003)。

圖4 5-Aza-dC處理前后腎癌細胞系中LOC100130476的表達
2.4 LOC100130476在腎癌及其相應正常組織中的甲基化狀態(tài)
MSP結果顯示,LOC100130476在腎癌和相應正常組織中的甲基化率分別為[78.57%(55/70)vs30.00%(21/70),χ2=33.273,P<0.01]。結合臨床病理特征發(fā)現(xiàn)(表1),有淋巴結轉移患者顯著高于無淋巴結轉移患者[85.42%(41/48)vs63.64%(14/22),χ2=4.250,P=0.039];按照年齡、性別、分化程度、臨床分期進行統(tǒng)計分析,腎癌組織LOC100130476甲基化率差異均不具有統(tǒng)計學意義。圖5顯示為部分病例腎癌組織的甲基化狀態(tài),case1有未甲基化表達,可能是組織差異造成的。

圖5 腎癌組織中LOC100130476的甲基化狀態(tài)
2.5 LOC100130476在腎癌細胞系中的甲基化狀態(tài)
MSP結果(圖6)顯示,5-Aza-dC處理前A498、ACHN、786-O細胞系中LOC100130476呈高甲基化狀態(tài);5-Aza-dC處理的3株細胞系使用甲基化引物進行擴增后,LOC100130476在A498和786-O細胞系中甲基化程度均消失,在ACHN細胞中甲基化程度降低;使用非甲基化引物進行擴增,A498、ACHN、786-O的LOC100130476非甲基化程度均顯著增高。

圖6 腎癌細胞系中LOC100130476的甲基化狀態(tài)
3 討 論
RCC為常見的惡性腫瘤,探索RCC發(fā)生發(fā)展的具體機制,尋找有效的腫瘤轉移和耐藥靶點,具有深遠的意義。LncRNA曾被視為RNA聚合酶II轉錄的“噪音”,沒有任何生物學功能[9]。但最近研究證實lncRNA在生物調(diào)控過程中扮演重要的作用,如染色質(zhì)修飾、X染色體沉默、轉錄激活、基因組印跡、轉錄干擾和核內(nèi)轉運[10]。同時lncRNA可成為腫瘤診斷和治療的有效指標。Li等[11]研究發(fā)現(xiàn),lncRNA PLK1S1在RCC組織和細胞中上調(diào),并與患者臨床分期相關,PLK1S1高表達患者的總生存時間更短。生信及熒光素酶報告基因表明,PLK1S1可通過miR653/CXCR5軸促進RCC進展和索拉非尼耐藥。Yang等[12]研究發(fā)現(xiàn),lncRNA FGD5-AS1在腎癌組織中高表達,并與miR-5590-3p競爭性相互作用并調(diào)節(jié)ERK/AKT的下游信號傳導,促進RCC的增殖和轉移。Wang等[13]研究發(fā)現(xiàn),在舒尼替尼耐藥的RCC組織和細胞系中,MALAT1表達顯著上調(diào)。LncRNA MALAT1通過miR-362-3p/G3BP1來促進SU化學耐藥性。
LOC100130476位于6q23.3,與食管鱗癌、胃賁門腺癌侵襲轉移以及預后緊密相關[14-15]。本研究檢測LOC100130476在RCC組織、正常組織及細胞系中的表達情況,結果表明,癌組織中LOC100130476的表達水平明顯低于正常組織,在腎癌細胞系(A498、ACHN、786-O)及人腎皮質(zhì)近曲小管上皮細胞(HK-2)中,LOC100130476在3種RCC細胞的表達均低于對照組。進一步分析LOC100130476的表達水平與臨床病理數(shù)據(jù)的關系發(fā)現(xiàn),LOC100130476的表達水平與RCC的淋巴結轉移及臨床分期有關。提示LOC100130476可能在RCC中起抑癌基因的作用。
RCC是多基因和多階段突變積累的病理過程。腫瘤細胞基因組DNA中常伴有廣泛低甲基化和局部異常高甲基化[16]。DNA甲基化在真核細胞中多發(fā)生于CpG位點,在DNA甲基化轉移酶作用下,使CpG二核苷酸5’端的胞嘧啶轉變?yōu)?’-甲基胞嘧啶[17],常見的具有甲基化活性的DNMTs主要為DNMT1、DNMT3A、DNMT3B[18]。基因啟動子區(qū)CpG位點常呈聚集狀態(tài),稱為CpG島,在人類正常基因組中呈低甲基化狀態(tài),可調(diào)控基因轉錄活性,與腫瘤的發(fā)生發(fā)展密切相關[19]。近年來,隨著對基因組研究的不斷深入,發(fā)現(xiàn)表觀遺傳學修飾可作為“開關”調(diào)控lncRNAs在腫瘤中作用[20]。抑癌基因啟動子中CpG島的異常甲基化導致基因表達下降并誘導腫瘤形成[21]。通過UCSC序列檢索并結合 CpG島預測軟件Meth primer分析發(fā)現(xiàn),LOC100130476有三個CpG島,長度分別為224 bp、768 bp、151 bp,在食管癌和賁門腺癌中LOC100130476甲基化主要表現(xiàn)在第一個CpG島,本研究推測啟動子區(qū)CpG島的高甲基化可能是LOC100130476表達異常的機制之一。因此,本課題組從RCC的甲基化狀態(tài)和LOC100130476的表達入手,初步探討了LOC1001 30476甲基化在RCC發(fā)生發(fā)展中的作用機制。
本實驗應用的干預藥物5-Aza-dC是一種DNA甲基轉移酶抑制劑,抑制DNA甲基化,通過誘導細胞周期停滯、凋亡、DNA損傷等來發(fā)揮其抗腫瘤活性,應用于多種惡性腫瘤的治療。我們檢測了LOC100130476在RCC細胞系(A498、ACHN、786-O)中5-Aza-dC處理前后表達水平的改變,初步探究其表觀遺傳學機制。實驗發(fā)現(xiàn)LOC100130476在RCC細胞系(A498、ACHN、786-O)中5-Aza-dC單獨處理后表達均上調(diào),這一結果提示LOC100130476在RCC中的低表達可能受到DNA甲基化的調(diào)控,并且這一修飾過程可被5-Aza-dC不同程度逆轉。我們進一步應用MSP的方法在70例RCC和相應癌旁正常組織中檢測LOC100130476啟動子區(qū)的甲基化狀態(tài),結果顯示LOC100130476啟動子區(qū)在RCC組織中呈高甲基化狀態(tài),顯著高于其相應癌旁正常組織,且該位點甲基化率與RCC淋巴結轉移密切相關,提示LOC100130476啟動子區(qū)DNA異常高甲基化可能是RCC中LOC100130476表達下調(diào)的主要機制之一,該區(qū)域CpG位點,對基因的表達起關鍵調(diào)控作用。我們進一步深入研究,應用MSP的方法檢測LOC100130476在RCC細胞系(A498、ACHN、786-O)中的甲基化狀態(tài),結果發(fā)現(xiàn)在5-Aza-dC處理前,3株細胞系中LOC100130476啟動子區(qū)表現(xiàn)為高甲基化狀態(tài),而在5-Aza-dC處理后,LOC100130476啟動子區(qū)甲基化程度均有不同程度降低或表現(xiàn)為非甲基化狀態(tài),這一結果證實,LOC100130476啟動子區(qū)呈高甲基化狀態(tài),并且其高甲基化狀態(tài)可抑制基因表達。在本實驗中部分RCC細胞系的高甲基化狀態(tài)沒有被5-Aza-dC干預完全逆轉,分析可能的原因有:1)同一基因CpG島區(qū)域在不同細胞系中DNA甲基化程度不同;2)5-Aza-dC藥物劑量較低或處理時間不足導致甲基化狀態(tài)未完全逆轉;3)可能存在如組蛋白乙酰化等其他機制而導致該基因沉默表達。研究結果顯示經(jīng)5-Aza-dC干預后的細胞中LOC100130476的表達均顯著升高,5-Aza-dC能逆轉LOC100130476啟動子區(qū)的異常甲基化狀態(tài),使LOC100130476重新表達,并起到抑癌基因的作用。經(jīng)5-Aza-dC處理后,LOC100130476的甲基化程度明顯降低,非甲基化引物的表達明顯升高。表明LOC100130476啟動子區(qū)甲基化與其基因表達相關,進一步驗證了LOC100130476異常甲基化是導致該基因失活的機制之一。因此,應不斷研究DNA甲基化與基因表達之間的相關性,為RCC的早期診斷和脫甲基治療提供依據(jù)。
綜上所述,LOC100130476在腎癌中低表達,其啟動子區(qū)的高甲基化是導致基因表達沉默的機制之一,5-Aza-dC可以逆轉LOC100130476啟動子區(qū)域的異常甲基化并提高其表達水平。總之,希望本研究為LOC100130476啟動子區(qū)甲基化和異常表達的研究提供新的思路和理論依據(jù)。
作者聲明:本文全部作者對于研究和撰寫的論文出現(xiàn)的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數(shù)據(jù)資料等已按照有關規(guī)定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(wǎng)(CNKI)科技期刊學術不端文獻檢測系統(tǒng)的學術不端檢測。
同行評議:經(jīng)同行專家雙盲外審,達到刊發(fā)要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協(xié)議。

