MicroRNA-30a、microRNA-181a在原發免疫性血小板減少癥中的表達及其臨床意義*
譚琳,謝瑜,楊堅,黃穎
(昆明醫科大學第一附屬醫院 血液科,云南 昆明650032)
原發免疫性血小板減少癥(immune thrombocytopenic purpura, ITP)病理機制為血小板計數(platelet count, PLT)下降,伴或不伴皮膚黏膜出血,其發病機制尚存在爭議,認為免疫作用在其中起主導地位[1]。ITP 發生后,B 淋巴細胞功能亢進,產生針對血小板抗原的自身反應性抗體,導致血小板的破壞增加和生成減少[2]。近年來有研究報道,ITP 發生、發展的分子機制可能與microRNA(miRNA)有關,認為其可通過與靶基因的3′-非編碼區(UTR)結合而對靶基因的表達發揮負向調節作用,調節多種蛋白的合成而參與多個細胞生物活動過程[3]。多種miRNA 表達與自身免疫性疾病的發生、發展有關,目前報道的有miR-142、 miR-143、 miR-181、 miR-30a-3p、 miR-223[4-7]。有報道顯示,在EB 病毒陽性皮肌炎患者中發現miR-30a-3p 靶向調控ANXA1,從而促進外周血單個核細胞(peripheral blood mononuclear cells,PBMC)相關炎癥因子的表達及皮肌炎炎癥反應的發生[6]。系統性紅斑狼瘡患者PBMC 中miR-223 異常表達,介導機體炎癥反應,參與疾病的發生、發展[7]。本研究前期通過靶基因生物信息學分析發現,在ITP 患者PBMC 中存在異常表達的miR-30a、miR-181a,考慮其可能作為ITP 發病的靶基因,但目前國內外尚無該類報道。因此本研究旨在明確miR-30a、miR-181a 在ITP 中的表達及其臨床意義,初步明確其是否可作為ITP 的潛在治療靶點,現報道如下。
1 資料與方法
1.1 一般資料
選取2020年1月—2020年12月昆明醫科大學第一附屬醫院收治的ITP 患者48 例作為ITP 組,另取同期本院40 例化療后骨髓抑制血小板減少患者作為對照組,體檢健康者45 例作為健康組。本研究獲得醫院倫理會批準,所有患者家屬知情并簽署同意書。ITP 組男性23 例,女性25 例;中位年齡35 歲,平均(35.62±5.25)歲;PLT 0~55×109/L;平均血小板體積(mean platelet volume, MPV)3.5~7.9 fl,平均(5.62±1.33)fl;出血分級:0 級8 例,1 級10 例,2 級11 例,3 級13 例,4 級6 例。對照組男性19 例,女性21 例;中位年齡36 歲,平均(36.08±5.31)歲;PLT 70×109/L~120×109/L,平均(85.73±10.19)×109/L;MPV 5~10 fl,平 均(6.52±1.37)fl。健康組男性22 例,女性23 例;中位年齡37 歲,平均(36.15±5.37)歲;PLT 82×109/L~290×109/L,平均(178.96±22.33)×109/L;MPV 7~11 fl,平均(7.88±1.48)fl。3 組性別、年齡比較,差異無統計學意義(P>0.05),具有可比性。
1.2 納入與排除標準
1.2.1 納入標準 ①由專科醫師根據診療共識確診為ITP[8];②年齡≥18 歲;③肝腎功能正常,無其他自身免疫性疾病;④依從性較好;⑤無溝通障礙和神經系統疾病,能接受各項檢查;⑥無潰瘍病史或未長期使用免疫調節劑。
1.2.2 排除標準 ①胃腸手術史;②難治性或無法控制的高血壓、糖尿病等原發性疾病;③合并惡性腫瘤;④合并大出血或內出血性疾病;⑤合并代謝性疾病;⑥各系統組織潰瘍。
1.3 方法
采集受試者空腹靜脈血檢測MPV 和PLT。采集受試者空腹靜脈血5 ml 置于枸櫞酸抗凝管中,采用密度梯度離心法分離PBMC,總RNA 提取試劑盒(北京厚生博泰科技有限公司)提取細胞總RNA,消除RNA 中基因組DNA 并除去DNase1 后,采用逆轉錄試劑盒(德國Qiagen 公司)逆轉錄成cDNA,以此cDNA 為模板參照引物序列(上海生工生物工程股份有限公司)進行實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction, qRTPCR)擴增。qRT-PCR 擴增體系:SYBR Green Mix 10 μl,正向引物0.5 μl(10 μmol/L),反向引物0.5 μl(10 μmol/L),cDNA 模板1 μl,ddH2O 8 μl。qRTPCR 反應條件:95℃預變性3 min,95℃變性5 s,56℃退火10 s,72 ℃延伸25 s,共計39 次循環。qRTPCR 引物序列見表1。擴增產物經1.5%瓊脂糖凝膠電泳,采用凝膠數字成像系統(美國Alpha Inotech 公司)掃描分析,測定各擴增帶吸光度值,以目的基因與β-actin 吸光度比值計算miR-30a、miR-181a 相對表達量。

表1 qRT-PCR引物序列
1.4 統計學方法
數據分析采用SPSS 18.0 統計軟件。計量資料以均數±標準差(x±s)表示,比較用方差分析,兩兩比較用SNK-q檢驗;計數資料以構成比(%)表示,比較用χ2檢驗;相關性分析用Spearman 法;影響因素的分析用多因素一般Logistic 回歸模型,將獨立危險因素擬合多變量的臨床模型;繪制ROC 曲線。P<0.05 為差異有統計學意義。
2 結果
2.1 3 組患者miR-30a、miR-181a 相對表達量及PLT、MPV比較
3 組患者miR-30a、miR-181a 相對表達量比較,經方差分析,差異有統計學意義(P<0.05)。進一步兩兩比較結果:ITP 組高于對照組和健康組(P<0.05)。3 組患者PLT、MPV 比較,經方差分析,差異有統計學意義(P<0.05)。進一步兩兩比較結果:ITP 組低于對照組和健康組(P<0.05)。見表2。
表2 3組患者miR-30a、miR-181a相對表達量及PLT、MPV比較 (±s)
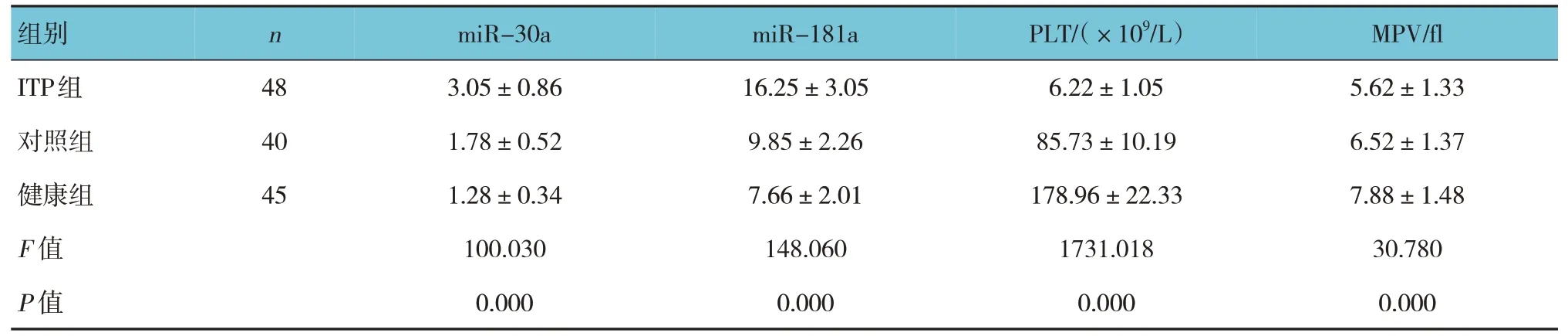
表2 3組患者miR-30a、miR-181a相對表達量及PLT、MPV比較 (±s)
組別ITP組對照組健康組F 值P 值n 48 40 45 miR-30a 3.05±0.86 1.78±0.52 1.28±0.34 100.030 0.000 miR-181a 16.25±3.05 9.85±2.26 7.66±2.01 148.060 0.000 PLT/(×109/L)6.22±1.05 85.73±10.19 178.96±22.33 1731.018 0.000 MPV/fl 5.62±1.33 6.52±1.37 7.88±1.48 30.780 0.000
2.2 miR-30a、miR-181a與各臨床指標的相關性
Spearman 相關性分析結果顯示,miR-30a與年齡和性別無關(P>0.05),與PLT、MPV 呈負相關(P<0.05),與出血分級呈正相關(P<0.05)。miR-181a 與年齡和性別無關(P>0.05),與PLT、MPV 呈負相關(P<0.05),與出血分級呈正相關(P<0.05)。見表3。
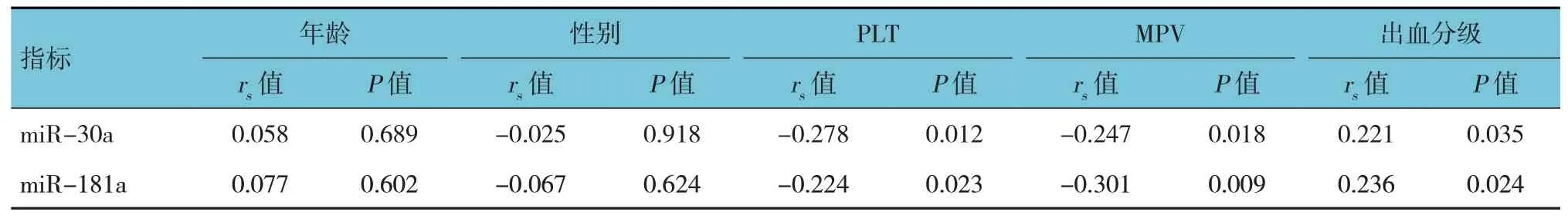
表3 miR-30a、miR-181a與各臨床指標的相關性
2.3 發生ITP的多因素Logistic回歸分析
以是否發生ITP 為因變量(是=1,否=0),以年齡、性別、PLT、MPV、出血分級及miR-30a、miR-181a 相對表達量為自變量,進行Logistic 回歸分析,結果顯示:MPV [=0.685(95% CI:0.332,0.968)]、miR-30a [=1.876(95% CI:1.230,6.336)]和miR-181a [=2.665(95% CI:1.365,8.558)]是發生ITP 的影響因素(P<0.05)。見表4。
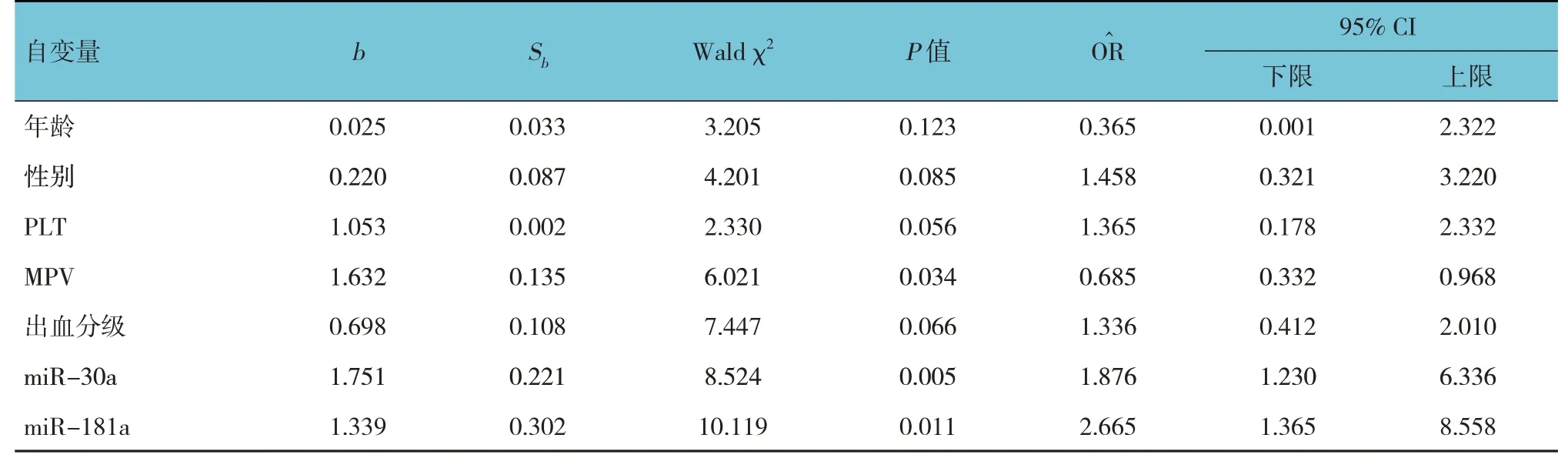
表4 發生ITP的多因素Logistic回歸分析參數
2.4 臨床模型建立與評估
選擇多因素分析差異有統計學意義的指標(MPV、miR-30a相對表達量、miR-181a相對表達量)及其回歸系數建立臨床模型的多元回歸方程:Logistic(P)=-4.115+1.305×MPV-1.258×miR-30a-1.664×miR-181a。在臨床模型中,MPV 6.2~11.0 fl定義為0,MPV <6.2 fl 定義為1;miR-30a 相對表達量<2.85 定義為0,≥2.85 定義為1;miR-181a 相對表達量<8.44 定義為0,≥8.44 定義為1。臨床模型診斷ITP 的標準誤為0.055,AUC 為0.889(95%CI:0.662,0.956),敏感性為75.25%(95% CI:1.123,2.084)、特異性為88.24%(95% CI:1.672,2.583)(見圖1)。選擇48 例ITP 組患者中的11 例,基于臨床模型下的散點圖經過9 次迭代后達精度要求,利用制定好的臨床模型對所有樣本進行診斷測試;散點均圍繞參考線波動,未顯著偏離,診斷ITP的敏感性為90.00%(9/10),特異性為100.00%(1/1),總準確率為90.91%(10/11)。
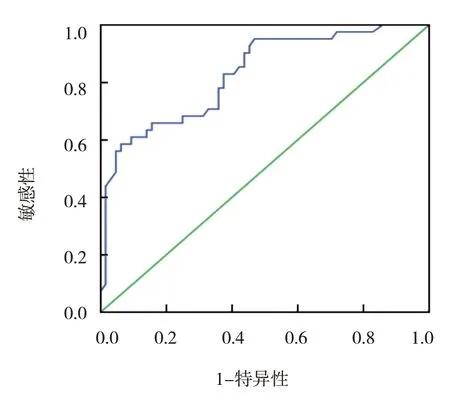
圖1 臨床模型診斷ITP的ROC曲線
2.5 臨床模型的臨床效能評估
極端情況下,預測未發生ITP 臨床凈獲益為0(紅色斜線),預測發生ITP 臨床凈獲益為0~3(藍色斜線);正常情況下,DCA 決策曲線斜率高于2 條極端線。見圖2。
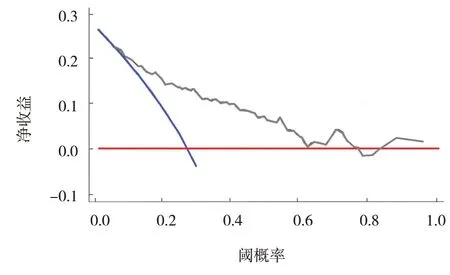
圖2 臨床模型預測ITP的DCA決策曲線
3 討論
近年來關于免疫功能、微炎癥狀態與ITP 密切相關的報道較多,已證實ITP 患者機體內內源性或外源性抗原可導致毛細血管及微靜動脈變態反應而激發氧化應激反應[9]。既往研究發現,在自身免疫性疾病中存在500 多個miRNA,而健康者與ITP患兒及不同出血分級、類型的ITP 患兒間存在60 多個miRNA 差異性表達,提示miRNA 可能參與ITP 的發生、發展[10]。本研究中ITP 組PMBC 中miR-30a、miR-181a 相對表達量顯著高于健康組,與吳曉芳等[11]報道miR-30a 通過介導Th17 細胞分化影響ITP發病的研究結果一致。本研究中miRNA 差異與既往報道有所區別,與不同物種、樣本來源和疾病階段、病情等有關[12-13]。王毅力等[12]報道,ITP 患者PMBC 中可檢測到異常表達的miR-146a,其可鑒別診斷ITP 和急性髓系白血病。miRNA 由體內大多數細胞產生后分泌到外泌體中,進入循環細胞后被其他細胞攝取,在血液和各細胞組織間轉運異常和/或機體表達抗炎miRNA 的能力受損時促進自身免疫性疾病的發病。有研究發現,MEK-ERK 通路激活后可誘導miR-30a、miR-181a 的表達,而其又可負向調節信號通路[14]。miR-30a 通過靶向位點結合SOCS3,影響Th17細胞分化,參與ITP發病[11]。
臨床骨髓巨噬細胞增生活躍時,外周MPV 增大,由于ITP 患者血小板破壞過多,骨髓巨核細胞代償性增生活躍,且血小板代謝旺盛,導致MPV迅速升高。有研究顯示,MPV 在PLT 明顯升高之前,已發生顯著變化,提示MPV 在判斷ITP 的發生、發展更敏感[15]。MPV 升高被認為是ITP 發生的危險因素,血小板功能直接決定骨髓巨核細胞功能特點,骨髓代償功能異常可誘發ITP[16]。本研究中MPV 預測ITP 具有較高的準確性,與既往報道結果基本一致[13]。既往研究認為,miRNA 可調控血小板誘導的炎癥因子合成及PBMC 增殖;同時,miRNA 通過促進/抑制轉錄因子的活性來影響T 細胞增殖,直接影響T 細胞活化誘導的細胞死亡過程[13]。本研究未分析相關炎癥因子,但通過檢測miR-30a、miR-181a 相對表達量發現,其在ITP 患者中變化較為敏感,與MPV、PLT 呈負相關,與出血分級呈正相關,提示其參與ITP 的發生機制。miR-30a 介導炎癥反應和免疫機制[17],由相對表達量在一定程度反映了機體免疫功能,miR-30a 表達升高,提示機體免疫功能差,血小板代謝旺盛引起自身免疫性疾病。ITP 發生后,大量炎癥因子釋放,加劇了氧化應激和免疫功能受損,導致受體相關激酶變化,引起miR-181a 改變,加劇血小板損傷。本研究結合多項臨床資料,進行單因素和多因素分析,建立的MPV、miR-30a、miR-181a 臨床模型區分度評估中,AUC 為0.889,提示準確度高,略高于MAXIMILIAN 等[18]的報道結果,與選擇的預測因子不同有關。校準度評估中,散點圖示散點均圍繞參考線波動,未顯著偏離參考線;說明該臨床模型具有較好的區分度和校準度,對預測ITP 的發生概率具有較高的敏感性和準確性。DCA 決策曲線分析說明本預測模型具有較好的臨床應用價值,使用該模型的患者能從中獲益。
綜上所述,miR-30a、miR-181a 與ITP 發生相關,通過miR-30a、miR-181a 建立個體化預測模型可準確判斷ITP 的發生,且具有較高的臨床實用價值。

