高壓氧治療一氧化碳中毒遲發腦病的療效分析及其機制研究
萬琛宜,黃招君,楊樂
(南昌大學第一附屬醫院 神經內科,江西 南昌330006)
碳物質燃燒時會生成無色、無臭、無刺激性氣體一氧化碳CO,其吸入人體后易引起中毒并對大腦造成損傷,從而導致頭暈、惡心、全身無力、昏迷。雖然治療后上述癥狀發生好轉,但有研究表明,0.2%~47.0%患者在經歷2~60 d 的“假愈期”后會出現失語、認知障礙、急性癡呆等癥狀,這一系列綜合表現被稱作CO 中毒遲發性腦病(delayed encephalopathy after CO poisoning, DEACMP)[1]。DEACMP 的發病機制被認為是CO 由呼吸道進入人體后與血紅蛋白發生反應,生成碳氧血紅蛋白(carbonyl hemoglobin, CoHb),從而導致機體缺氧,給人體中樞神經系統帶來嚴重影響。
高壓氧治療CO 中毒是國內外推薦的方法之一,雖然頻率、療程尚無統一標準,但應用較廣泛,但是高壓氧治療DEACMP 的療效是非確定性的[2]。信號通路作為一種細胞發生某種反應的傳遞信息,近年來在多種疾病中報道,可能有助于研究高壓氧治療DEACMP 的發生機制[3]。本研究對90 例DEACMP 患者進行臨床調查,探討高壓氧對DEACMP 患者Toll樣受體4(Toll-like receptor 4,TLR4)/核轉錄因子-κB(nuclear factor-κB, NF-κB)信號通路及后續療效的作用,并報道如下。
1 資料與方法
1.1 研究對象
選取2018年10月—2019年10月在南昌大學第一附屬醫院神經內科就診的DEACMP 患者90 例。根據抽中奇偶數的結果將患者分成兩組,偶數患者作為實驗組,奇數患者作為對照組,每組45 例。實驗組男性26 例,女性19 例;年齡58~75 歲,平均(62.31±4.31)歲;CO 中毒時昏迷時間2~48 h,平均(18.64±3.15)h;假愈期2~60 d,平均(32.54±5.14)d;病程3~70 h,平均(32.15±4.67)h;對照組男性24 例,女性21 例;年齡56~73 歲,平均(61.85±4.26)歲;CO 中毒時昏迷時間2~46 h,平均(18.20±3.01)h;假愈期2~60 d,平均(33.68±5.36)d;病程3~72 h,平均(31.89±4.54)h;兩組上述指標比較,差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會審批通過,患者及其家屬均知情同意。
1.2 納入與排除標準
1.2.1 納入標準 ①參照DEACMP 診斷標準,有CO 中毒史和明確的假愈期[4];②年齡56~75 歲;③DEACMP 病程≤72 h,格拉斯哥昏迷評分[5]>8 分。
1.2.2 排除標準 ①伴有帕金森癥、阿爾茨海默癥、反應性精神病等認知障礙性疾病;②預計生存期≤6 個月;③心、肝、腎功能異常;④合并感染患者;⑤合并腦卒中等其他影響腦器官及日常活動能力的疾病。
1.3 治療方法
1.3.1 對照組 采取常規治療,在發病早期促進患者腦細胞營養代謝,予以改善腦血液循環藥物[血塞通(廣西梧州制藥集團股份有限公司,國藥準字Z20025652)500 mg/次,1 次/d];靜脈滴注地塞米松(武漢久安藥業有限公司,國藥準字H42020896)10 mg/d,持續1 個月以上;靜脈注射銀杏葉提取物注射液(中豪國際有限公司,國藥準字H20181022)1 次/d。15 d 后根據患者恢復情況調整用藥方案。恢復期給予針灸、按摩,肢體功能鍛煉等。
1.3.2 實驗組 在對照組基礎上使用高壓氧治療,壓力0.2 MPa,持續20 min,穩壓后吸100%純氧約80 min,穩壓吸氧期間休息2 次,約5 min/次,然后持續減壓約20 min,1 次/d。采用煙臺宏遠氧業公司生產的GY3400 型高壓氧艙,10 d 為1 個療程,1 個療程后根據患者恢復情況再調整。
1.4 觀察指標
1.4.1 臨床療效 比較兩組患者治療3 個月后的臨床療效。將臨床療效分為:①痊愈,患者臨床體征消失,腦電圖檢查顯示正常,生活可以自理;②好轉,患者部分癥狀體征消失或減輕,腦電圖檢查顯示輕度異常或中度正常,部分活動需要照顧者幫助);③無效,患者病情無好轉,腦電圖檢查顯示重度異常,生活無法自理)[6]。總有效率(%)=(痊愈例數+好轉例數)/總例數×100%。
1.4.2 TLR4/NF-κB 信號通路 比較兩組患者治療前后TLR4/NF-κB 信號通路的表達,分別采集患者治療前及治療3 個月后空腹靜脈血10 ml,2 000 r/min 離心后進行細胞培養,采用實時熒光定量聚合酶鏈反應(quantitative real-time polymerase chain reaction, qRT-PCR)檢測TLR4 mRNA 的表達。TLR4 mRNA 相對表達量為TLR4 與β-action 條帶灰度值的比值。采用Western blotting 檢測NF-κB p65蛋白的表達。兔抗人磷酸化NF-κB p65 抗體、β-action 抗體購自美國Abcam 公司,TLR4 單克隆抗體購自美國Biolegend 公司。
1.4.3 洛文斯頓作業治療用認知評定量表(Lovins cognitive rating scale for occupational therapy,LOTCA)、日常生活能力量表(activity of daily living scale, ADL)、Wahlund 改良腦白質疏松分級量表(Wahlund modified leukoaraiosis rating scalem ARWMC)評分 比較兩組患者治療前后LOTCA[7]、ADL[8]、ARWMC[9]評分的變化。LOTCA 評分分別從定向力、知覺、視組織運動、思維運作及注意力5 個方面進行評定,共21 個測評項。除思維運作有3 項滿分為5 分,余者每項滿分皆為4 分,分數越低表示其認知障礙越嚴重。ADL 評分從進食、入廁、大小便控制、修飾、洗澡、轉椅床椅、步行、洗澡、上下樓梯10 個項目進行評定,每項滿分10 分,總分越高其生活自理能力越好。ARWMC 評分可依照不同時間點獲取的影像圖像進行判定,分別從兩側腦組織重要組成部分的局部破壞情況進行分析,滿分30 分,總分>10 分時為嚴重的腦白質疏松,總分越低其腦白質疏松程度越輕微。本研究均由專業醫師(對本研究不知情)于治療前及治療3 個月后對患者進行評估。
1.4.4 預后評分 比較兩組患者治療后3 個月、6 個月和12 個月預后評分的變化。預后評分采用改良Rankin(improved Rankin, mRS)評分[10],mRS 評分依照患者病后生活狀態來計算分數,0 分表示無明顯障礙;1 分為有輕微癥狀但無明顯功能障礙;6 分表示患者已無生命體征。mRS ≤2 分表示預后良好。
1.5 統計學方法
數據分析采用Epi Data 3.1 和SPSS 17.0 統計軟件。計量資料以均數±標準差(±s)表示,用t檢驗或重復測量設計的方差分析,進一步兩兩比較用LSD-t檢驗;計數資料以率(%)表示,用χ2檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組臨床療效比較
兩組總有效率比較,經χ2檢驗,差異有統計學意義(χ2=5.000,P=0.025),觀察組高于對照組。見表1。
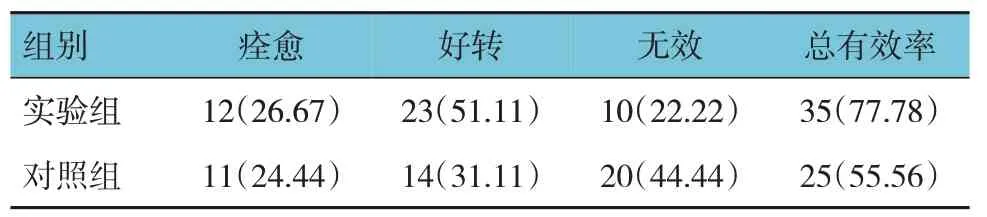
表1 兩組臨床療效比較 [n=45,例(%)]
2.2 兩組患者治療前后TLR4 mRNA、NF-κB p65相對表達量的變化
兩組患者治療前后TLR4 mRNA、NF-κB p65 相對表達量的差值比較,經t檢驗,差異有統計學意義(P<0.05),實驗組大于對照組。見表2。
表2 兩組患者治療前后TLR4 mRNA、NF-κB p65相對表達量的差值比較 (n=45,±s)
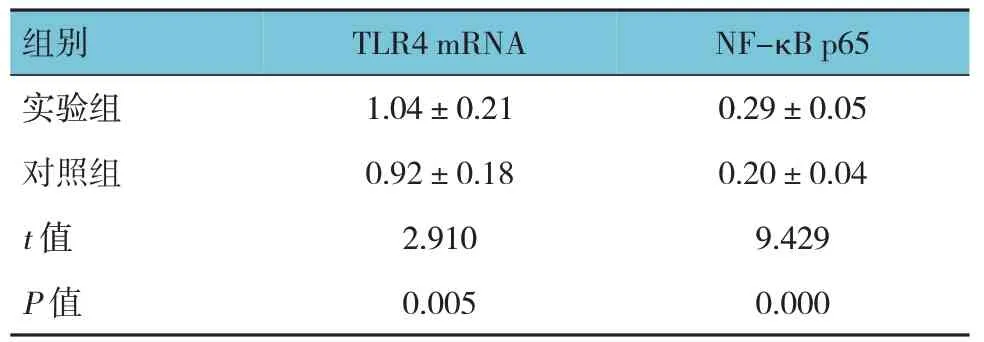
表2 兩組患者治療前后TLR4 mRNA、NF-κB p65相對表達量的差值比較 (n=45,±s)
組別實驗組對照組t 值P 值TLR4 mRNA 1.04±0.21 0.92±0.18 2.910 0.005 NF-κB p65 0.29±0.05 0.20±0.04 9.429 0.000
2.3 兩組患者治療前后各項評分的變化
兩組患者治療前后LOTCA、ADL 及ARWMC 的差值比較,經t檢驗,差異有統計學意義(P<0.05),實驗組治療前后LOTCA、ADL 的差值大于對照組,ARWMC 的差值小于對照組。見表3。
表3 兩組治療前后各項評分的差值比較(n=45,分,±s)
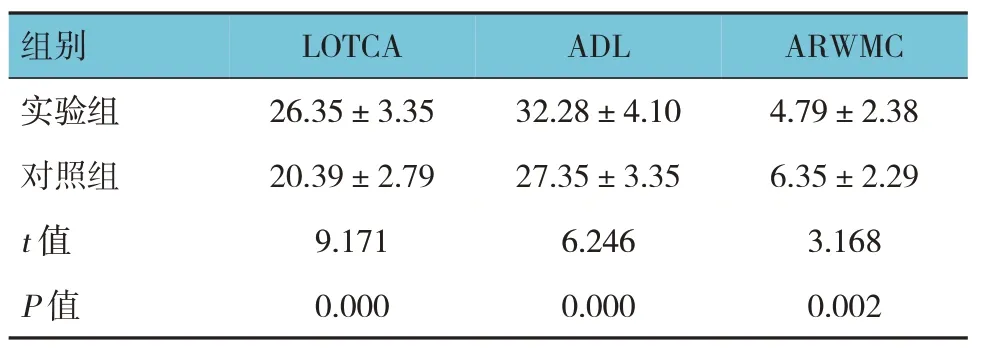
表3 兩組治療前后各項評分的差值比較(n=45,分,±s)
組別實驗組對照組t 值P 值LOTCA 26.35±3.35 20.39±2.79 9.171 0.000 ADL 32.28±4.10 27.35±3.35 6.246 0.000 ARWMC 4.79±2.38 6.35±2.29 3.168 0.002
2.4 兩組患者不同時間點mRS評分的變化
實驗組與對照組患者治療后3 個月、6 個月、12 個月mRS 評分比較,采用重復測量設計的方差分析,結果:①不同時間點mRS 評分有差異(F=122.783,P=0.000);②實驗組與對照組mRS 評分有差異(F=43.885,P=0.000);③兩組mRS 評分變化趨勢有差異(F=66.939,P=0.000)。見表4。
表4 兩組患者不同時間點mRS評分比較(n=45,分,±s)
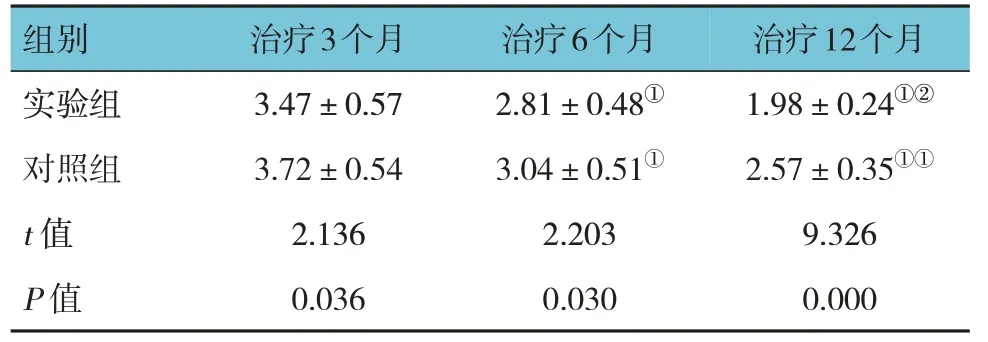
表4 兩組患者不同時間點mRS評分比較(n=45,分,±s)
注:①與治療后3個月比較,P <0.05;②與治療后6個月比較,P <0.05。
組別實驗組對照組t 值P 值治療3個月3.47±0.57 3.72±0.54 2.136 0.036治療6個月2.81±0.48①3.04±0.51①2.203 0.030治療12個月1.98±0.24①②2.57±0.35①①9.326 0.000
3 討論
CO 中毒后,腦組織自由基生成增加,脂質過氧化,從而損傷線粒體;大量生成的自由基引起髓鞘堿蛋白的修飾,激活自身免疫系統,導致髓鞘脫失,T 淋巴細胞活化,釋放炎癥因子,最終引起腦血管病變[11]。TLR4 作為人類發現的第1 個TLR 蛋白,與臨床上許多炎癥性疾病關系密切,其受體與病原相關分子模式結合,利用信號傳導激活NF-κB,調控下游炎癥基因,增強機體炎癥因子的表達,促進機體多種器官炎癥性疾病的發生、發展[12]。
本研究中觀察組總有效率高于對照組,提示高壓氧治療DEACMP 臨床療效更好。李哲等[13]研究高壓氧改善患者臨床療效的機制,認為高壓氧治療能增加血氧分壓,改善大腦缺氧癥狀,減輕腦水腫的惡性循環,相同時間內增快神經纖維髓鞘活性,使血管因缺氧而造成的損傷得到修復,并成功形成側支循環,增強微血栓生成的抑制效果,激活中樞神經生化過程。這也證實了高壓氧可增強生命體抗氧化能力,盡快恢復大腦功能,減少神經細胞的變質及凋亡,改善患者癥狀。
本研究中實驗組治療前后TLR4 mRNA、NF-κB p65 相對表達量的差值大于對照組,提示高壓氧可能通過改善TLR4/NF-κB 信號通路來提高治療效果。DEACMP 患者大腦通常存在微循環功能障礙,神經細胞凋亡及氧化應激等病理生理改變,引起炎癥級聯反應,而TLR4/NF-κB 信號通路也參與了免疫信號傳遞和炎癥因子釋放的過程[14]。TLR4 主要在抗原呈遞細胞及一些實質細胞中表達。在中樞神經系統中,TLR4 主要分布在小膠質細胞和神經元表面,可在一系列反應下激活NF-κB 并暴露核定位信號,促使NF-κB 活化并進入細胞核啟動轉錄,誘導產生腫瘤壞死因子α(Tumor necrosis factor alpha,TNF-α)、白細胞介素1β(interleukin-1β, IL-1β)、IL-6、IL-8、IL-12,從而促進外周炎癥細胞向缺血腦組織移動、黏附和浸潤,加重組織損傷。高壓氧通過提高腦組織氧含量和氧分壓,增加腦組織毛細血管的彌散距離,減少細胞變性壞死,提高超氧化物歧化酶活性,加強清除自由基和抗氧化能力,糾正因無氧酵解產生的酸中毒,從而逆轉神經細胞損傷,降低炎癥因子水平,實現對TLR4/NF-κB 信號通路的調控[15]。
本研究中實驗組治療前后LOTCA、ADL 的差值大于對照組,ARWMC 的差值小于對照組,提示高壓氧治療可顯著減輕患者認知障礙,提高生活自理能力,且可以逆轉腦組織損傷。CO 中毒后,血腦屏障呈非特異性炎癥狀態,高壓氧治療可明顯增強其通透性,降低由氧成分不足而對腦神經器官產生的破壞,促進腦功能逐漸恢復,改善認知功能[16]。
本研究中實驗組與對照組治療后3 個月、6 個月和12 個月mRS 評分有差異,提示高壓氧治療可顯著改善患者預后。方建飛等[17]研究證實,較長時間的高壓氧治療能使病情得到較有效恢復,遠期預后良好,與本研究結果相符。
綜上所述,高壓氧可改善DEACMP 患者TLR4/NF-κB 信號表達,同時緩解其大腦缺氧狀態,提高臨床療效,且遠期預后良好,值得臨床推廣。

