LiCoO2材料的電化學制備及回收研究進展
黃金鳳,韓昀暉,胡 玲,陳夢君,舒建成,王 蓉
(西南科技大學固體廢物處理與資源化教育部重點實驗室,四川 綿陽 621010)
鋰離子電池(Lithium-ion batteries,LIBs)具備高能量密度、高電壓、極低的自放電率、安全的處理和良好的循環壽命等特性,使其逐步取代了Ni-Cd和Ni-MH 電池[1]。1980年,John B.Goodenough 教授基于能帶結構理論,首次將LiCoO2作為正極材料應用于LIBs 中,對于LIBs 的發展和商業化起到了決定性的作用[2]。1991年,SONY 公司成功實現了LIBs 的商業化,以LiCoO2、導電劑、黏結劑和集流體構建的正極進一步推動了LIBs 的發展[3-4]。如今,LIBs 已經成為我們生活中必不可缺的部分,廣泛應用于筆記本電腦、手機、攝像機和其他便攜式電子設備,并深入航空、醫療、電子等高端科技領域[5-6]。常見的LIBs 由正極、負極、電解質、隔膜和外殼等部分組成[7],其中正極是將正極材料和乙炔黑導電劑通過有機黏合劑涂覆于鋁箔上所構成的電流收集體。正極材料是LIBs 的主要部分,是決定LIBs 電化學性能的重要因素。LiCoO2作為最早被發現并應用于商業中的正極材料,具有α-NaFeO2型層狀結構、優良的化學穩定性、生產工藝簡單等特點,且相較于LiNiO2和LiMnO2結構更穩定,廣泛應用于小型二次電池[8-9]。
常見的正極材料的合成方法有固相法和濕法合成[10-14]。固相法分為高溫固相反應法和低溫固相反應法,以固相原料按比例混合和焙燒得到所需產物[15-16]。濕法合成正極材料主要包括水熱法、共沉淀法和溶膠-凝膠法等[12,16],以溶液為介質合成正極材料或前驅體[15]。固相法是大規模制備商用LiCoO2材料的重要方法,但制備過程需要高溫及嚴格的固相原料配比,成本較高,且合成產物成分不均勻、形態不規則[10]。濕法合成LiCoO2雖然方法繁多,易于控制,但需要聯合高溫處理才能提高Li-CoO2的結晶度。相較之下,電化學法制備LiCoO2材料具有成本低、合成溫度低、產品純度高、合成產物形貌可控等特點[17],是制備正極材料的新興方法。
電化學法作為一種新興的LiCoO2材料制備工藝,是將過渡金屬元素利用電化學法直接在各種基底上沉積正極材料或前驅體薄膜[18]。近年來,電化學法在LiCoO2材料制備和回收領域取得了一系列的成果,為此,在全面調研近年來電化學法制備和回收LiCoO2材料成果的基礎上,重點闡述了電化學合成LiCoO2的方法、原理及合成正極材料的電化學性能,具有重要的指導意義。
1 電化學方法制備LiCoO2 材料
電化學法制備LiCoO2材料的方法主要包括電化學-水熱法、靜電噴霧沉積法和電紡絲法等。這些方法基于不同的電化學原理,都具有各自的特點與局限性。
1.1 電化學-水熱法
電化學-水熱法是一種結合電沉積和水熱合成的聯合工藝,由于具有合成溫度低和工藝簡單等特點而被用來在各種襯底上合成LiCoO2材料[18]。在電化學的作用下,控制電沉積反應條件,使電沉積液中的鈷離子不斷遷移和氧化,進而沉積在基板上,并與過量的鋰離子反應,生成相應的正極材料(圖1)[1,18]。
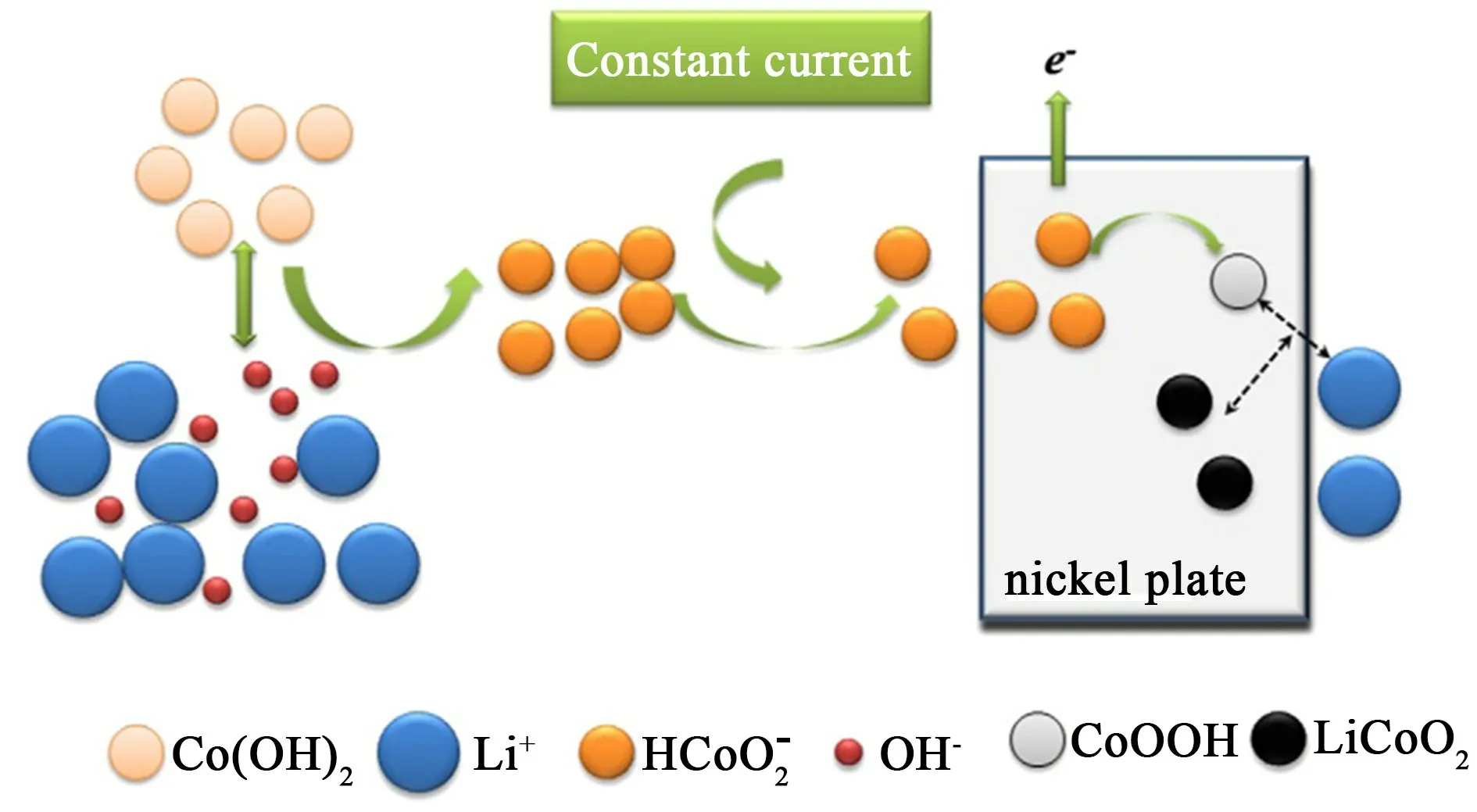
圖1 電化學水熱法制備LiCoO2 的合成機制[1]Fig.1 Synthesis mechanism of lithium cobalt oxide prepared by electrochemical-hydrothermal method[1]
早期研究者以金屬粉末作為原料,如以鈷金屬粉末為鈷源[19],在室溫及100~200℃、電流密度0.1~1.0 mA·cm-2,直接沉積了LiCoO2薄膜。經SEM 測試,沉積膜表面均勻,厚度約為12μm,薄膜間沒有間斷和剝離。電化學性能測試表明LiCoO2沉積薄膜的初始放電體積比容量為54. 1μAh·cm-2·μm-1,循環性15 次后,放電容量保持率為85. 6%。使用金屬鈷粉做鈷源電化學合成LiCoO2薄膜,結晶度好、膜厚度均勻,但電化學性能較差,可能是因為合成溫度的不足,鈷粉的溶解過程緩慢,導致LiCoO2合成速率慢,沉積薄膜的密度小于理論密度。
Porthault 等[18]以鈷鹽[Co(NO3)2·6H2O]和氫氧化鋰做電解液,鈦箔或受保護的晶片(硅/氧化硅/鈦/鉑)為基底,外加1 mA·cm-2的恒定電流密度,在不銹鋼高壓釜中以不同溫度(150~200℃)恒溫電解1 h,觀察到明顯的黑色薄膜沉積。經過3.0~4.2 V 的循環伏安測量,沉積LiCoO2薄膜的循環性能與R-3m 型的LiCoO2高度相似。不經過任何后續處理,在100 次循環后仍能保持90%的容量,極大提高了沉積薄膜的效率和電化學性能。除此之外,Porthault 等[20]還分別在光滑基底和非光滑基底沉積了LiCoO2薄膜。先將鈷鹽溶解于氫氧化鋰溶液,125℃水熱條件下形成可溶性的Co(Ⅱ)物種,然后在恒定的電流密度電沉積1 h,分別在平坦和有圖案的金屬化硅晶片上制備黑色薄膜(圖2)。經分析,在2 種基底上沉積的薄膜具有相同的特性,體積比容量約為35μAh·cm-2·μm-1,低于在較高溫度下電沉積的薄膜材料[18],循環50 次后,容量保持率為80%。與濺射沉積工藝相比,電化學-水熱法無需后續退火處理,直接形成高溫相LiCoO2(R-3m)[21]。Azib 等[22]研究了電解液組成對合成LiCoO2薄膜性能的影響。電化學-水熱過程中,電解液由氫氧化鋰、硝酸鈷組成,加入不同比例的乙醇作為共溶劑,乙醇的低沸點導致容器中的壓力增大,進而提高了薄膜沉積速率,達到500 nm·min-1。與純水溶劑制備的LiCoO2薄膜相比,沉積的薄膜更光滑,有利用于制備薄膜電極。

圖2 a)平坦基底上沉積薄膜的俯視圖和橫截面SEM 圖;b)不同圖案基底上沉積薄膜的橫截面SEM 圖;c)平坦基底沉積薄膜的電壓曲線和容量演化曲線;d)3D LiCoO2 薄膜的電壓曲線和容量演變[20]Fig.2 Top view and cross section view SEM of thin film deposited on a)flat and b)different patterns substrates;c)Voltage curve and d)evolution of the capacity of thin films deposited on flat substrate and different pattern substrate[20]
由此可見,與金屬鈷粉相比,鈷鹽作為鈷源制備LiCoO2所需的電解時間更短。因為鈷鹽在溶解過程中并未發生價態變化,而金屬鈷粉的溶解需要涉及氧化過程。正如圖3 所示,LiCoO2的合成需要堿性條件,而鈷離子在常溫下與LiCoO2形成平衡的鈷物種有CoO2、Co(OH)3、Co3O4、Co (OH)2和。其中CoO2在常規條件下難以穩定存在,Co(OH)3、Co3O4和Co(OH)2屬于難溶性物質,不適合作為水介質中合成LiCoO2的前驅物質。因此,唯一可溶的HCoO-2成為LiCoO2合成的關鍵前驅物質。由于HCoO-2離子的負電性,在溶液中可以隨著電場向陽極移動,進而氧化成高價鈷化合物,促進LiCoO2的合成[1,18-19,24]。進一步分析,金屬鈷和可溶相HCoO-2之間的平衡受到氧化還原電位和pH 值條件的共同影響,而鈷鹽解離出來的Co2+和HCoO-2之間的轉化只受pH 值條件的影響,因此鈷鹽更容易在堿液中溶解。此外,電化學-水熱法合成LiCoO2通常在100℃以上進行,這是由于HCoO-2的生成pH 值隨著溫度的升高而減小,鈷離子更容易在堿性溶液中溶解。
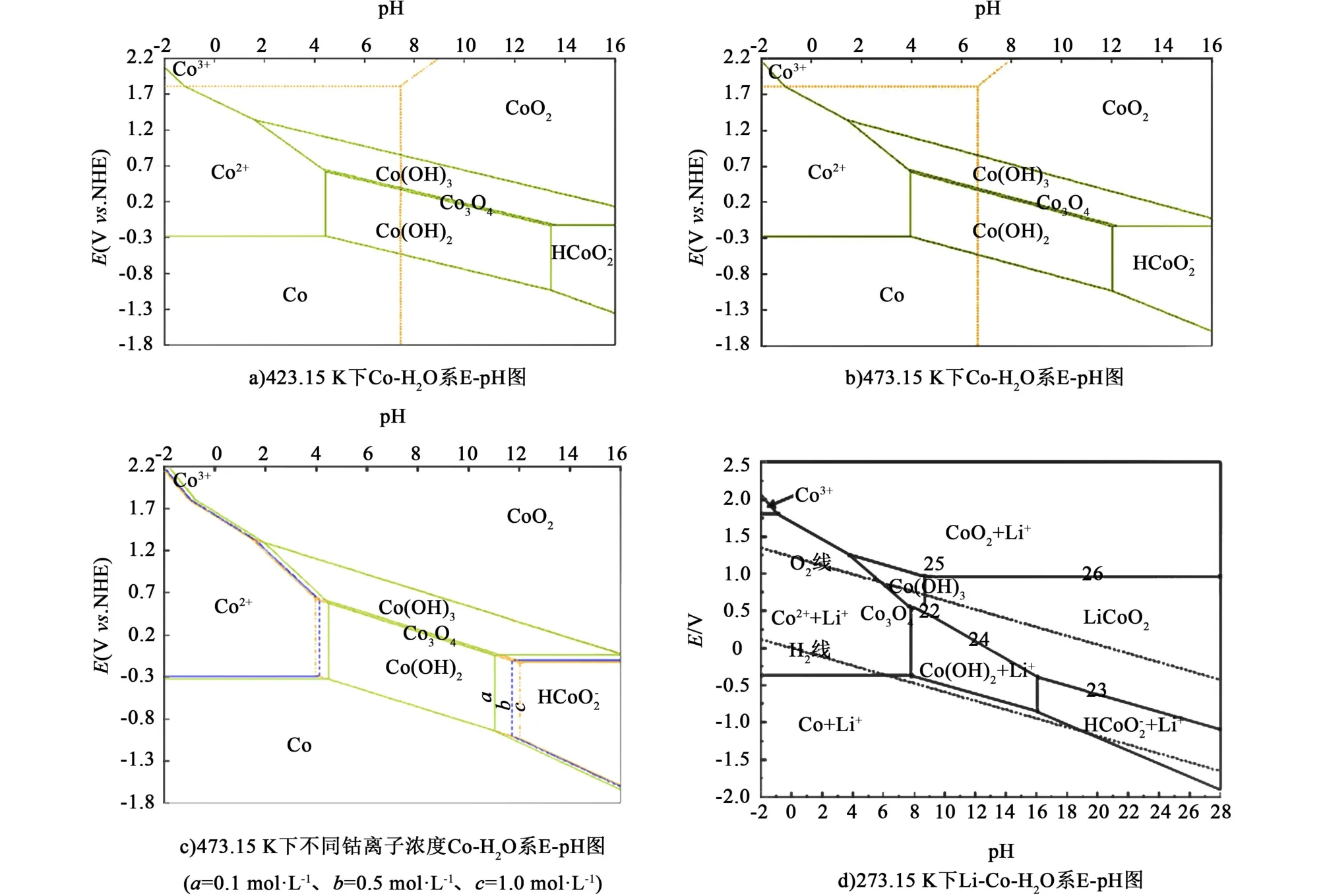
圖3 Co-H2O 系和Co-Li-H2O 系的E-pH 圖[18,23]Fig.3 E-pH diagram of Co-H2O and Co-Li-H2O systems[18,23]
最近,有研究者提出以廢舊LiCoO2電池為原料,電化學制備LiCoO2的方法[1,25]。Li 等[1]以廢舊LIBs 為原料,經拆解、放電、分離等預處理后,用硝酸從廢舊電池電極材料中浸出鈷離子和鋰離子,將獲得的浸出液用LiOH 溶液調節pH 值至11,以鎳基底為陽極、鉑基底為陰極,恒定溫度為100℃,恒定電流密度為1.0 mA·cm-2,電沉積20 h,得到擇優取向為(104)面的LiCoO2晶體。制備的LiCoO2材料初始放電的質量比容量為127.2 mAh·g-1,經30 次循環后放電容量仍有122.9 mAh·g-1,充電效率為99.1%,具有良好的電化學性能。Ra 等[25]使用Etoile-Rebatt 技術直接回收和翻新廢舊LiCoO2材料,初始放電比容量為134.8 mAh·g-1,50 次循環后的放電容量保留率為95.9%。但是在制備的Li-CoO2材料中,易出現其他雜質, 如 Co (OH)2、CoOOH 和Co3O4,必須嚴格控制反應條件。以廢舊鋰電池為原料,不僅對回收和制備LiCoO2材料具有重要意義,更是降低廢舊LiCoO2材料對環境危害的重要途徑。
綜上所述,通過電化學-水熱法制備的LiCoO2材料,具有良好的結構和電化學性能。沉積產物無需進一步熱處理,極大的縮短了工藝流程,降低成本。不同的原料和基底選擇,使合成工藝更靈活,適應LiCoO2材料在各領域的發展,具有極大的實際意義。
1.2 靜電噴霧沉積法
靜電噴霧沉積法(Electrostatic spray deposition,ESD)是一種用于制造無機多孔薄膜的技術[26]。其原理是通過噴嘴泵入由有機溶劑和無機前驅體配制的混合液,使尖端形成球形,然后在高電壓下變成圓錐形,進而產生氣溶膠,依次沉積在加熱的基底上合成多孔薄膜(圖4)[27-28]。

圖4 電噴霧工藝示意圖[29]Fig.4 Schematic diagram of electrostatic spray deposition process[29]
與傳統的沉積技術相比,靜電噴霧沉積法具有許多優點,如設置簡單、成本低、沉積效率高、合成溫度低、沉積薄膜成分和表面形貌易于控制等特點[30]。Yoon 等[30]采用靜電噴霧的方法,在鉑包覆的鋁基底上沉積了LiCoO2薄膜,經600℃退火處理,制備了高溫相的LiCoO2薄膜。實驗分析表明,LiCoO2薄膜的平均重量隨著沉積時間呈線性增長,而產物結晶度和平均粒徑隨著退火溫度的升高而提高。初始放電體積比容量為70μAh·cm-2·μm-1,具有穩定的循環性能。Bezza 等[29]研究了ESD 制造LiCoO2多孔薄膜,由乙酸鋰和乙酸鈷溶于有機溶劑磁力攪拌24 h 制得均質的前驅體混合液,噴嘴電壓和襯底溫度設置在+8 kV 和250℃,前驅體溶液流速為0.2~0.7 mL·h-1。沉積過程中,噴嘴在高電壓下產生高靜電,使霧化尖端的前驅液,加速帶電液滴的形成,并在加熱的基底上沉積所需的LiCoO2薄膜。將沉積的薄膜在空氣中加熱退火2 h,以獲得高溫相的LiCoO2(HT-LiCoO2)。600℃退火處理后的LiCoO2材料表現出最佳電化學性能,其在50μAh·cm-2的電流密度下具有179.6μAh·cm-2的放電容量,通過增加放電電流可以觀察到電容的輕微下降,在300 mA·cm-2的放電電流下,仍然表現出其初始容量的89%左右。
最近的研究報道,靜電噴霧技術可用于改性和制備大面積LiCoO2薄膜材料[26,31]。Yu 等[31]以SiO2溶膠和鋰鈷醋酸鹽溶液混合前驅體,先在350℃的鉑基底沉積50 min,然后在700℃空氣中退火2 h,制備納米SiO2改性的LiCoO2薄膜材料。當SiO2含量為15%時,薄膜具有最佳的循環性能,質量比容量為130 mAh·g-1,60 次循環后幾乎不會衰減。Koike 等[26]采用向下噴射方式,先以氫氧化鋰和乙酸鈷溶解于有機溶劑中制備前體溶液,噴嘴與基底之間施加3~5 kV 的電壓,然后以0.5 mL·h-1的速率將前體溶液噴射在240℃的大面積鋁制基底上。如圖5 所示,沉積薄膜分別再進行400 和650℃熱處理2 h,得到低溫相LiCoO2(LT-LiCoO2)和高溫相LiCoO2(HT-LiCoO2)。400℃處理的薄膜,初始比容量為120 mAh·g-1,具有較大不可逆容量,循環10 次后僅保留原始容量的一半,不適合作為正極材料。與400℃處理的薄膜不同,650℃處理后的薄膜初始比容量為140 mAh·g-1,1.0 C 速率下循環100 次仍能保持93%,接近理論容量。由此可見,靜電噴霧技術可以使LiCoO2在大表面積的基底上直接成膜,通過高溫熱處理后,即使未添加黏合劑和導電添加劑,也能表現出優異的性能。
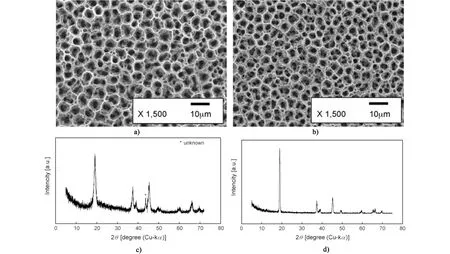
圖5 a)靜電噴霧制備的薄膜SEM;b)650℃處理后的薄膜SEM;c)400℃處理的薄膜XRD;d)650℃處理的薄膜XRD[26]Fig.5 a)SEM of films prepared by electrostatic spray;b)SEM of films treated at 650℃;XRD of films treated at c)400℃ and d)650℃[26]
1.3 靜電紡絲法
靜電紡絲技術最初是由電噴霧技術演變而來,用于制備納米纖維型材料的電化學技術。靜電紡絲工藝制備的納米級纖維材料具有3 D 互連網絡結構,同時擁有較高的長徑比和較大的比表面積,能有效提高鋰離子傳輸速率和嵌入量,因此成為制備具有優異電化學性能的鋰離子電極材料的方法之一(圖6)[7,32]。
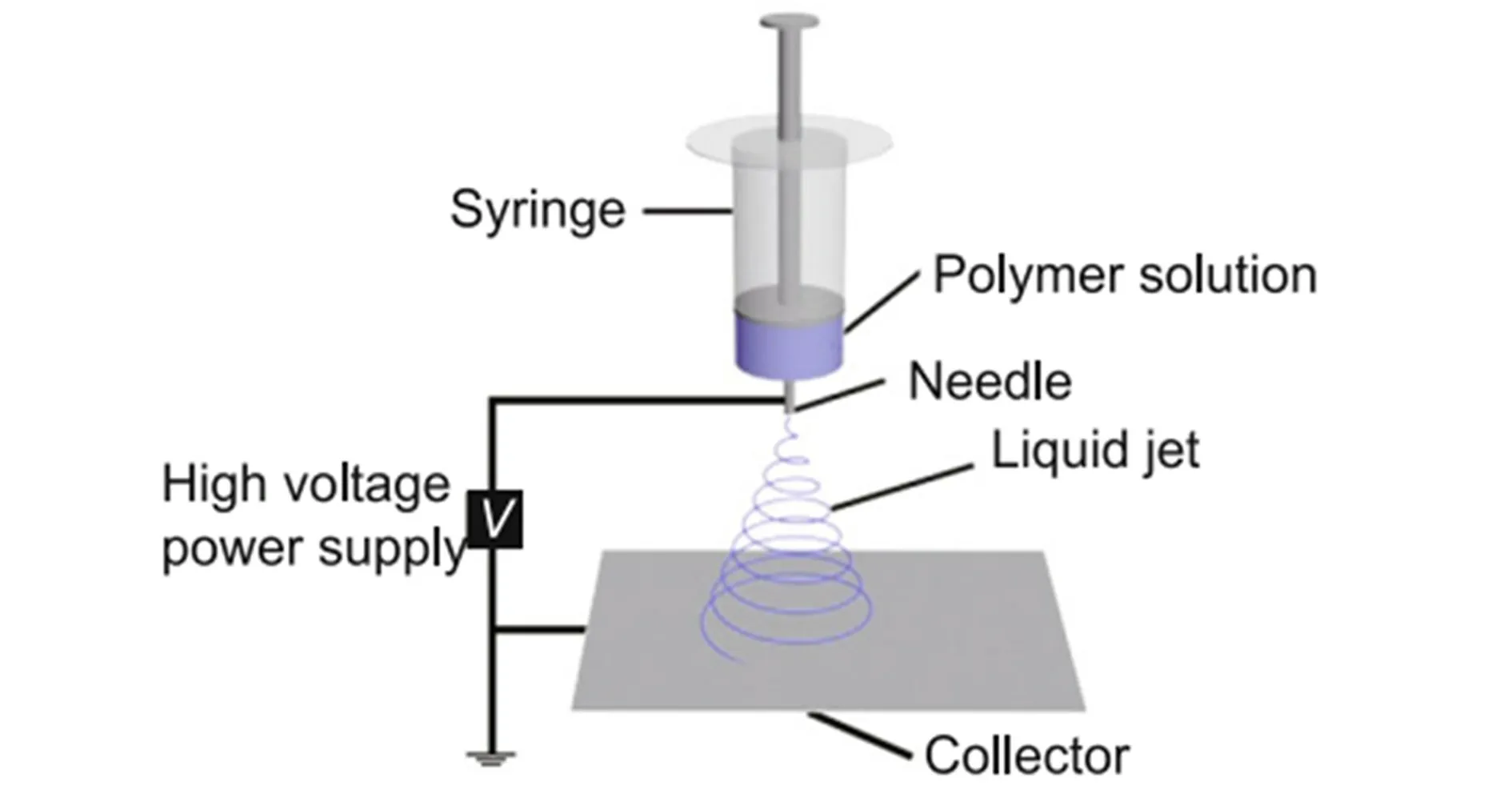
圖6 靜電紡絲工藝示意圖[32]Fig.6 Schematic diagram of electrospinning process[32]
最近,靜電紡絲技術被開發用于制備具有優異結晶度和超細粒徑的LiCoO2粉末。Ou 等[33]采用溶膠-凝膠靜電紡絲工藝合成了納米LiCoO2粉末,乙酸鋰和乙酸鈷混合液中加入適量的丙烯酸,先在70~80℃下連續攪拌形成溶膠-凝膠溶液,然后將聚乙烯吡咯烷酮(PVP)的乙醇溶液加入復合溶液中,連續攪拌得到聚合物溶液。將所得溶液通過注射器,控制進料速率為0.4 mL·min-1,靜電紡絲電場為1.5 kV·cm-2,紡出的納米纖維干燥后在450℃下加熱1 h,研磨后在空氣中600~800℃煅燒7.5 h,得到最終產物。在650℃下煅燒的LiCoO2納米纖維衍生粉末的放電容量在循環次數為1、5、10、20 和30 時分別為153、144、138、123 和117 mAh·g-1。合成的LiCoO2粉末經La2O3涂層表面改性后,表現出了更高的循環穩定性,其放電比容量在循環數1、5、10、20、30 和50 時分別為147、144、143、138、134 和122 mAh·g-1。與常 規溶膠-凝膠 法合成 的LiCoO2粉末相比,納米纖維衍生的粉末具有更高的結晶度和純度,良好的初始放電容量和循環穩定性,并且初始容量的保持率遠高于文獻報道的裸LiCoO2納米纖維。La2O3涂層表面改性后進一步提高了Li-CoO2粉末的循環穩定性,對于其在鋰電池領域的應用具有實際意義。
1.4 其他電化學方法
電沉積技術是研究最多的電化學工藝,常用來沉積各種金屬合金。與傳統陰極沉積工藝不同,Sonoyama 等[34]先使用陽極電沉積的方法,分別在光滑的玻璃碳基底和粗糙的碳紙基底上沉積了前驅體薄膜,然后通過水熱處理合成了由納米顆粒組成的薄膜,并在氬氣流中500℃退火6 h。電化學性能研究表明,在粗糙基底上所獲得的LiCoO2薄膜放電容量達到81μAh·cm-2,優于平坦基底上沉積的LiCoO2薄膜,這種優勢源于高的比表面積基底及鋰離子和電子之間較短的擴散長度。
Watanabe 等[35]基于電化學-水熱技術開發了雙陽極體系,鈷極板和各種基底(鉑、鎳和石墨)同時作為陽極,電解液為陰極,以50μm 厚的鈦箔間隔(圖7)。整個電化學過程中,電解液采用高壓泵維持5 mL·min-1的流速流動,電解池內壓力2 MPa,恒定電流密度1 mA·cm-2,不同溫度125~175℃條件下電解2 h。物相分析證實了各基底上沉積的Li-CoO2薄膜。Fujiwara 等[36]受植物和硅藻在自然界為身體部分合成無定形二氧化硅這一生物過程的啟發,提出一種利用“人工生物礦化”制備薄膜的電化學活化界面反應方法(圖8)。利用被膜分離的溶液之間的界面反應,借助電化學反應在低溫下直接在紙上制備LiCoO2薄膜。陽極和陰極均為碳棒,基底為濾紙,電解液A 和B 分別為氫氧化鋰和硫酸鈷溶液。整個電化學過程保持電解液流動,電流密度為0.01~2.00 mA·cm-2。結果表明,在溫度為120℃時成功沉積了LiCoO2薄膜,而在80℃時得到HCoO2薄膜。此外,該方法具有沉積產物可控的優點,通過控制陽極形狀實現了沉積薄膜的圖案化。
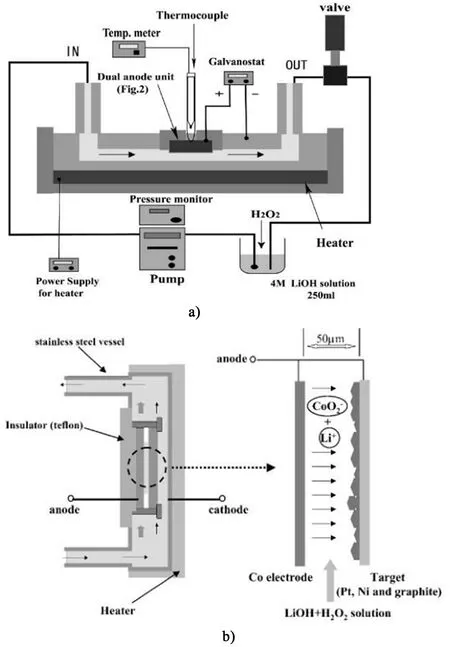
圖7 雙陽極體系a)裝置和b)電極示意圖[35]Fig.7 Schematic diagram of a)device and b)electrode of dual anode system[35]
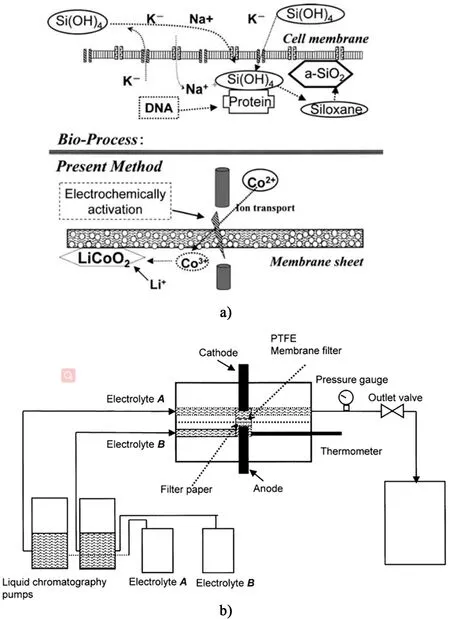
圖8 a)電化學活化界面法原理和b)反應器原理示意圖[36]Fig.8 Schematic diagram of a)electrochemical activation interface method and b)reactor[36]
采用電化學法制備LiCoO2材料,成本低、產品純度高、操作簡單、合成產物具有良好的電化學性能。隨著鋰電池領域的發展,人們對電池材料的要求日益提高。在LiCoO2的制備領域,各電化學法基于不同的處理工藝和原理表現出不同的技術特點和局限性。相對于固相法和濕法而言,電化學法具有更好的靈活性和可控性。雖然部分電化學工藝合成的LiCoO2材料存在結構性差的問題,但配合退火處理可以使產物結構得到很大的改善。不難看出,電化學法可以很好地適應LiCoO2的發展需求,具有很好的應用的前景。雖然電化學法合成LiCoO2已有較深入的研究,但原理的分析仍存在不足,合成產物需進一步向商業化方向發展。
2 電化學方法回收廢舊LiCoO2 材料
鋰離子電池的使用壽命通常在幾百次至1 000次之間,電池經過幾百次的充放電,電極材料會發生膨脹、收縮,甚至活性物質的性能也將發生變化,這就導致電池容量的下降,甚至電池報廢[37-38]。LiCoO2作為常見的電極材料之一,其廢棄量不容小覷。在LiCoO2電池中,通常含有5%以上的鋰和40%以上鈷[39-40],具有極大的經濟價值。因此,合理的回收和再利用廢舊LiCoO2電池不僅能有效的減輕其對環境的破壞,緩解環保的壓力,同時還可以降低金屬資源的浪費,并帶來巨大的經濟收入。
目前,電化學技術在廢棄鋰離子電池回收領域已有廣泛研究。根據處理對象和工藝的不同,電化學方法主要包括電場強化浸出和電沉積法。
2.1 電化學輔助浸出
電化學輔助浸出是在濕法冶金的基礎上,通過電化學作用輔助廢棄LiCoO2電池中有價成分的浸出,進一步提高有價金屬的浸出效率(圖9)。
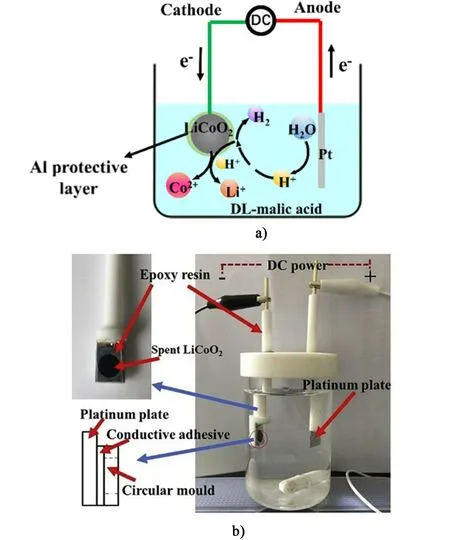
圖9 電化學輔助浸出a)機理和b)裝置示意圖[41-42]Fig.9 Schematic diagram of electrochemically assisted leaching a)mechanism and b)device[41-42]
在電化學輔助浸出過程中,陰極源源不斷地提供電子,進而使鈷離子從難溶的高價態還原為易溶解的低價態。Meng 等[41]使用1.25 mol·L-1蘋果酸溶液做浸出劑,在8 V 電壓和70℃的優化條件下,以陰極提供的電子代替還原劑浸出180 min,鋰和鈷的浸出率分別為94.17%和90.45%。在浸出過程中,由于部分LiCoO2表面形成了Co(OH)3,鈷的浸出由表面化學反應控制轉變為表面化學反應和擴散共同控制,導致了鈷離子相對較低的浸出。Zhou等[42]提出一種一步電解浸出廢LiCoO2,回收鋁箔和分離陰極材料的方法。該方法以DL-蘋果酸作為浸出劑,在無還原劑的弱酸環境中,電化學強化廢棄LiCoO2的溶解。其中鋰的浸出率為97.25%,鈷的浸出率為96.21%,而鋁的浸出率僅有6.85%。由于鋁箔受到鈍化層的保護,所以幾乎未被浸出。此外,從浸出液中回收的CoC2O4·2H2O 可以用作再生LiCoO2的原料。
2.2 電沉積回收有價金屬
與電場輔助浸出不同,電沉積法多用于處理濕法浸出的富金屬浸出液。在電場作用下,廢棄LiCoO2浸出液中的金屬陽離子向陰極移動,進而在陰極板上還原和沉積[43]。陳夢君等[44]以廢舊鋰電池正負極混合粉末的氨浸液作電解液,利用電沉積技術在陰極回收有價金屬。當電流為1.0 A 時,回收的金屬粉末中,金屬鈷的占比為80.71%,其余為鎳9.75%、銅6.96%及鋰2.76%。Myoung 等[45]先以硝酸浸提廢舊LiCoO2電池中的鈷離子制成電解液,然后在鈦基底上恒電位(1.0 V)沉積了島狀結構的Co(OH)2材料。溶解的LiCoO2在硝酸溶液中性掃描伏安分析,沉積過程中發生了多步電還原反應。首先是溶解氧與硝酸鹽離子的還原反應,增加電極局部的pH 值,然后Co(Ⅲ)還原成Co(Ⅱ),并形成Co(OH)2薄膜。但是氫氧根薄膜的不導電性,阻礙了活性物質的進一步還原。
Freitas 等[46]過氧化氫和鹽酸作為浸出劑,結合電沉積技術回收了廢舊手機電池正極材料中的鈷。在電沉積過程中,鈷的成核受到pH 值的影響。當pH 值大于4.0 時,鈷的電沉積通過氫氧化鈷形成。而pH 值低于4.0 時,鈷的電沉積存在中間過程,即沉積的物質形成不穩定化合物(如CoH),隨后還原成金屬鈷。成核模型表明,在pH 值為5.4 時,鈷核成三維逐漸生長(漸進成核),晶核尺寸較大。而隨著pH 值降低至2.7,鈷的成核過程接近瞬時成核。在這種成核過程中,晶核是同時形成的,所以電沉積晶核更小,數量更多。
在傳統的電沉積鈷工藝中,金屬鈷沉積在陰極,而陽極發生析氧反應。雖然有效地從電解液中沉積出金屬鈷,但是陽極消耗的電能卻被浪費[47]。為解決上述問題,Lv 等[47]提出一種成對的電解工藝,從陰極廢舊鋰離子電池硫酸浸出液中沉積高純度(質量分數>99%)的金屬鈷,同時在陽極硫酸銨溶液中合成可活化降解有機污染物的過硫酸鹽。電化學過程在有兩個反應室的電解槽中進行,反應室之間通過陰離子交換膜相隔(圖10),改變陰陽極板面積以控制不同的電流密度。進一步比較成對的電解工藝和單一電解,9.39 kWh 電能在成對電解系統中可同時產生1 kg 金屬鈷和2.08 kg Na2S2O8,陰極電流效率提高約4%,而單一的鈷電解和硫酸鹽氧化工藝共需要消耗約14.08 kWh 電能,節約了約33.31%的電能。
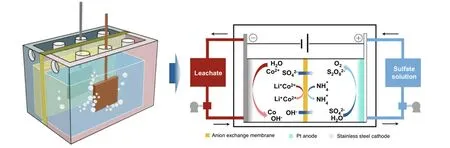
圖10 成對電解工藝原理圖[47]Fig.10 Schematic diagram for the mechanisms of paired electrolysis method[47]
Prabaharan[48]等結合電化學輔助浸出和電沉積工藝,從廢舊鋰離子電池正極材料中分別回收了鈷、銅和錳。在電化學輔助浸出過程中,廢舊鋰離子電池中的鈷和錳浸出率達到99%以上,并在陰極直接沉積回收金屬銅。浸出液用氫氧化鈉調節pH值至4.5,以沉淀除鋁。在電沉積過程中,浸出液中的鈷離子在陰極被還原沉積成金屬鈷,而錳離子在陽極被氧化成二氧化錳。鈷、銅和錳的總體回收率分別在96%、97%和99%以上,金屬鈷、金屬銅粉末和電解二氧化錳純度分別為99.2%、99.5%和96%。由此可見,相對于常規的鈷回收工藝,如萃取、沉淀和過濾等,電沉積技術具有回收的產品純度高、沉積形貌可控、成本低等特點,適用于大規模回收廢舊電極材料。
2.3 其他電化學回收工藝
基于電化學輔助浸出工藝,Huang 等[49]研究了雙室微生物電解浸出LiCoO2中的鈷離子。石墨氈電極在微生物燃料電池陽極室中預馴化3 個月,然后用作電解槽陽極。LiCoO2顆粒先加入100 mL 浸沒一塊石墨氈的去離子水中,磁攪拌下保持15 min,以均勻地散布和負載粒子在電極表面,用作陰極板。浸出液用氮氣凈化15 min 以去除氧。在pH 值為2.0,外加電壓0.2 V 時,鈷的浸出率為57.0(±0.7)%,能量效率為134.0(±5.6)%。雖然提高外加電壓和降低電解液pH 值會增強鈷的浸出效率,但會降低能量效率。實驗結果表明,利用雙室微生物電解從微粒狀LiCoO2中浸出鈷在技術上是可行的。此外,根據不同金屬的電化學特性和生物電化學系統特定的選擇性,通過雙室微生物電解浸出技術分步回收廢舊LiCoO2電池中的金屬離子具有理論可行性,可做進一步研究。
最近,隨著新能源技術的發展,鋰作為鋰離子電池重要的組成元素,其生產和回收都受到了極大的關注。Jang 等[50]利用鋰錳氧化物和活性碳電極的電化學吸附,從廢舊鋰離子電池浸出液中選擇性回收鋰。回收過程中,鋰錳氧化物電極表現出較高的鋰選擇性,隨著電流的增大和電化學反應時間的延長,鋰的回收量和純度增加,回收鋰浸出液的最大鋰回收容量為3.51 mmol·g-1,能量消耗為3.77 Wh·mol-1(13.6 kJ·mol-1)。與傳統萃取法、浸出法和沉淀法回收鋰相比,電化學方法減少了其他化學品(如氫氧化鈉、碳酸鈉等)的使用,可以在其他金屬離子共存條件下,選擇性回收鋰,不需要經過復雜的分離除雜步驟,具有一定應用前景。
3 結語
LiCoO2材料自商用以來,因具有α-NaFeO2型層狀結構和優良的化學穩定性能,相對于其他正極材料更具吸引力,受到人們的廣泛關注。因此,Li-CoO2材料的制備和回收一直是研究熱點之一。在制備方面,采用電化學法制備LiCoO2正極材料具有成本低、產品純度高、操作簡單等特點。相對于固相法和濕法而言,合成過程更靈活和可控,通過調節電化學參數設置、外部條件及工藝形式可以實現對材料粒徑的靈活控制及其他離子的摻雜,有助于改善材料的各方面性能。雖然部分電化學工藝合成的LiCoO2材料存在結構性差的問題,但配合退火處理可以使產物結構得到很大的改善。在回收方面,電化學方法成本低、工藝簡單、回收產物純度高,具有大規模應用的潛力。盡管電化學方法在鈷酸鋰的制備和回收領域已取得了一定的進展,但仍存在許多工藝的不足問題需要進一步研究。未來應對電化學制備和回收的過程及原理進行深入研究,并完善合成產品的后續商業化利用,提高產品的經濟價值。

