免疫檢查點抑制劑治療晚期肝癌的研究進展
李 鑫,高 見,屠 紅
原發性肝癌是2020年全球第6大常見癌癥和第3大癌癥死亡原因[1]。肝細胞癌(hepatocellular carcinoma,HCC)是原發性肝癌的主要類型,早期和中期HCC患者經過手術切除和局部治療如射頻消融(radiofrequency ablation,RFA)或經導管動脈化療栓塞(transcatheter arterial chemoembolization,TACE)等,可獲得較高的5年生存率[2-3]。然而,由于HCC發病隱匿、進展迅速,大多數患者確診時已進入晚期,失去了最佳的手術治療機會。此時,包括靶向治療在內的綜合治療是提高HCC患者生存率的主要措施,但作為晚期HCC的一線藥物,索拉非尼(sorafenib)和侖伐替尼(lenvatinib)延長患者的生存時間十分有限[4]。最近,基于免疫檢查點抑制劑(immune checkpoint inhibitor,ICI)的治療方案,在晚期HCC的治療中取得了重要進展,顯示出了較好的應用前景。本文總結了ICI單藥及聯合用藥在治療晚期HCC中所取得的最新進展,為晚期HCC的綜合治療提供參考方案。
1 肝癌的免疫微環境
腫瘤免疫微環境(tumor immune microenvironment,TIME)是由免疫細胞及其細胞因子與癌細胞相互作用共同構成的微環境,對腫瘤的發生、發展和治療有重要影響[5]。由于肝臟結構特殊,經常暴露于腸源性抗原中,使得肝臟的免疫微環境通常處于免疫耐受狀態。在生理狀態下這種機制可以防止自身免疫損傷,但在病理狀態下則有利于肝癌細胞的免疫逃逸[6]。肝癌TIME中的CD8+T淋巴細胞和自然殺傷細胞(natural killer cell,NK)等免疫效應細胞可以通過直接殺傷肝癌細胞發揮抗腫瘤作用;但TIME中的免疫抑制細胞,如調節性T細胞(regulatory T cell,Treg)、腫瘤相關巨噬細胞(tumor-associated macrophage,TAM)和髓系來源的抑制性細胞(myeloid-derived suppressor cell,MDSC)等,則可以通過產生免疫抑制性細胞因子,抑制CD8+T淋巴細胞等效應細胞的活化,促進HCC進展[7-8]。
免疫檢查點(immune checkpoint,IC)是一類表達于免疫細胞表面的抑制性分子,可以調節免疫系統的激活程度。在HCC中,研究最為廣泛的免疫檢查點包括程序性死亡受體-1(programmed cell death protein-1,PD-1)、程序性死亡配體1(programmed cell death ligand-1,PD-L1)和細胞毒性T淋巴細胞相關抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)。T淋巴細胞表面的PD-1可與癌細胞、樹突狀細胞(dendritic cell,DC)和TAM等細胞表面的PD-L1結合,引起CD8+T淋巴細胞衰竭,從而抑制CD8+T淋巴細胞對癌細胞的殺傷作用;CD8+T淋巴細胞表面的CTLA-4則通過與CD28競爭結合抗原提呈細胞表面的共刺激分子B7,抑制CD8+T淋巴細胞的活化,從而介導癌細胞的免疫逃逸[9]。目前,PD-1單抗、PD-L1單抗和CTLA-4單抗無論在單藥還是聯合用藥治療時,都能不同程度地延長晚期HCC患者的生存時間,是最具潛力的免疫治療策略。
除了PD-1、PD-L1和CTLA-4等IC之外,HCC組織中淋巴細胞活化基因3(lymphocyte activation gene-3,LAG-3)、T細胞免疫球蛋白3(T cell immunoglobulin-3,Tim-3)和T細胞免疫球蛋白和ITIM結構域蛋白(T cell immunoreceptor with Ig and ITIM domain,TIGIT)等IC的水平也均較癌旁組織中明顯增高,這些分子不僅促進了HCC的進展,同時也能影響PD-1單抗、PD-L1單抗和CTLA-4單抗的治療效果[10-11]。
2 ICI單藥在肝癌中的應用
截止2021年9月,美國食品藥品監督管理局(Food and Drug Administration,FDA)和中國國家藥品監督管理局(National Medical Products Administration,NMPA)已批準帕博利珠單抗(pembrolizumab)、納武單抗(nivolumab)、阿特珠單抗(atezolizumab)、伊匹木單抗(ipilimumab)和卡瑞利珠單抗(camrelizumab)等14個單抗用于惡性黑素瘤、非小細胞肺癌(non-small cell lung carcinoma,NSCLC)、和HCC等的治療,具體內容詳見表1。

表1 獲批上市的免疫檢查點抑制劑及適應證Table 1 Approved immune checkpoint inhibitors and indications

表1(續) 獲批上市的免疫檢查點抑制劑及適應證Table 1(continued) Approved immune checkpoint inhibitors and indications
由于腫瘤組織內高表達PD-L1的HCC患者的總體生存率較低[12],使用PD-1單抗或PD-L1單抗可以通過抑制HCC中CD8+T淋巴細胞的衰竭從而延長HCC患者的生存時間[13]。近年來,PD-1單抗在晚期HCC的治療中取得了突破性的進展。一項全球多中心隨機Ⅲ期臨床試驗CheckMate 459(NCT02576509)研究了納武單抗(PD-1單抗)對晚期HCC的療效與安全性。相較于索拉非尼組,雖然納武單抗組對主要終點事件中位總生存期(median overall survival,mOS)的延長沒有統計學意義(P=0.075 2),但仍有改善趨勢(14.7個月vs16.4個月),并且納武單抗組不良事件的發生率為22%,遠低于索拉非尼組的49%。目前,FDA已批準納武單抗作為對索拉非尼治療不耐受或無效的晚期HCC的一線用藥[14](表2)。另一項在27個國家進行的隨機雙盲Ⅲ期臨床試驗Keynote-240(NCT02702401)中,雖然帕博利珠單抗(PD-1單抗)在mOS和中位無進展生存期(median progression free survival,mPFS)等指標方面均未達到預先設定的統計學雙終點標準(mOS:P=0.017;mPFS:P=0.002),但與安慰劑組相比,mOS(13.9個月vs10.6個月,P=0.023)和mPFS(3.0個月vs2.8個月,P=0.022)均有一定的改善,因此FDA批準其作為治療晚期HCC的二線藥物[15](表2)。
3 ICI聯合用藥在肝癌中的應用
3.1 ICI聯合血管內皮生長因子(vascular endothelial growth factor,VEGF)抑制劑
HCC的發生、進展和轉移與病理性血管生成密切相關。促血管生成因子VEGF在HCC中的水平升高,其可通過誘導異常腫瘤血管的形成,導致局部缺氧和腫瘤酸性微環境的形成,從而有利于癌細胞的生長和轉移[16-19]。此外,VEGF也可通過影響TIME,如阻礙免疫效應細胞浸潤、招募Treg和MDSC以及抑制T淋巴細胞增殖和DC成熟等途經間接促進腫瘤的生長[20]。VEGF和血管內皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)抑制劑可促進血管正常化,抑制腫瘤的惡性生物學行為,增強抗腫瘤免疫反應[21]。有研究顯示,VEGF/VEGFR抑制劑能通過促進腫瘤內T淋巴細胞浸潤和逆轉VEGF介導的免疫抑制發揮增強PD-1單抗和PD-L1單抗療效的作用[22]。
阿特珠單抗是一種靶向PD-L1的單克隆抗體,可以通過阻斷PD-L1與PD-1或CD80(B7-1)的結合提高T淋巴細胞的活化狀態[23];貝伐珠單抗(bevacizumab)是一種VEGF抑制劑,通過抑制血管生成發揮抗腫瘤作用[24]。2018年的一項開放性、多中心Ⅰb期臨床試驗GO30140(NCT02715531)發現,阿特珠單抗與貝伐珠單抗聯合治療有助于提高晚期HCC的整體療效[25-26]。隨后,為了進一步確定阿特珠單抗聯合貝伐珠單抗在晚期HCC治療中的療效和安全性,研究者發起了一項覆蓋全球17個國家/地區的111家醫院/癌癥中心的開放性、多中心、隨機Ⅲ期臨床試驗IMbrave150(NCT03434379)[27-28]。研究者將晚期HCC患者隨機分為阿特珠單抗聯合貝伐珠單抗治療組(336例)和索拉非尼對照組(165例),阿特珠單抗聯合貝伐珠單抗組每3周靜脈注射1 200 mg阿特珠單抗加15 mg/kg貝伐珠單抗1次,索拉非尼組每天口服索拉非尼(400 mg/次)2次,直到出現不可耐受的不良反應或失去臨床獲益為止。在中位隨訪15.6個月后,與索拉非尼組相比,阿特珠單抗聯合貝伐珠單抗治療組的死亡風險比(hazard ratio,HR)降低了42%(HR=0.58,P<0.001),mOS提高了5.8個月(13.4個月vs19.2個月,P<0.000 1),mPFS延長了2.5個月(4.3個月vs6.8個月,P<0.000 1)。值得注意的是,這項研究中還包括了中國隊列的194例晚期HCC患者(阿特珠單抗聯合貝伐珠單抗治療組133例,索拉非尼組61例);結果顯示,與索拉非尼對照組相比,阿特珠單抗聯合貝伐珠單抗治療組可以顯著延長患者的mOS(11.4個月vs24.0個月,P=0.001 9),提示聯合治療同樣適用于中國晚期HCC患者,并可能有更好的治療效果[29]。在安全性方面,阿特珠單抗聯合貝伐珠單抗組與索拉非尼組的3~4級不良事件發生率分別為63%和57%,基本一致;主要表現為高血壓、疲勞、蛋白尿以及天冬氨酸轉氨酶升高等[27-29](表2)。
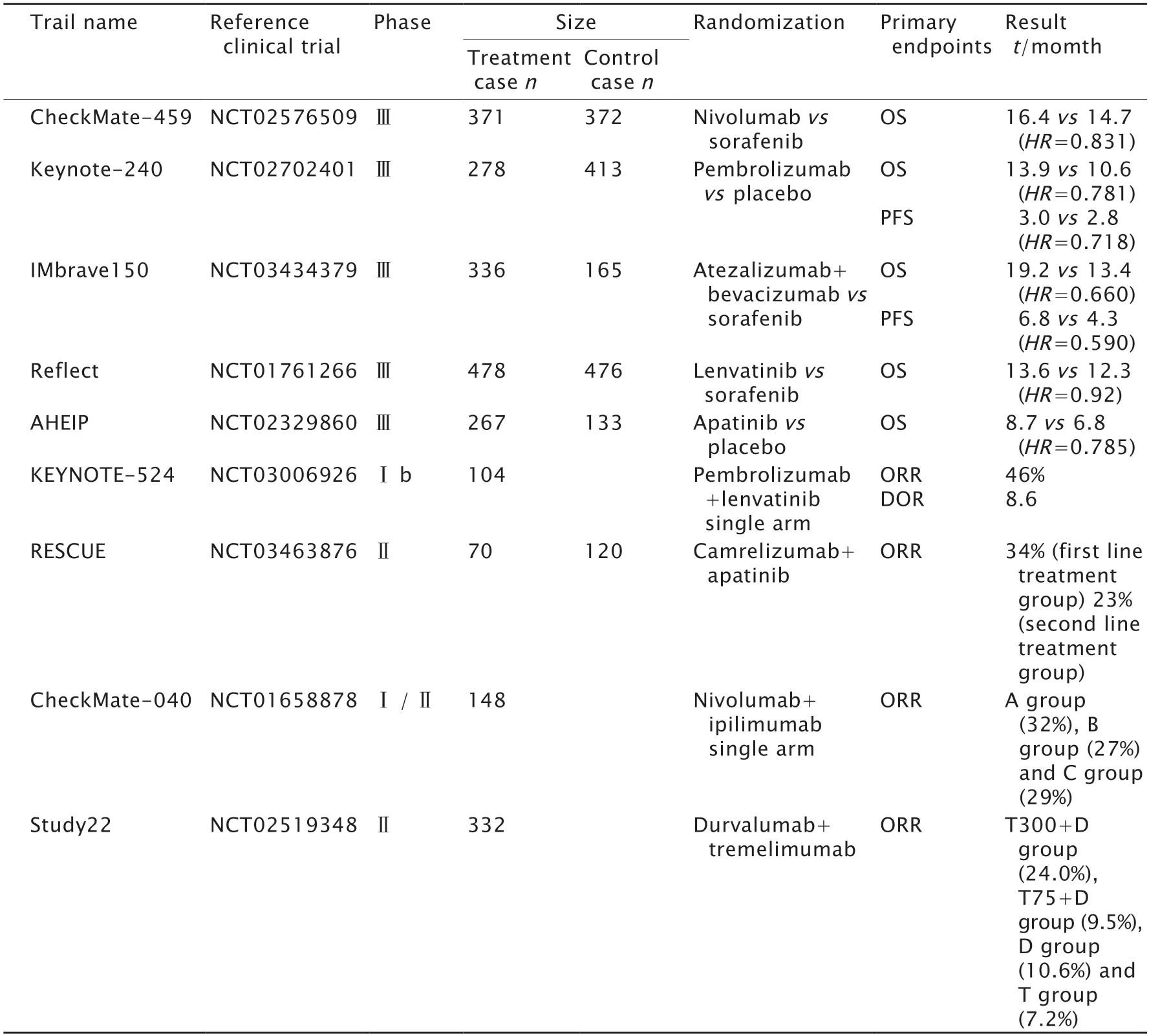
表2 免疫檢查點抑制劑用于晚期肝癌治療的臨床試驗Table 2 Clinical trials of immune checkpoint inhibitors in the treatment of advanced HCC
上述IMbrave150是一項具有里程碑意義的臨床試驗,該研究開創了HCC雙靶向聯合用藥的成功先例。在目前所完成的8項晚期HCC一線藥物臨床試驗中,阿特珠單抗聯合貝伐珠單抗對提高mOS和mPFS的效果均位于第一[30],優于納武單抗等ICI及索拉非尼和舒尼替尼(sunitinib)等酪氨酸激酶抑制劑(tyrosine kinase inhibitors,TKIs)的單藥治療效果。基于這些研究結果,阿特珠單抗聯合貝伐珠單抗已在全球70多個國家獲得了批準,用于治療以往未接受系統治療的不可切除性HCC。
3.2 ICI聯合TKI
TKI的主要靶點包括血管內皮細胞表面的VEGFR,以及腫瘤細胞表面的表皮生長因子受體(epidermal growth factor receptor,EGFR)、成纖維細胞生長因子受體(fibroblast growth factor receptor,FGFR)和血小板衍生生長因子受體(platelet-derived growth factor receptor,PDGFR)等多種生長因子受體。TKI通過阻斷上述靶點,抑制其下游的Raf(rapidly accelerated fibrosarcoma)/絲裂原活化蛋白激酶激 酶(mitogen-activated protein kinase kinase,MEK)/細胞外信號調節激酶(extracellular signal-regulated kinase,ERK)等信號轉導通路,進而抑制腫瘤血管的形成和腫瘤細胞的增殖[31]。常見的TKI藥物主要有索拉非尼、侖伐替尼和阿帕替尼(apatinib)。索拉非尼以多種酪氨酸激酶為靶點,是第一個用于治療晚期HCC的一線藥物[32];侖伐替尼的主要靶點有VEGFR1~3、FGFR1~4、PDGFRα、RET(rearranged during transfection proto-oncogene)和KIT,2018年FDA批準其作為晚期HCC患者的一線治療藥物[33];阿帕替尼是一種選擇性的VEGFR2酪氨酸激酶抑制劑,在2020年正式獲得NMPA批準,用于治療既往一線藥物治療失敗或不耐受一線藥物的晚期HCC患者[34]。
一項開放性、多中心、Ⅰb期臨床試驗Keynote-524(NCT03006926)觀察了帕博利珠單抗聯合侖伐替尼在治療晚期HCC中的療效和安全性。研究結果顯示,聯合治療組的主要終點客觀緩解率(objective response rate,ORR)為46%,mOS為22.0個月。雖然mOS和ORR等臨床數據顯示帕博利珠單抗聯合侖伐替尼具有顯著的臨床獲益,但這僅是Ⅰb期臨床試驗數據,且缺少對照,因此該聯合療法能否作為晚期HCC一線治療方案還有待于正在進行的Ⅲ期臨床試驗(NCT03713593)[35]予以進一步證實。在另一項開放性、非隨機Ⅱ期臨床試驗Rescue(NCT03463876)中,卡瑞利珠單抗(PD-1單抗)聯合阿帕替尼治療晚期HCC在mOS(20.3個月)和ORR(34.3%)指標上展現出較好的臨床獲益,但其不良事件的發生率也較高(78.6%),主要為高血壓、γ-谷氨酰轉移酶以及中性粒細胞減少等,研究人員推測可能與組內納入的乙型肝炎病毒(hepatitis B virus,HBV)相關性HCC患者比例(88.6%)較高有關[36]。
3.3 兩種ICI的聯合治療
CTLA-4在T淋巴細胞活化早期表達上調,它與T淋巴細胞表面的共刺激受體CD28競爭結合抗原提呈細胞表面的CD80(B7-1)和CD86(B7-2),從而抑制T淋巴細胞的早期活化。單獨使用CTLA-4抗體可以提高腫瘤內CD4+T淋巴細胞的活化能力[37]。
在一項研究納武單抗聯合伊匹木單抗(CTLA-4單抗)治療晚期HCC的開放性、多中心、Ⅰ/Ⅱ期臨床試驗CheckMate-040(NCT01658878)中,148例曾經接受過索拉非尼治療的患者根據單抗的不同劑量隨機分為3組。A組方案為1 mg/kg納武單抗+3 mg/kg伊匹木單抗,每3周1次,共4次;隨后給予納武單抗240 mg,每2周1次。B組方案為3 mg/kg納武單抗+1 mg/kg伊匹木單抗,每3周1次,共4次;隨后給予納武單抗240 mg,每2周1次。C組方案為每2周1次3 mg/kg納武單抗+每6周1次1 mg/kg伊匹木單抗。結果顯示,A組患者的mOS為22.8個月,明顯長于B組的12.5個月和C組的12.7個月;因此A組治療方案經FDA獲批作為晚期HCC的二線療法。目前,A組方案聯合一線藥物索拉非尼或侖伐替尼治療晚期HCC的療效比較試驗正在進行中(NCT04039607)[38](表2)。
一項開放性、多中心的Ⅱ期臨床試驗Study22(NCT02519348)評估了德瓦魯單抗(durvalumab)(PD-L1單抗)和曲美木單抗(tremelimumab)(CTLA-4單抗)聯合治療對晚期HCC患者的療效和安全性。將332例對索拉非尼不耐受或無效HCC患者隨機分為4組:T300+D組方案、T75+D組方案、T單藥組方案和D單藥組方案;T300+D組方案為同時給予曲美木單抗300 mg+德瓦魯單抗1 500 mg 1次,隨后每4周給予德瓦魯單抗1500 mg 1次;T75+D組方案為每4周給予曲美木單抗75 mg+德瓦魯單抗1 500 mg 1次,4次后每4周再給予德瓦魯單抗1 500 mg 1次;T單藥組方案為單用曲美木單抗750 mg,前7個療程每4周1次,之后每12周1次;D單藥組方案為單用德瓦魯單抗1 500 mg,每4周1次。研究結果顯示,T300+D組的mOS長達18.73個月,ORR為24%,并且安全性較高。鑒于Study 22研究中T300+D組所表現出的良好療效和安全性,目前正在開展該方案與索拉非尼相對比的Ⅲ期臨床試驗(NCT03298451),以期將T300+D方案能作為一線方案用于晚期HCC的治療中[39](表2)。
除了PD-1單抗、PD-L1單抗和CTLA-4單抗等IC,在TIME中還存在其他免疫抑制分子,如LAG-3和TIM-3等也可以協助癌細胞逃避免疫監視。目前LAG-3單抗聯合PD-1單抗(NCT01968109)以及TIM-3單抗聯合PD-L1單抗(NCT03099109)的臨床試驗正在晚期HCC患者中進行[40]。
3.4 ICI聯合局部治療
對于不可切除的中期HCC,TACE和RFA等局部治療是最常見的治療方法。TACE和RFA不僅可以促使癌細胞的死亡,同時也能增強機體的抗腫瘤免疫狀態,表現為外周血中CD4+和CD8+T淋巴細胞數量增加,Treg和MDSC數量減少等[41]。然而,局部治療所誘導的抗腫瘤免疫反應維持時間較短[42],因此ICI聯合局部治療可能有助于通過促進記憶性T淋巴細胞的發育而維持患者的抗腫瘤反應。在一項小型的臨床試驗中(NCT01853618),研究者對32例晚期HCC患者采用了曲美木單抗聯合RFA的治療方法,研究結果顯示,聯合治療組的mOS為12.3個月,相較于RFA治療組的10.1個月有了一定的延長,提示該聯合治療可能是一種潛在的治療晚期HCC的新方法[43]。最近,一項評估TACE聯合貝伐珠單抗和德瓦魯單抗對晚期HCC療效的Ⅲ期研究(NCT03778957)也正在在招募中。這些已完成或正在進行的臨床試驗有望為晚期HCC患者提供更多有效的治療策略。
4 問題與展望
雖然ICI治療在晚期HCC中顯示了較大的潛力,但仍有許多需要進一步探討的問題。(1)如何降低免疫治療的不良反應和耐藥性。ICI所引起的免疫相關不良事件(immune-related adverse event,irAE)發生率較高,并且可能累及所有器官,甚至危及生命[44]。所幸大部分irAE是可控的,一項薈萃分析表明納武單抗和帕博利珠單抗相關的irAE主要發生在惡性黑素瘤 和NSCLC中[45]。NSCLC中,無EGFR基因和間變性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因突變且高表達PD-L1的患者,在使用帕博利珠單抗聯合伊匹木單抗方案后,不僅mOS和mPFS沒有獲益,反而增加了治療的不良反應和死亡風險[46-47]。但從目前HCC中的臨床研究結果來看,ICI免疫聯合治療在改善mOS、mPFS和ORR的同時僅輕度增加irAE的發生率,irAE整體上仍然可控[27-28,35,38-39]。(2)如何篩選出能有效預測ICI療效的生物標志物,以減輕患者的不良反應和不必要的經濟負擔。在NSCLC中,PD-L1表達低(<1%)患者在接受納武單抗聯合伊匹木單抗治療時的療效優于PD-L1表達高者(≥1%)[48],提示PD-L1表達水平可以用作療效預測指標[49-51],但在晚期HCC的臨床試驗中,腫瘤細胞表面PD-L1表達水平的高低對納武單抗[52]或帕博利珠單抗[53]治療的客觀反應率均未見影響,因此目前仍需積極尋找與HCC免疫治療效果密切相關的標志物。(3)如何優化VEGF/VEGFR抑制劑、TKI和ICI三者的劑量和給藥順序,以期達到最佳的治療效果。(4)ICI及其聯合治療方案能否用于早期和中期HCC患者,目前尚缺乏相關的臨床試驗。(5)如何將ICI低反應或無反應者轉變為ICI高反應者,增加ICI的適用人群。總之,ICI是繼索拉非尼之后又一新的里程碑式的生物療法,它能給晚期HCC患者帶來生存獲益。隨著治療方案的不斷個體化和精準化,其療效和安全性也將得到進一步提高,最終應用于越來越多的HCC患者。