真實世界研究助力我國基本藥物制度改革
李卓陽,吳玉高,張晨曦,雷紅濤,方 菁
(昆明醫科大學健康研究所,昆明 650500)
實施基本藥物制度是黨中央、國務院在衛生健康領域作出的重要戰略部署,是深化醫藥衛生體制改革、強化基本公共衛生服務的重要舉措。為改變1982年以來只有基本藥物目錄、沒有基本藥物制度的狀況,我國于2009年開始建立基本藥物制度,并不斷發展至今,實現了省級招標采購、零差率銷售,完善了藥物從研發、生產、流通到使用等多環節的制度安排。隨著經濟社會的發展和醫療改革的不斷深化,我國基本藥物制度暴露出基本藥物無法完全適應臨床基本用藥需求、基本藥物仿制品種與原研品種質量療效差異顯著、保障供應機制不健全等缺陷[1]。2020年,國家藥品監督管理局頒布《真實世界證據支持藥物研發與審評的指導原則(試行)》,鼓勵應用真實世界數據(real-world data,RWD)研發與評價藥物,強調RWD在我國藥物監管決策中的重要地位。該文件對解決基本藥物制度的現存問題具有重要導向作用。本文通過總結現階段真實世界研究(real-world study,RWS)在我國基本藥物制度改革中的應用,進一步分析其如何加快推動我國基本藥物制度改革。
1 RWS的定義及現狀
1.1 概念及發展
RWS產生于新藥研發和醫療器械Ⅲ期臨床試驗中。在現有研究方法不足以解決某些臨床診療和醫療管理相關決策問題的情況下,考慮建立一種更接近臨床真實條件的方法體系,收集與研究對象健康狀況、診療及保健有關的RWD,經過清洗、整理、分析,獲得藥物的使用情況、潛在獲益或風險的臨床證據,即真實世界證據(real-world evidence,RWE)[2],以回答傳統Ⅲ期臨床試驗無法解釋的科學問題,如研發藥物的實際治療效果以及同類藥物不同產品間的比較效果等。隨著對RWS認識的加深,其運用也得到了進一步擴展。評估患者健康狀況和疾病診療過程、評估防治結局、評估患者預后以及預測、支持醫療政策制定是RWS目前主要解決的4類問題[3]。
1.2 國外應用RWS現況
對于使用RWD對醫療產品進行評價,多個國家已經積累了豐富的實踐經驗。2016年12月,美國通過了《21世紀治愈法案》,支持美國食品藥品監督管理局開展研究并使用RWE支持藥物和醫療器械等醫療產品的監管決策,以推動醫藥產品開發[4]。2013年,歐洲藥品管理局參加了GetReal Initiative項目[5],意在開發收集RWD和有效綜合RWE的新方法,以更早地將其運用于藥物研發和醫療管理決策過程中。在國際人用藥品注冊技術要求協調會上,日本藥品和醫療器械管理局提出了真實世界技術要求新議題,以高效利用RWD促進上市后藥物流行病學研究[6]。
2 RWS在我國基本藥物制度中的應用
作為醫藥衛生體制中的重要組成部分,我國的基本藥物制度需要不斷改革發展。當前我國基本藥物制度在實施過程中仍暴露出較多缺陷,如臨床基本用藥需求與基本藥物配備不完全適應、缺乏基本藥物使用激勵機制、仿制藥與原研藥質量和療效存在差距、藥品供應保障機制還不健全等,亟需順應國情,完善頂層制度設計,推動相關政策出臺[7]。
我國目前已開始使用RWE支持藥物監管決策。2020年,國家藥品監督管理局先后發布《真實世界證據支持藥物研發與審評的指導原則(試行)》和《真實世界研究支持兒童藥物研發與審評的技術指導原則(試行)》,強調了RWD在藥物監管決策中的適用范圍和地位,并厘清了藥物研發和監管決策中RWE的相關定義,鼓勵探究RWD的評價原則,通過收集RWD和評估適用性,為醫藥產品制造商和藥物監管部門應用RWD進行藥物監管決策提供參考。近幾年,我國學者通過對RWD的收集與治理,利用傾向性評分、工具變量法等統計學方法控制混雜因素,嚴格按照科學的程序分析RWD[8-9],獲得了國內部分藥物的使用情況、潛在獲益或風險的更為可靠的臨床證據,為基本藥物決策監管提供了科學依據。圖1和圖2分別顯示了傾向性評分法和工具變量法在真實世界藥物療效評估中的應用程序。
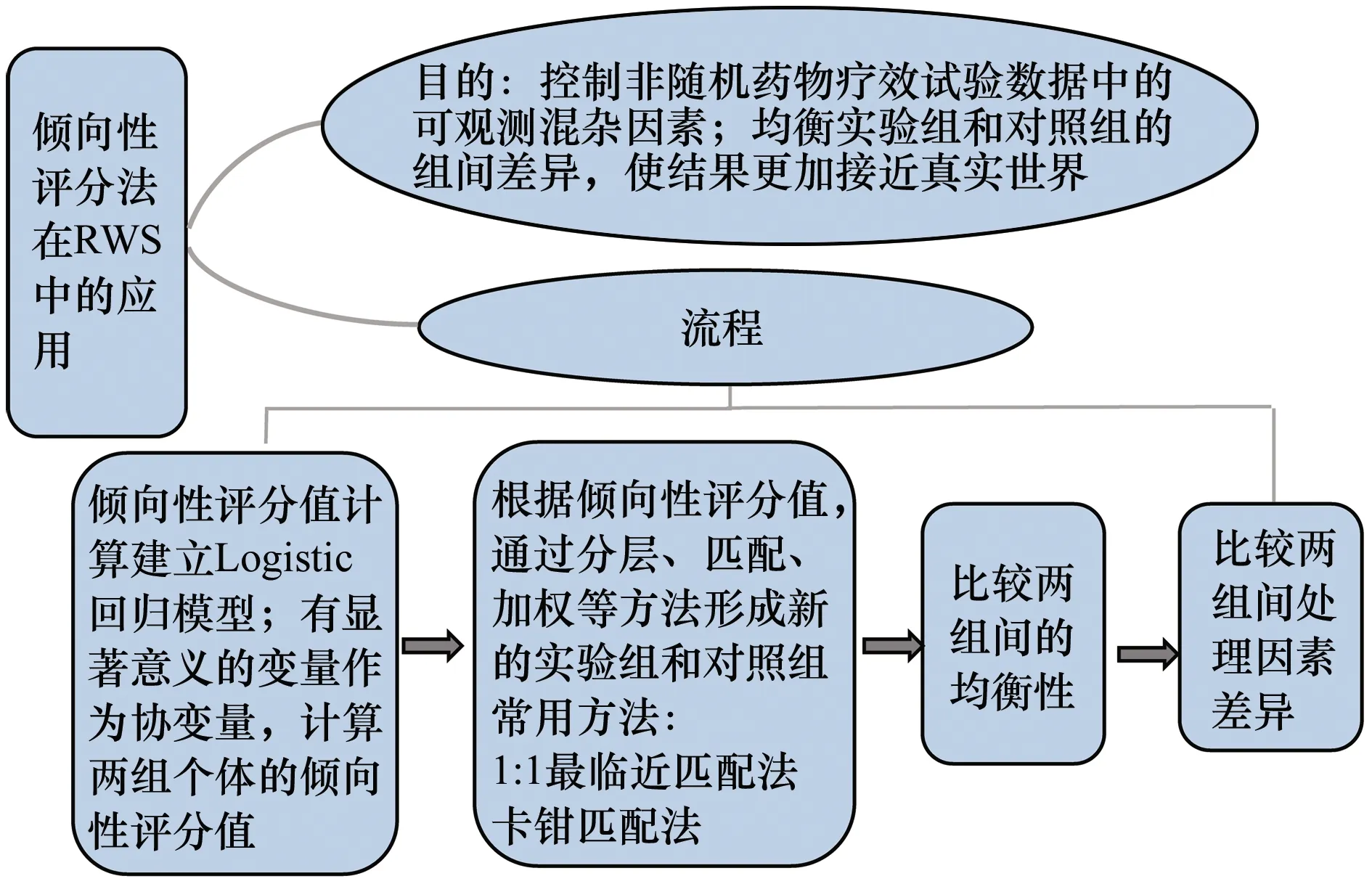
圖1 傾向性評分法在RWS中的應用
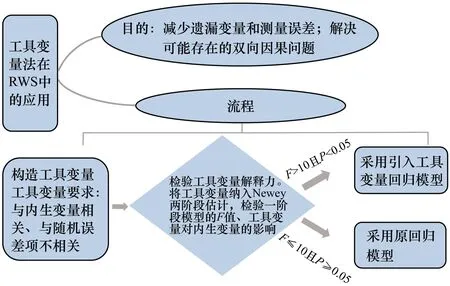
圖2 工具變量法在RWS中的應用
2.1 RWS為基本藥物遴選提供了更多科學的證據
基本藥物目錄作為基本藥物制度的核心環節,其品種數量的選擇、類別結構的設置都與基本藥物制度的實施效果緊密相關。基本藥物遴選程序為:確定目標疾病及其備選藥物、針對備選藥物開展證據評價、根據評價結果撰寫專家推薦意見,多方論證后由專家委員會審定。其中,證據評價主要指評價藥物有效性、安全性、成本、成本-效果等幾個方面的證據[10]。我國于1982年頒布了第一版《國家基本藥物目錄》,并于2002年修訂時開始將循證評價與決策應用于藥物遴選過程中,主要采用全國范圍的專家循證評價、課題方式的系統循證評價和專職隊伍的重點循證評價等方法[11]。2018年我國基本藥物目錄第九版調整完成,其中包含西藥417種、中藥268種,循證醫學原理和延伸方法應用為藥物品種的調入和調出、藥物療效和安全性以及經濟性提供了證據支持[12]。近幾年,有學者沿著循證醫學的思路,設計基于真實世界的實效性隨機對照試驗(pragmatic randomized controlled trial,pRCT)和建立患者登記數據庫,對新上市藥品開展早期療效評價、對上市后藥品開展實際使用效果或相對效果研究、分析常見的不良反應發生情況[13],以評價藥物的臨床診療效果,為基本藥物的遴選提供新的研究思路。成馮鏡茗等以血栓彈力圖的檢測作為客觀評價指標,驗證注射用丹參多酚酸鹽與阿司匹林聯用治療冠心病心絞痛的療效,結果表明兩藥聯用可進一步加強治療效果[14]。董珍宇等追蹤監測應用松齡血脈康膠囊的原發性高血壓患者,比較分析其用藥后2周、4周、6周和8周的舒張壓,得出松齡血脈康膠囊能夠有效控制舒張壓、提高血壓達標率,具有良好的治療效果[15]。這些基于RWD分析不同藥物診療效果的研究為遴選規范有效的基本藥物提供了有力的科學依據。表1總結了RWS中的pRCT與建立患者登記數據庫這2種藥物療效評價方法的目的、特點、適用情況,優缺點等[16-17]。

表1 2種RWD研究方法在藥物評價中的應用比較
2.2 RWS促進監測基本藥物配備情況
目前RWS在基本藥物配備方面的應用主要體現在運用各級醫院信息系統監測基本藥物采購配備金額和品種數量,通過縱向和橫向數據分析,判斷各級醫療機構是否按照要求配備基本藥物,為合理考核基本藥物配備情況提供清晰明確的獎懲依據。馬潔等通過醫院信息系統調取2012~2015年期間南京市31家不同類型的二、三級醫療衛生機構的藥物采購數據,分析不同年份各級醫療衛生機構基本藥物采購金額占藥物采購總額的比例、基本藥物配備品種數量占藥物總品種數比重,結果表明多數醫療衛生機構達不到原江蘇省衛生和計劃生育委員會的基本藥物配備要求,且醫療衛生機構類型、等級等因素會對基本藥物配備產生影響[18]。該研究有助于監督各級醫療機構科學合理合規地配備基本藥物,并為合理制定各級醫療機構基本藥物配備獎懲機制提供了參考依據。
2.3 RWS提升基本藥物質量監管水平,有利于開發已上市藥品的新用途
我國藥品監管機構日益重視RWS在藥品和醫療器械監管領域的應用,致力于推動RWS為新藥注冊上市提供有效性和安全性的證據、為已上市藥品說明書變更和藥品上市后再評價提供證據。目前已有學者基于回顧性RWD,運用Meta分析和推薦分級的評估、制訂與評價(grade of recommendations assessment,development and evaluation,GRADE質量評價),進一步探索和證實新上市藥品的新適應癥,為發現、鑒別和申請新適應癥提供重要支撐證據[19]。邊妍等通過檢索收集2008年1~3月期間硫酸氫氯吡格雷片仿制藥與原研藥對比研究的文獻并進行統計分析,結果表明硫酸氫氯吡格雷片仿制藥與原研藥的療效、安全性相當,且仿制藥具有明顯經濟學優勢[20]。
2.4 RWS推動中醫藥研究和療效評價
RWS在一定程度上可以推動名老中醫經驗方、中藥醫療機構院內制劑的人用經驗總結與臨床研發。在處方固定、生產工藝路線基本成型的基礎上,嘗試將RWS與隨機臨床對照試驗相結合,探索臨床研發的新路徑。中國中醫科學院建成了國內首個科研用醫療電子數據庫,收集電子病歷400余萬份,并對臨床用藥的安全性和有效性進行了研究,對真實世界用藥特征進行了分析[21];建設了中醫藥大數據中心和臨床數據共享系統,建立了6000余種臨床疾病模板庫,形成了中醫藥數據標準和共享管理,搭建了具有中醫藥特色的健康云平臺[22],推動了中醫藥的合理使用和質量監管。
3 展望
3.1 RWS在基本藥物目錄遴選中的應用前景
我國基本醫療衛生需求和基本醫療保障水平的變化,是基本藥物目錄中藥物品種和數量增減的依據之一。當前我國已有學者基于真實世界單病種定額付費對于醫院藥品、治療等費用和醫療服務質量等的影響開展研究,但缺乏對于基本藥物使用品種和數量等方面的研究。醫療衛生服務需求與基本醫療保障水平相互影響、相互作用[23],應用RWS分析不同醫保支付方式對基本藥物需求和使用的影響,可以為基本藥物目錄的合理遴選提供科學依據。
3.2 RWS在基本藥物生產供應保障中的應用前景
藥物生產成本增加、國家基本藥物指導價格過低和市場需求不足是基本藥物生產力不足的主要原因。基于藥物經濟學原理和藥物需求,合理定價是解決這一問題的最佳方法[24]。目前我國基本藥物招標采購采用“雙信封”制度,在招標前將經濟技術標書和商務標書分別裝入兩個信封,首先對經濟技術標開標,入圍者參與商務標評標,投標價低者中標。通過對RWD的收集和清理,快速準確掌握原料藥的價格及變動趨勢,并利用相關分析方法,促進完善“雙信封”評價體系,從而推動基本藥物合理制定最高限價和最終定價,以吸引和鼓勵藥物生產企業提高短缺基本藥物的生產供應。此外,當前我國短缺藥品信息直報系統中的信息相對滯后,供給雙方“信息不對稱”,導致基本藥物供應不及時。基于真實世界建立國家短缺藥品多源信息采集平臺迫在眉睫,以便跟蹤監測原料藥貨源、企業庫存和市場交易行為等情況,綜合研判潛在短缺因素和趨勢,盡早發現短缺風險,針對不同短缺原因分類應對。當前已有學者將RWS運用于“4+7”集采藥品政策實施中,通過分析不同省份間集采藥品的醫院使用情況、尋找集采藥品用量與采購金額的關系,為集采藥品采購價格和品種選擇提供科學依據,促進醫療機構制定合理的采購計劃,更好地滿足人民群眾的醫療需求[24]。但目前尚未形成統一高效的藥品管理平臺和短缺藥物多源信息采集平臺,可以依據中國真實世界數據與研究聯盟(China REal world data and studies Alliance,ChinaREAL)工作組制定的基于真實世界觀察性研究數據庫建立指南,充分考慮所建平臺的目的和影響因素,合理設計并形成有效的信息共享和預警監測平臺。
3.3 RWS在基本藥物使用中的應用前景
國務院辦公廳發布的《關于完善國家基本藥物制度的意見》中指出,要把加強基本藥物臨床使用監測和績效評估作為促進醫療機構優先使用基本藥物的措施[1]。監測基本藥物臨床使用需要加快建立健全基于真實世界的國家級和省級藥品使用監測平臺和全面立體的監測網絡體系。基于注冊登記患者和藥物使用人群信息,采用RWD分析方法對不同個案使用基本藥物數量、用藥頻次、痊愈與否等信息清洗處理,以開展基本藥物臨床綜合評價,指導臨床安全合理用藥。
4 結語
RWS在我國基本藥物上市前評價與監管中的應用仍處于早期探索階段。如何運用不同類別的RWD和由不同研究設計中獲得的RWE來評估藥物的臨床價值、推動政策的科學制定,還有待進一步研究[25]。ChinaREAL依據我國實際情況制定了相關技術規范,學者可基于此開展研究,以促進中國RWE的生產與應用。目前,我國RWS在基本藥物制度中的應用主要集中在基本藥物目錄遴選和不良藥物反應監測兩個方面,也有部分研究基于RWD分析基本醫療保險按病種付費政策對住院總費用、住院天數和個人負擔的影響,但對于基本藥物使用鮮有研究報道。未來可以加強RWS在基本藥物制度、醫療保障制度和分級診療制度之間關系研究中的應用,促進三者聯動發揮作用。同時,針對基本藥物生產供應和配備使用,可以基于RWD建立多源多環節信息監測平臺,以促進基本藥物制度的實施,使我國基本藥物制度政策更加完善。

