支氣管肺泡灌洗術聯合局部應用敏感抗菌藥物對COPD合并支氣管擴張患者血氣分析、炎癥因子及肺功能的影響*
曹洪麗,于 紅,石曼欣妤,木亞莎爾·吐遜江,阮昱豪,席家寧△
1.首都醫科大學附屬北京康復醫院呼吸科,北京 100144;2.首都醫科大學北京康復醫學院,北京 100144
慢性阻塞性肺疾病(COPD)是以持續、進行性發展的氣流受限為特征的呼吸系統疾病,包括急性加重期與穩定期,主要表現為慢性咳嗽、咳痰、氣短或呼吸困難,嚴重者可出現肺源性心臟病、呼吸衰竭,致殘率和病死率較高,嚴重影響患者的生存質量。支氣管擴張是以支氣管不可逆性擴張為特征的呼吸系統疾病,可能與慢性炎癥和纖維化影響支氣管壁的肌肉及彈性組織有關,最終引起支氣管的變形與長期擴張。以往認為COPD與支氣管擴張之間的相關性不大,但近年來發現COPD合并支氣管擴張患者在臨床上并不少見,目前認為支氣管擴張是COPD的并發癥之一,二者不僅能共存,且相互作用,形成惡性循環,但目前國內相關的研究并不多[1-2]。對于COPD合并支氣管擴張患者,以往臨床上主要給予抗炎、解痙、化痰、平喘、吸氧等治療,但療效不甚理想,可能與痰液不易清除有關。本研究前瞻性選取2017年6月至2019年1月本院收治的62例COPD合并支氣管擴張患者為研究對象,旨在探討支氣管肺泡灌洗術(BAL)聯合局部應用敏感抗菌藥物對COPD合并支氣管擴張患者血氣分析、炎癥因子及肺功能的影響。
1 資料與方法
1.1一般資料 選取2017年6月至2019年1月本院收治的62例COPD合并支氣管擴張患者為研究對象,其中男45例、女17例,年齡43~88歲、平均(67.33±18.00)歲。納入標準:(1)符合2017年慢性阻塞性肺疾病全球創議更新解讀中COPD的診斷標準[3];(2)符合成人支氣管擴張癥診斷專家共識編寫組制定的專家共識中的診斷標準[4];(3)基礎狀態可,能耐受支氣管鏡檢查。排除標準:(1)合并其他系統的感染;(2)合并哮喘、肺癌等其他肺臟疾病或有肺臟手術史;(3)心、肝、腦、腎等臟器的嚴重原發性疾病;(4)對所用的藥物過敏。本研究已通過醫院醫學倫理委員會的批準,所有患者均簽署相關的知情同意書。采用隨機數字表法將患者分為觀察組(31例)與對照組(31例),2組性別構成、年齡、病程比較,差異無統計學意義(P>0.05),具有可比性,見表1。

表1 2組一般資料比較
1.2方法 對照組:入院后進行血常規、血培養、痰培養、血氣分析、肺功能等常規檢查,同時行胸部高分辨率螺旋CT檢查,初步確定感染部位,并給予靜脈滴注敏感抗菌藥物、吸氧、解痙、化痰、平喘、體位引流、無創呼吸機輔助通氣等常規干預措施。觀察組:在對照組基礎上,采用日本奧林巴斯公司提供的BF260型電子支氣管鏡行BAL。常規進行術前準備、局部麻醉(2%利多卡因霧化吸入)與心電監測,經鼻腔插入纖維支氣管鏡,吸凈呼吸道內的分泌物與痰液,留取痰液送檢,然后根據術前胸部螺旋CT檢查結果及支氣管鏡下所見來確定感染部位,然后針對性進行BAL,灌洗時每次灌入生理鹽水(0.9%氯化鈉注射液)10~20 mL,反復抽吸,每次持續時間不超過20 s,每次灌洗后應盡量吸凈灌洗液與分泌物,直到病變處的分泌物被完全清除,總灌洗液≤120 mL,并且在灌洗后局部應用敏感抗菌藥物,將抗菌藥物注入病變的段或亞段支氣管內,觀察組患者每周BAL干預2~3次。全部患者干預2周后評估治療情況。
1.3觀察指標
1.3.1血氣分析 分別在干預前、干預2周后采集所有患者橈動脈血2 mL,采用丹麥Radiometer公司生產的ABL80型血氣分析儀檢測動脈血氧分壓(PaO2)、二氧化碳分壓(PaCO2)及血氧飽和度(SaO2)。
1.3.2血清炎癥因子 分別在干預前、干預2周后采集所有患者清晨空腹靜脈血5 mL,以3 000 r/min離心5 min,取血清置于冰箱中保存待測。采用酶聯免疫吸附試驗檢測白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)、血清超敏C反應蛋白(hs-CRP)等炎癥因子水平,全部操作均嚴格按照說明書進行操作。
1.3.3肺功能 在干預前、干預2周后采用日本福田產業株式會社生產的ST-130 肺通氣功能檢測儀檢測所有患者的肺功能,包括肺活量(VC)、第一秒用力呼氣容積(FEV1)與用力肺活量(FVC)。
1.3.4臨床療效 采用下列標準判斷患者的臨床療效[5]:(1)顯效,典型癥狀和體征基本消失,體溫、血白細胞計數恢復正常,痰量明顯減少,咳嗽、胸悶、氣促明顯好轉,肺部啰音消失或減少,胸部CT提示氣道炎癥基本吸收,痰培養轉為陰性;(2)有效,典型癥狀和體征有所改善,體溫、血白細胞計數下降,痰量有所減少,咳嗽、胸悶、氣促有所好轉,肺部啰音減少,胸部CT提示氣道炎癥部分吸收;(3)無效:干預后患者臨床癥狀、體征與肺功能指標無明顯變化,或繼續惡化。有效率=(顯效例數+有效例數)/總例數×100%。

2 結 果
2.12組干預前后血氣分析結果比較 2組干預前PaO2、PaCO2、SaO2差異均無統計學意義(P>0.05);2組干預后PaO2、SaO2均高于干預前,且觀察組高于對照組(P<0.05),而PaCO2則低于干預前,且觀察組低于對照組(P<0.05),見表2。
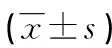
表2 2組患者干預前后的PaO2、PaCO2、SaO2比較
2.22組干預前后血清炎癥因子水平比較 2組干預前血清IL-6、TNF-α、hs-CRP水平差異無統計學意義(P>0.05);2組干預后血清IL-6、TNF-α、hs-CRP水平均低于干預前,且觀察組低于對照組(P<0.05),見表3。
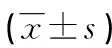
表3 2組干預前后血清IL-6、TNF-α、hs-CRP水平比較
2.32組干預前后肺功能比較 2組干預前VC、FEV1、FEV1/FVC差異無統計學意義(P>0.05);2組干預后VC、FEV1、FEV1/FVC均高于干預前,且觀察組高于對照組,差異有統計學意義(P<0.05),見表4。
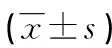
表4 2組干預前后VC、FEV1、FEV1/FVC比較
2.42組臨床療效比較 觀察組臨床療效優于對照組,差異有統計學意義(P<0.05),見表5。

表5 2組臨床療效比較[n(%)]
3 討 論
目前認為COPD與支氣管擴張本質上都是呼吸系統的慢性炎癥性疾病,二者可合并存在,相互作用,均可出現支氣管的阻塞與感染,加重了咳嗽、咳痰、氣促、呼吸困難等臨床癥狀,肺功能更差,也加大了臨床的治療難度。氣道的慢性炎性反應可通過多種介質來破壞支氣管壁與肺組織的結構,促進支氣管擴張的發生,同時也降低了氣道纖毛上皮的清潔能力,進一步加重了感染,導致惡性循環,尤其是COPD晚期患者,其呼吸道黏膜容易出現萎縮性病變,從而促進支氣管周圍組織的增生與擴張。因此,抗炎一直是支氣管擴張的重要治療措施,但當前抗菌藥物的濫用現象較為嚴重,且靜脈用藥難以在肺臟達到較高的藥物濃度峰值,故臨床上急需改善常規抗感染的方法。
隨著內鏡微創手術及器械的發展,纖維支氣管鏡已廣泛用于呼吸系統疾病的診治,除了能通過直接觀察呼吸道來進行疾病的診斷外,還能進行直視下操作與治療,其中BAL是通過纖維支氣管鏡對發生感染的肺葉或肺段進行反復的生理鹽水沖洗,以清除呼吸道內的分泌物及痰液,改善支氣管的阻塞現象。既往多個研究證實BAL對支氣管擴張合并感染患者[6-10]、COPD急性加重期患者[11-12]、肺炎患者[13-15]的應用效果突出,能緩解炎性反應,提高臨床療效。但是,BAL仍有一定的缺點,包括操作復雜,患者容易出現不耐受現象。
本研究前瞻性選取了62例COPD合并支氣管擴張患者為研究對象,采用隨機數字表法將患者分為對照組(常規干預,31例)和觀察組(BAL及局部應用敏感抗菌藥物干預,31例)。干預后對照組血氣分析、全身炎性反應與肺功能均有一定改善,而觀察組的療效更加突出,表現為干預后PaO2、SaO2、VC、FEV1、FEV1/FVC均明顯高于對照組(P<0.05),PaCO2及血清IL-6、TNF-α、hs-CRP水平均明顯低于對照組(P<0.05),并且觀察組顯效率達到61.3%,明顯高于對照組的38.7%(P<0.05)。分析其原因,一方面是由于BAL能直接清洗殘留在呼吸道的分泌物與痰液,同時刺激分泌物的排出,促進肺不張的恢復,通暢呼吸道,改善肺功能,提高SaO2,緩解臨床癥狀體征;另一方面可能與其抗菌藥物的局部應用有關,在灌洗結束后局部給予敏感的抗菌藥物能提高藥物在肺臟的濃度峰值,更高效地抑制或殺滅感染部位的細菌,減輕炎性反應,增強了抗感染的療效,促進早日康復,改善耐藥現象,且纖維支氣管鏡能直接觀察呼吸道的病變特點與活動程度,獲得被菌群污染較少的感染病變組織,更有效地實施痰培養及藥敏試驗,提高結果的準確性,以便更準確地發現感染病原體,篩選出敏感性較高的抗菌藥物,提高抗炎療效[16]。
綜上所述,BAL聯合局部應用敏感抗菌藥物能改善COPD合并支氣管擴張患者的血氣分析結果,降低血清炎癥因子水平,促進肺功能的康復,臨床療效明顯,值得臨床推廣應用。

